Fe (железо) – элемент с прядковым номером 26 в периодической системе.
Находится в IV периоде. Температура плавления: 1535 ℃. Плотность: 7.87 г/см3.
Электронная формула атома железа в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Электронная формула атома железа в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращенная электронная конфигурация Fe:
[Ar] 3d6 4s2
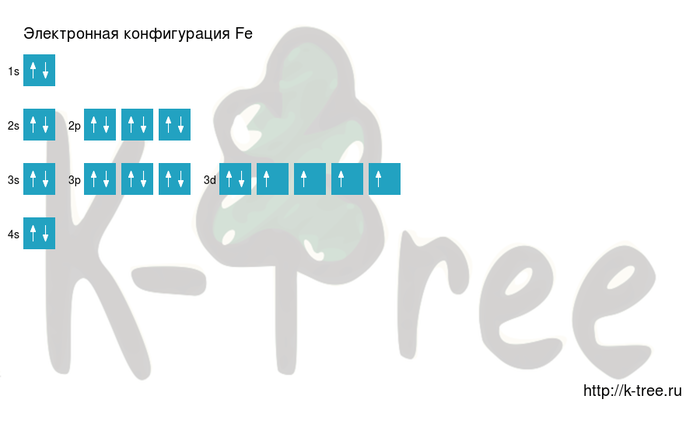
Ниже приведена электронно-графическая схема атома железа
Распределение электронов по энергетическим уровням в атоме Fe
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 14
4-й уровень (N): 2
Валентные электроны железа
Количество валентных электронов в атоме железа – 8.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | 0 | +1/2 |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
| d | 3 | 2 | -2 | -1/2 |
Степени окисления, которые может проявлять железо: +1, +2, +3, +4, +5, +6
Электронное строение атома железа
Электронное строение нейтрального атома железа в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме железа.
Fe
+26
2
8
14
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме железа.
| 4 | ↑↓ | |||||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома железа выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома железа.
26Fe 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращённая электронная конфигурация атома железа.
26Fe [Ar] 3d6 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома железа.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3d | 3 | 2 | -2 | +½ |
| -½ | ||||
| 0 | +½ | |||
| 1 | +½ | |||
| 2 | +½ | |||
| 3 | +½ | |||
| 4s | 4 | 0 | 0 | +½ |
| -½ |
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,893 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Железо — химический элемент (№) (26), расположенный в побочной подгруппе (VIII) группы, в четвёртом периоде.
Это (d)-элемент. В его атоме на (d)-орбиталях третьего электронного слоя находится (6) электронов, а на (s)-орбитали четвёртого слоя — (2) электрона:
1s22s22p63s23p63d64s2
.
Электронно-графическая схема атома железа выглядит следующим образом:
В образовании химических связей участвуют электроны внешнего и предвнешнего уровней, поэтому у железа переменные степени окисления. Наиболее устойчивы соединения со степенями окисления (+2), (+3).
Нахождение в природе и получение
По содержанию в природе железо занимает второе место среди всех металлов (после алюминия) и первое — среди металлов (B)-групп. Важнейшие железные руды: красный железняк (гематит)
Fe2O3
, магнитный железняк (магнетит)
Fe3O4
, бурый железняк (лимонит)
Fe2O3⋅H2O
, железный колчедан (пирит)
FeS2
.
|
|
|
|
|
|
Рис. (1). Гематит |
Рис. (2). Магнетит |
Рис. (4). Пирит |
Для получения железа используют пирометаллургию, его восстанавливают коксом и угарным газом:
Fe2O3+3CO=t2Fe+3CO2.
Из железной руды в доменных печах получают чугун, который затем перерабатывают в сталь.
|
|
 |
|
Рис. (5). Чугун |
Рис. (6). Сталь |
В качестве восстановителя также используется водород:
Fe2O3+3H2=t2Fe+3H2O.
Физические свойства железа
Чистое железо — пластичный серебристо-серый металл, обладающий магнитными свойствами. Железо относится к тяжёлым тугоплавким металлам; его плотность составляет (7,874) г/см³, а температура плавления — (1539 °C).
В ряду активности железо располагается до водорода, относится к металлам средней активности. Во влажном воздухе оно реагирует с кислородом и водой и постепенно покрывается ржавчиной:
Fe+O2+H2O→Fe2O3⋅nH2O.
Железо вступает в реакции с неметаллами.
|
Реагенты |
Характеристика реакций |
Уравнения реакций |
| Галогены | Реакции идут при нагревании с образованием галогенидов железа((III)) |
2Fe+3Cl2=t2FeCl3 |
| Кислород | При нагревании в кислороде железо сгорает с образованием оксида железа((II), (III)) (железной окалины) |
3Fe+2O2=tFe3O4 |
| Сера | Реакция идёт при нагревании; образуется сульфид железа((II)) |
Fe+S=tFeS |
Железо реагирует с водой и вытесняет водород из кислот, реагирует с растворами некоторых солей, а также восстанавливает ионы
Fe3+
до
Fe2+
.
Железо пассивируется концентрированными азотной и серной кислотами, но при нагревании окисляется ими до соединений железа (+3).
|
Реагенты |
Характеристика реакций |
Уравнения реакций |
| Вода | Реагирует при нагревании с водяным паром, образуется оксид | 2Fe+3H2O=tFe2O3+3H2↑ |
| Кислоты-неокислители | Выделяется водород, образуются соли железа((II)) |
Fe+2HCl=FeCl2+H2↑; Fe+H2SO4(р)=FeSO4+H2↑ |
|
Серная концентрированная кислота |
Образуются сульфат железа((III)), сернистый газ и вода | 2Fe+6H2SO4(к)=tFe2(SO4)3+3SO2↑+6H2O |
| Азотная кислота | Образуются нитрат, вода и соединение азота |
Fe+4HNO3(р)=Fe(NO3)3+NO↑+2H2O |
| Растворы солей | Вытесняет из растворов солей менее активные металлы | Fe+Cu(NO3)2=Fe(NO3)2+Cu↓ |
| Соли железа((III)) | Образуются соли железа((II)) | Fe+2FeCl3=3FeCl2 |
Источники:
Рис. 1. Гематит. https://www.shutterstock.com/ru/image-photo/heap-natural-iron-ore-isolated-on-131632697. (Дата обращения: 20.01.2021).
Рис. 2. Магнетит. https://www.shutterstock.com/ru/image-photo/iron-ore-rocks-which-metallic-can-2205029847. (Дата обращения: 05.04.2023).
Рис. 3. Лимонит. https://www.shutterstock.com/ru/image-photo/macro-photography-natural-mineral-geological-collection-1274440675. (Дата обращения: 05.04.2023).
Рис. 4. Пирит. https://www.shutterstock.com/ru/image-photo/pyrite-mineral-sulfide-group-1734246830. (Дата обращения: 10.02.2020).
Рис. 5. Чугун. https://www.shutterstock.com/ru/image-photo/old-cast-iron-plumbing-fittings-1689109489. (Дата обращения: 05.04.2023).
Рис. 6. Сталь. https://www.shutterstock.com/ru/image-illustration/stack-stainless-steel-flat-bar-3d-2034297092. (Дата обращения: 04.03.2021).