Ba (барий) – элемент с прядковым номером 56 в периодической системе.
Находится в VI периоде. Температура плавления: 725 ℃. Плотность: 3.65 г/см3.
Электронная формула атома бария в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
Электронная формула атома бария в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2
Сокращенная электронная конфигурация Ba:
[Xe] 6s2
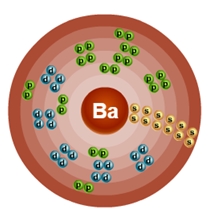
Ниже приведена электронно-графическая схема атома бария
Распределение электронов по энергетическим уровням в атоме Ba
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 18
4-й уровень (N): 18
5-й уровень (O): 8
6-й уровень (P): 2
Валентные электроны бария
Количество валентных электронов в атоме бария – 2.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 6 | 0 | 0 | +1/2 |
| s | 6 | 0 | 0 | -1/2 |
Степени окисления, которые может проявлять барий: +2
Электронное строение атома бария
Электронное строение нейтрального атома бария в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме бария.
Ba
+56
2
8
18
18
8
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме бария.
| 6 | ↑↓ | |||||||||||
| 5 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 4 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома бария выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома бария.
56Ba 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2
Сокращённая электронная конфигурация атома бария.
56Ba [Xe] 6s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома бария.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 6s | 6 | 0 | 0 | +½ |
| -½ |
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,653 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,926 -
разное
16,901
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Барий в таблице менделеева занимает 56 место, в 6 периоде.
| Символ | Ba |
| Номер | 56 |
| Атомный вес | 137.3270000 |
| Латинское название | Barium |
| Русское название | Барий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема бария
Ba: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
Короткая запись:
Ba: [Xe]6s2
Одинаковую электронную конфигурацию имеют
атом бария и
Cs-1, Ce+2, Pr+3, Nd+4
Порядок заполнения оболочек атома бария (Ba) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Барий имеет 56 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
Степень окисления бария
Атомы бария в соединениях имеют степени окисления 2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы бария
Валентность Ba
Атомы бария в соединениях проявляют валентность II.
Валентность бария характеризует способность атома Ba к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ba
Квантовые числа определяются последним электроном в конфигурации,
для атома Ba эти числа имеют значение N = 6, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Ba:
Eo = 503 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Ba в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Строение атома бария
- Общие сведения о строении атома бария
- Электронное строение атома бария
- Барий, свойства атома, химические и физические свойства
- Барий, свойства атома, химические и физические свойства.
- Атом и молекула бария. Формула бария. Строение бария:
- Изотопы и модификации бария:
- Свойства бария (таблица): температура, плотность, давление и пр.:
- Электронные формулы атомов химических элементов
- Электронные конфигурации элементов со 105 по 118
- Эмпирическое правило Клечковского
Строение атома бария
Общие сведения о строении атома бария
Относится к семейству s-элементов. Металл. Обозначение – Ba. Порядковый номер – 56. Относительная атомная масса – 137,34 а.е.м.
Электронное строение атома бария
Атом бария состоит из положительно заряженного ядра (+56), внутри которого есть 56 протонов и 81 нейтрон, а вокруг, по шести орбитам движутся 56 электронов.
Рис.1. Схематическое строение атома бария.
Распределение электронов по орбиталям выглядит следующим образом:
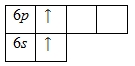
Внешний энергетический уровень атома бария содержит 2 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Для атома бария характерно наличие возбужденного состояния. Электроны 6s-подуровня распариваются и один из них занимает вакантную орбиталь 6p-подуровня:
Наличие двух неспаренных электронов свидетельствует о том, что для бария характерна степень окисления +2.
Валентные электроны атома бария можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Источник
Барий, свойства атома, химические и физические свойства
Барий, свойства атома, химические и физические свойства.
137,327(7) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2
Барий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 56. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), шестом периоде периодической системы.
Физические свойства бария
Атом и молекула бария. Формула бария. Строение бария:
Барий (лат. Barium, от др.-греч. βαρύς – «тяжёлый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ba и атомным номером 56. Расположен в 14-й группе (по старой классификации — главной подгруппе второй группы), шестом периоде периодической системы.
Барий – щёлочноземельный металл. Относится к группе лёгких, цветных металлов .
Барий обозначается символом Ba.
Как простое вещество барий при нормальных условиях представляет собой мягкий, ковкий щёлочноземельный металл серебристо-белого цвета.
Молекула бария одноатомна.
Химическая формула бария Ba.
Электронная конфигурация атома бария 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 . Потенциал ионизации (первый электрон) атома бария равен 502,85 кДж/моль (5,2116646(12) эВ).
Строение атома бария. Атом бария состоит из положительно заряженного ядра (+56), вокруг которого по шести атомным оболочкам движутся 56 электронов. При этом 54 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку барий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и пятая – внутренние оболочки представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома бария – на 6s-орбитали находится два спаренных электрона. Поэтому барий проявляет валентность II и степень окисления +2. В свою очередь ядро атома бария состоит из 56 протонов и 81 нейтрон. Барий относится к элементам s-семейства.
Радиус атома бария (вычисленный) составляет 253 пм.
Атомная масса атома бария составляет 137,327(7) а. е. м.
Барий обладает высокой химической активностью. Ядовит.
Изотопы и модификации бария:
Свойства бария (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Барий |
| 102 | Прежнее название | |
| 103 | Латинское название | Barium |
| 104 | Английское название | Barium |
| 105 | Символ | Ba |
| 106 | Атомный номер (номер в таблице) | 56 |
| 107 | Тип | Металл |
| 108 | Группа | Щёлочноземельный, лёгкий, цветной металл |
| 109 | Открыт | Карл Вильгельм Шееле и Иоганн Готлиб Ган, Швеция , 1774 г. |
| 110 | Год открытия | 1774 г. |
| 111 | Внешний вид и пр. | Мягкий, вязкий, ковкий металл серебристо-белого цвета. Ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации:
– α-барий с кубической объёмно-центрированной кристаллической решёткой, – β-барий |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,034 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10 -6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10 -6 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10 -6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00027 % |
| 124 | Содержание в организме человека (по массе) | 0,00003 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 137,327(7) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O8 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 253 пм |
| 205 | Эмпирический радиус атома* | 215 пм |
| 206 | Ковалентный радиус* | 215 пм |
| 207 | Радиус иона (кристаллический) | Ba 2+
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 268 пм |
| 209 | Электроны, Протоны, Нейтроны | 56 электронов, 56 протонов, 81 нейтрон |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | +1, +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 0,89 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 502,85 кДж/моль (5,2116646(12) эВ) |
| 305 | Электродный потенциал | Ba 2+ + 2e – → Ba, E o = -2,905 В |
| 306 | Энергия сродства атома к электрону | 13,954(6) кДж/моль (0,14462(6) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 3,51 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело),
3,338 г/см 3 (при температуре плавления 727 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 727 °C (1000 К, 1341 °F) |
| 403 | Температура кипения* | 1845 °C (2118 K, 3353 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 7,12 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 142 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,209 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 28,07 Дж/(K·моль) |
| 411 | Молярный объём | 39,1245 см³/моль |
| 412 | Теплопроводность | 18,4 Вт/(м·К) (при стандартных условиях ),
18,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-барий |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 5,020 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-39-3 |
205* Эмпирический радиус бария согласно [1] и [3] составляет 222 пм.
206* Ковалентный радиус бария согласно [1] и [3] составляет 215±11 пм и 198 пм соответственно.
401* Плотность бария согласно [3] и [4] составляет 3,5 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – твердое тело) и 3,76 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) соответственно.
402* Температура плавления бария согласно [3] составляет 728,85 °C (1002 K, 1343,93 °F).
403* Температура кипения бария согласно [3] и [4] составляет 1636,85 °C (1910 K, 2978,33 °F) и 1860 °C (2133,15 K, 3380 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) бария согласно [3] и [4] составляет 7,66 кДж/моль и 8,66 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) бария согласно [4] составляет 150,9 кДж/моль.
410* Молярная теплоёмкость бария согласно [3] составляет 28,1 Дж/(K·моль).
Источник
Электронные формулы атомов химических элементов
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s 1 2 He гелий 1s 2
| № | Знак | Элемент | Электронная формула |
| II период | |||
| 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 |
| № | Знак | Элемент | Электронная формула |
| III период | |||
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 |
| № | Знак | Элемент | Электронная формула |
| IV период | |||
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
| № | Знак | Элемент | Электронная формула |
| V период | |||
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 22 4d 10 5p 3 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 |
| № | Знак | Элемент | Электронная формула |
| VI период | |||
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 |
| № | Знак | Элемент | Электронная формула |
| VII период | |||
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f 0 |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 |
| 110 | Ds | дармштадтий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 8 |
| 111 | Rg | рентгений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 9 |
| 112 | Cn | коперниций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 |
| 113 | Nh | нихоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 1 |
| 114 | Fl | флеровий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 2 |
| 115 | Mс | московий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 3 |
| 116 | Lv | ливерморий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 4 |
| 117 | Ts | теннесcин | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 5 |
| 118 | Og | оганесон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 |
Электронные конфигурации элементов со 105 по 118
Электронные конфигурации элементов со 105 по 118 приведены согласно данных сайта WebElements
- 105 Db : [Rn].5f 14 .6d 3 .7s 2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2
- 106 Sg : [Rn].5f 14 .6d 4 .7s 2 (догадка, основанная на электронной конфигурации вольфрама) ; 2.8.18.32.32.12.2
- 107 Bh : [Rn].5f 14 .6d 5 .7s 2 (догадка, основанная на электронной конфигурации рения) ; 2.8.18.32.32.13.2
- 108 Hs : [Rn].5f 14 .6d 6 .7s 2 (догадка, основанная на электронной конфигурации осмия) ; 2.8.18.32.32.14.2
- 109 Mt : [Rn].5f 14 .6d 7 .7s 2 (догадка, основанная на электронной конфигурации иридия) ; 2.8.18.32.32.15.2
- 110 Ds : [Rn].5f 14 .6d 9 .7s 1 (догадка, основанная на электронной конфигурации платины) ; 2.8.18.32.32.17.1
- 111 Rg : [Rn].5f 14 .6d 10 .7s 1 (догадка, основанная на электронной конфигурации золота) ; 2.8.18.32.32.18.1
- 112 Cn : [Rn].5f 14 .6d 10 .7s 2 (догадка, основанная на электронной конфигурации ртути) ; 2.8.18.32.32.18.2
- 113 Uut : [Rn].5f 14 .6d 10 .7s 2 .7p 1 (догадка, основанная на электронной конфигурации таллия) ; 2.8.18.32.32.18.3
- 114 Fl : [Rn].5f 14 .6d 10 .7s 2 .7p 2 (догадка, основанная на электронной конфигурации свинца) ; 2.8.18.32.32.18.4
- 115 Uup : [Rn].5f 14 .6d 10 .7s 2 .7p 3 (догадка, основанная на электронной конфигурации висмута) ; 2.8.18.32.32.18.5
- 116 Lv : [Rn].5f 14 .6d 10 .7s 2 .7p 4 (догадка, основанная на электронной конфигурации полония) ; 2.8.18.32.32.18.6
- 117 Uus : [Rn].5f 14 .6d 10 .7s 2 .7p 5 (догадка, основанная на электронной конфигурации астата) ; 2.8.18.32.32.18.7
- 118 Uuo : [Rn].5f 14 .6d 10 .7s 2 .7p 6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Источник