Ca (кальций) – элемент с прядковым номером 20 в периодической системе.
Находится в IV периоде. Температура плавления: 839 ℃. Плотность: 1.54 г/см3.
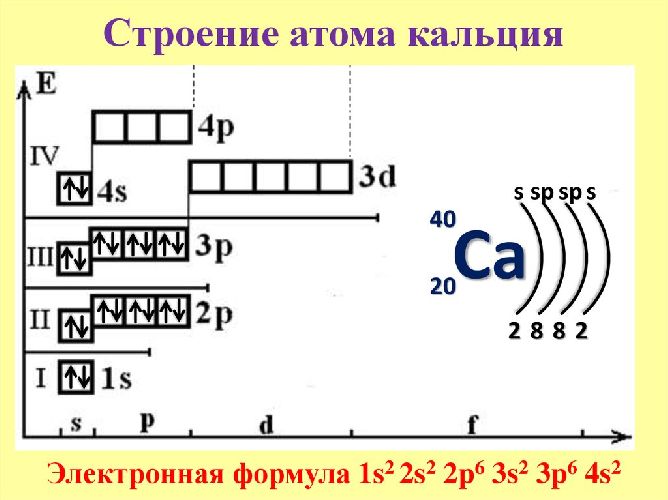
Электронная формула атома кальция:
1s2 2s2 2p6 3s2 3p6 4s2
Сокращенная электронная конфигурация Ca:
[Ar] 4s2
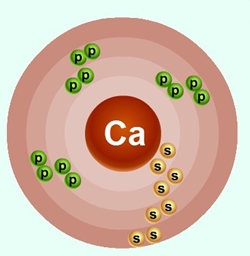
Ниже приведена электронно-графическая схема атома кальция
Распределение электронов по энергетическим уровням в атоме Ca
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 8
4-й уровень (N): 2
Валентные электроны кальция
Количество валентных электронов в атоме кальция – 2.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
Степени окисления, которые может проявлять кальций: +2
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,653 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,904 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Электронное строение атома кальция
Электронное строение нейтрального атома кальция в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме кальция.
Ca
+20
2
8
8
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме кальция.
| 4 | ↑↓ | |||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома кальция выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома кальция.
20Ca 1s2 2s2 2p6 3s2 3p6 4s2
Сокращённая электронная конфигурация атома кальция.
20Ca [Ar] 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома кальция.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 4s | 4 | 0 | 0 | +½ |
| -½ |
Кальций в таблице менделеева занимает 20 место, в 4 периоде.
| Символ | Ca |
| Номер | 20 |
| Атомный вес | 40.0780000 |
| Латинское название | Calcium |
| Русское название | Кальций |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема кальция
Ca: 1s2 2s2 2p6 3s2 3p6 4s2
Короткая запись:
Ca: [Ar]4s2
Одинаковую электронную конфигурацию имеют
атом кальция и
K-1, Sc+1, Ti+2, V+3, Mn+5, Fe+6
Порядок заполнения оболочек атома кальция (Ca) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Кальций имеет 20 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
Степень окисления кальция
Атомы кальция в соединениях имеют степени окисления 2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы кальция
Валентность Ca
Атомы кальция в соединениях проявляют валентность II.
Валентность кальция характеризует способность атома Ca к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ca
Квантовые числа определяются последним электроном в конфигурации,
для атома Ca эти числа имеют значение N = 4, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Ca:
Eo = 590 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Ca в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Строение атома кальция
- Общие сведения о строении атома кальция
- Электронное строение атома кальция
- Примеры решения задач
- Строение атома кальция
- Строение
- Общее описание
- Химические свойства
- Что мы узнали?
- Электронные формулы атомов химических элементов
- Электронные конфигурации элементов со 105 по 118
- Эмпирическое правило Клечковского
Строение атома кальция
Общие сведения о строении атома кальция
Относится к элементам s — семейства. Металл. Элементы-металлы, входящие в эту группу, носят общее название щелочно-земельных. Обозначение – Ca. Порядковый номер – 20. Относительная атомная масса – 40,8 а.е.м.
Электронное строение атома кальция
Атом кальция состоит из положительно заряженного ядра (+20), внутри которого есть 20 протонов и 20 нейтронов, а вокруг, по четырем орбитам движутся 20 электронов.
Рис.1. Схематическое строение атома кальция.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома кальция содержит 2 электрона, которые являются валентными. Степень окисления кальция равна +2. Энергетическая диаграмма основного состояния принимает следующий вид:
Возбужденного состояния, несмотря на наличие вакантных 3p— и 3d-орбиталей нет.
Примеры решения задач
| Задание | Элемент литий состоит из двух природных изотопов 6 Li (массовая доля 7,52%) и 7 Li(92,48%). Чему равна относительная атомная масса элемента лития? |
| Решение | Изотопы – это атомы одного и того же химического элемента, имеющие разные массовые числа (одинаковое число протонов, но разное – нейтронов). Средняя относительная масса изотопов рассчитывается по формуле: |
Рассчитываем среднюю относительную атомную массу лития:
Ar(Li) = (6 × 7,52 + 7 × 92,48)/100 = 6,9248 а.е.м.
Ответ Средняя относительная атомная масса лития равна 6,9248 а.е.м.
| Задание | Рассчитайте относительную атомную массу элемента кобальта, если известно, что в природе существуют два его изотопа: 57 Co (массовая доля 0,17%) и 59 Co (99,83%). |
| Решение | Изотопы – это атомы одного и того же химического элемента, имеющие разные массовые числа (одинаковое число протонов, но разное – нейтронов). Средняя относительная масса изотопов рассчитывается по формуле: |
Рассчитываем среднюю относительную атомную массу лития:
Ar(Co) = (57 × 0,17 + 59 × 99,83)/100 = 58,9966 а.е.м.
Ответ Средняя относительная атомная масса кобальта равна 58,9966 а.е.м.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Источник
Строение атома кальция

Средняя оценка: 4.4
Всего получено оценок: 184.
Средняя оценка: 4.4
Всего получено оценок: 184.
Кальций (Ca) – щелочноземельный металл, входящий в состав минералов. Из-за строения атома кальций проявляет активные восстановительные свойства. Играет важную роль в метаболизме и постройке организма.
Строение
Кальций – 20 элемент периодической таблицы. Находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 или +20 Ca)2)8)8)2.

Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. Вокруг ядра по четырём орбитам движется 20 электронов. Последний энергетический s-уровень содержит два спаренных электрона, поэтому постоянная валентность кальция – II.
В соединениях атом кальция отдаёт два электрона, выполняя функцию восстановителя. Степень окисления кальция – +2.
Кальций не может переходить в возбуждённое состояние.
Общее описание
Основным источником кальция является карбонат кальция – CaCO3, который является главным соединением известняка, мела, мрамора. Также кальций входит в состав доломита, гипса, апатита, шпата и других минералов.
Кальций – металл серебристого цвета с температурой плавления 854°С. При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.

Кальций получают электролизом расплавленного хлорида кальция – CaCl2.
Химические свойства
Схема строения атома определяет химические свойства элемента. Кальций активно реагирует с простыми и сложными веществами. Из-за способности быстро присоединять кислород, образуя на поверхности оксидную плёнку, кальций хранят под слоем парафина или керосина в плотно закрытой таре. Основные реакции кальция с элементами и соединения приведены в таблице.
Взаимодействие
Продукты
Уравнение
С кислородом при нагревании (реакция горения)
Оксид кальция (негашёная известь)
С большинством неметаллов при нагревании
С фтором даже на холоде
Гидроксид кальция (гашёная или едкая известь) выпадает в осадок, выделяется водород
Большинство солей кальция (фторид, сульфат, карбонад кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Что мы узнали?
Кальций – активный щелочноземельный металл, являющийся восстановителем. На внешнем энергетическом уровне атома находится два электрона, определяющие валентность. Кальций входит в состав минералов, быстро окисляется на воздухе, реагирует с неметаллами при нагревании, водой и кислотами. Оксид кальция называется негашёной известью, гидроксид – гашёной известью. Большинство солей кальция плохо растворяются в воде. Кальций входит в состав костей, крови, участвует в метаболизме, применяется в промышленности, строительстве и медицине.
Источник
Электронные формулы атомов химических элементов
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s 1
| Понравился сайт? Расскажи друзьям! | |||
| 2 | He | гелий | 1s 2 |
| № | Знак | Элемент | Электронная формула |
| II период | |||
| 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 |
| № | Знак | Элемент | Электронная формула |
| III период | |||
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 |
| № | Знак | Элемент | Электронная формула |
| IV период | |||
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
| № | Знак | Элемент | Электронная формула |
| V период | |||
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 22 4d 10 5p 3 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 |
| № | Знак | Элемент | Электронная формула |
| VI период | |||
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 |
| № | Знак | Элемент | Электронная формула |
| VII период | |||
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f 0 |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 |
| 110 | Ds | дармштадтий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 8 |
| 111 | Rg | рентгений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 9 |
| 112 | Cn | коперниций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 |
| 113 | Nh | нихоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 1 |
| 114 | Fl | флеровий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 2 |
| 115 | Mс | московий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 3 |
| 116 | Lv | ливерморий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 4 |
| 117 | Ts | теннесcин | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 5 |
| 118 | Og | оганесон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 |
Электронные конфигурации элементов со 105 по 118
Электронные конфигурации элементов со 105 по 118 приведены согласно данных сайта WebElements
- 105 Db : [Rn].5f 14 .6d 3 .7s 2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2
- 106 Sg : [Rn].5f 14 .6d 4 .7s 2 (догадка, основанная на электронной конфигурации вольфрама) ; 2.8.18.32.32.12.2
- 107 Bh : [Rn].5f 14 .6d 5 .7s 2 (догадка, основанная на электронной конфигурации рения) ; 2.8.18.32.32.13.2
- 108 Hs : [Rn].5f 14 .6d 6 .7s 2 (догадка, основанная на электронной конфигурации осмия) ; 2.8.18.32.32.14.2
- 109 Mt : [Rn].5f 14 .6d 7 .7s 2 (догадка, основанная на электронной конфигурации иридия) ; 2.8.18.32.32.15.2
- 110 Ds : [Rn].5f 14 .6d 9 .7s 1 (догадка, основанная на электронной конфигурации платины) ; 2.8.18.32.32.17.1
- 111 Rg : [Rn].5f 14 .6d 10 .7s 1 (догадка, основанная на электронной конфигурации золота) ; 2.8.18.32.32.18.1
- 112 Cn : [Rn].5f 14 .6d 10 .7s 2 (догадка, основанная на электронной конфигурации ртути) ; 2.8.18.32.32.18.2
- 113 Uut : [Rn].5f 14 .6d 10 .7s 2 .7p 1 (догадка, основанная на электронной конфигурации таллия) ; 2.8.18.32.32.18.3
- 114 Fl : [Rn].5f 14 .6d 10 .7s 2 .7p 2 (догадка, основанная на электронной конфигурации свинца) ; 2.8.18.32.32.18.4
- 115 Uup : [Rn].5f 14 .6d 10 .7s 2 .7p 3 (догадка, основанная на электронной конфигурации висмута) ; 2.8.18.32.32.18.5
- 116 Lv : [Rn].5f 14 .6d 10 .7s 2 .7p 4 (догадка, основанная на электронной конфигурации полония) ; 2.8.18.32.32.18.6
- 117 Uus : [Rn].5f 14 .6d 10 .7s 2 .7p 5 (догадка, основанная на электронной конфигурации астата) ; 2.8.18.32.32.18.7
- 118 Uuo : [Rn].5f 14 .6d 10 .7s 2 .7p 6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Источник