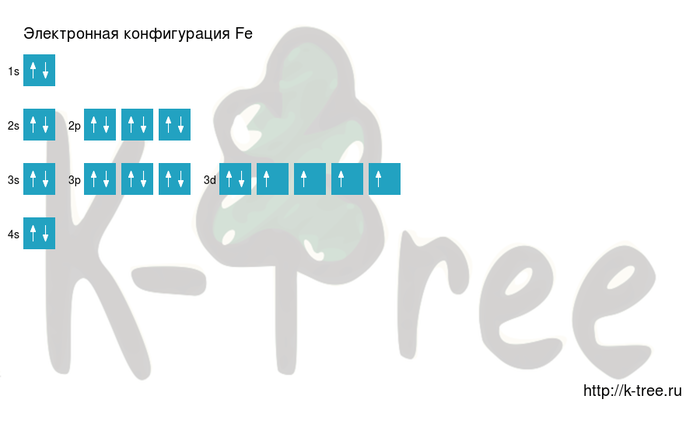
Fe (железо) – элемент с прядковым номером 26 в периодической системе.
Находится в IV периоде. Температура плавления: 1535 ℃. Плотность: 7.87 г/см3.
Электронная формула атома железа в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Электронная формула атома железа в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращенная электронная конфигурация Fe:
[Ar] 3d6 4s2
Ниже приведена электронно-графическая схема атома железа
Распределение электронов по энергетическим уровням в атоме Fe
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 14
4-й уровень (N): 2
Валентные электроны железа
Количество валентных электронов в атоме железа – 8.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | 0 | +1/2 |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
| d | 3 | 2 | -2 | -1/2 |
Степени окисления, которые может проявлять железо: +1, +2, +3, +4, +5, +6
Электронное строение атома железа
Электронное строение нейтрального атома железа в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме железа.
Fe
+26
2
8
14
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме железа.
| 4 | ↑↓ | |||||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома железа выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома железа.
26Fe 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращённая электронная конфигурация атома железа.
26Fe [Ar] 3d6 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома железа.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3d | 3 | 2 | -2 | +½ |
| -½ | ||||
| 0 | +½ | |||
| 1 | +½ | |||
| 2 | +½ | |||
| 3 | +½ | |||
| 4s | 4 | 0 | 0 | +½ |
| -½ |
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Электронные формулы атомов химических элементов (Таблица)
Таблица содержит электронные формулы атомов химических элементов (слои расположены в порядке заполнения подуровней)
Электронная формула показывает распределение электронов на орбиталях в атоме:
Формирование электронной оболочки атома происходит в соответствии с 3-мя принципами:
1. Принцип минимума энергии, который определяет заполнение атомных орбиталей с наименьшей энергией
(1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s)
2. Принцип Паули, который диктует присутствие на атомной орбитали не более 2 электронов с противоположно направленными спинами
3. Правило Хунда, по которому происходит заполнение атомных орбиталей электронами так, чтобы их суммарный спин был максимальным.
Ниже показаны примеры графического изображения электронных формул атомов некоторых химических элементов:
Таблица электронных формул атомов химических элементов
|
№ элемента |
Химический знак |
Название элемента |
Электронная формула |
|
1 |
H |
водород |
1s1 |
|
2 |
He |
гелий |
1s2 |
|
II период |
|||
|
3 |
Li |
литий |
1s22s1 |
|
4 |
Be |
бериллий |
1s22s2 |
|
5 |
B |
бор |
1s22s22p1 |
|
6 |
C |
углерод |
1s22s22p2 |
|
7 |
N |
азот |
1s22s22p3 |
|
8 |
O |
кислород |
1s22s22p4 |
|
9 |
F |
фтор |
1s22s22p5 |
|
10 |
Ne |
неон |
1s22s22p6 |
|
III период |
|||
|
11 |
Na |
натрий |
1s22s22p63s1 |
|
12 |
Mg |
магний |
1s22s22p63s2 |
|
13 |
Al |
алюминий |
1s22s22p63s23p1 |
|
14 |
Si |
кремний |
1s22s22p63s23p2 |
|
15 |
P |
фосфор |
1s22s22p63s23p3 |
|
16 |
S |
сера |
1s22s22p63s23p4 |
|
17 |
Cl |
хлор |
1s22s22p63s23p5 |
|
18 |
Ar |
аргон |
1s22s22p63s23p6 |
|
IV период |
|||
|
19 |
K |
калий |
1s22s22p63s23p64s1 |
|
20 |
Ca |
кальций |
1s22s22p63s23p64s2 |
|
21 |
Sc |
скандий |
1s22s22p63s23p64s23d1 |
|
22 |
Ti |
титан |
1s22s22p63s23p64s23d2 |
|
23 |
V |
ванадий |
1s22s22p63s23p64s23d3 |
|
24 |
Cr |
хром |
1s22s22p63s23p64s13d5 |
|
25 |
Mn |
марганец |
1s22s22p63s23p64s23d5 |
|
26 |
Fe |
железо |
1s22s22p63s23p64s23d6 |
|
27 |
Co |
кобальт |
1s22s22p63s23p64s23d7 |
|
28 |
Ni |
никель |
1s22s22p63s23p64s23d8 |
|
29 |
Cu |
медь |
1s22s22p63s23p64s13d10 |
|
30 |
Zn |
цинк |
1s22s22p63s23p64s23d10 |
|
31 |
Ga |
галлий |
1s22s22p63s23p64s23d104p1 |
|
32 |
Ge |
германий |
1s22s22p63s23p64s23d104p2 |
|
33 |
As |
мышьяк |
1s22s22p63s23p64s23d104p3 |
|
34 |
Se |
селен |
1s22s22p63s23p64s23d104p4 |
|
35 |
Br |
бром |
1s22s22p63s23p64s23d104p5 |
|
36 |
Kr |
криптон |
1s22s22p63s23p64s23d104p6 |
|
V период |
|||
|
37 |
Rb |
рубидий |
1s 22s 22p 63s 23p64s 23d104p65s1 |
|
38 |
Sr |
стронций |
1s 22s 22p 63s 23p64s 23d104p65s2 |
|
39 |
Y |
иттрий |
1s 22s 22p 63s 23p64s 23d104p65s24d1 |
|
40 |
Zr |
цирконий |
1s 22s 22p 63s 23p64s 23d104p65s24d2 |
|
41 |
Nb |
ниобий |
1s 22s 22p 63s 23p64s 23d104p65s14d4 |
|
42 |
Mo |
молибден |
1s 22s 22p 63s 23p64s 23d104p65s14d5 |
|
43 |
Tc |
технеций |
1s 22s 22p 63s 23p64s 23d104p65s24d5 |
|
44 |
Ru |
рутений |
1s 22s 22p 63s 23p64s 23d104p65s14d7 |
|
45 |
Rh |
родий |
1s 22s 22p 63s 23p64s 23d104p65s14d8 |
|
46 |
Pd |
палладий |
1s 22s 22p 63s 23p64s 23d104p65s04d10 |
|
47 |
Ag |
серебро |
1s 22s 22p 63s 23p64s 23d104p65s14d10 |
|
48 |
Cd |
кадмий |
1s 22s 22p 63s 23p64s 23d104p65s24d10 |
|
49 |
In |
индий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
|
50 |
Sn |
олово |
1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
|
51 |
Sb |
сурьма |
1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
|
52 |
Te |
теллур |
1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
|
53 |
I |
йод |
1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
|
54 |
Xe |
ксенон |
1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
|
VI период |
|||
|
55 |
Cs |
цезий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
|
56 |
Ba |
барий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
|
57 |
La |
лантан |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
|
58 |
Ce |
церий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
|
59 |
Pr |
празеодим |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
|
60 |
Nd |
неодим |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
|
61 |
Pm |
прометий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
|
62 |
Sm |
самарий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
|
63 |
Eu |
европий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
|
64 |
Gd |
гадолиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
|
65 |
Tb |
тербий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
|
66 |
Dy |
диспрозий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
|
67 |
Ho |
гольмий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
|
68 |
Er |
эрбий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
|
68 |
Tm |
тулий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
|
70 |
Yb |
иттербий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
|
71 |
Lu |
лютеций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
|
72 |
Hf |
гафний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
|
73 |
Ta |
тантал |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
|
74 |
W |
вольфрам |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
|
75 |
Re |
рений |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
|
76 |
Os |
осмий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
|
77 |
Ir |
иридий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
|
78 |
Pt |
платина |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
|
79 |
Au |
золото |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
|
80 |
Hg |
ртуть |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
|
81 |
Tl |
таллий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
|
82 |
Pb |
свинец |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
|
83 |
Bi |
висмут |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
|
84 |
Po |
полоний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
|
85 |
At |
астат |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
|
86 |
Rn |
радон |
1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
|
VII период |
|||
|
87 |
Fr |
франций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
|
88 |
Ra |
радий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
|
89 |
Ac |
актиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
|
90 |
Th |
торий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
|
91 |
Pa |
протактиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
|
92 |
U |
уран |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
|
93 |
Np |
нептуний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
|
94 |
Pu |
плутоний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
|
95 |
Am |
америций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
|
96 |
Cm |
кюрий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
|
97 |
Bk |
берклий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
|
98 |
Cf |
калифорний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
|
99 |
Es |
эйнштейний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
|
100 |
Fm |
фермий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
|
101 |
Md |
менделеевий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
|
102 |
No |
нобелий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
|
103 |
Lr |
лоуренсий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
|
104 |
Rf |
резерфордий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
|
105 |
Db |
дубний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
|
106 |
Sg |
сиборгий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
|
107 |
Bh |
борий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
|
108 |
Hs |
хассий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
|
109 |
Mt |
мейтнерий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
|
s-элементы |
p-элементы |
d-элементы |
f-элементы |