Mg (магний) – элемент с прядковым номером 12 в периодической системе.
Находится в III периоде. Температура плавления: 648.8 ℃. Плотность: 1.74 г/см3.
Электронная формула атома магния:
1s2 2s2 2p6 3s2
Сокращенная электронная конфигурация Mg:
[Ne] 3s2
Ниже приведена электронно-графическая схема атома магния

Распределение электронов по энергетическим уровням в атоме Mg
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 2

Валентные электроны магния
Количество валентных электронов в атоме магния – 2.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
Степени окисления, которые может проявлять магний: +1, +2
Магний в таблице менделеева занимает 12 место, в 3 периоде.
| Символ | Mg |
| Номер | 12 |
| Атомный вес | 24.3040000 |
| Латинское название | Magnesium |
| Русское название | Магний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема магния
Mg: 1s2 2s2 2p6 3s2
Короткая запись:
Mg: [Ne]3s2
Одинаковую электронную конфигурацию имеют
атом магния и
Na-1, Al+1, Si+2, P+3, S+4, Cl+5
Порядок заполнения оболочек атома магния (Mg) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Магний имеет 12 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы магния
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mg
Квантовые числа определяются последним электроном в конфигурации,
для атома Mg эти числа имеют значение N = 3, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:

Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Mg:
Eo = 738 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Mg в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Магний Mg
- Электронная схема магния
- Степень окисления магния
- Ионы магния
- Валентность Mg
- Квантовые числа Mg
- Энергия ионизации
- Магний Mg
- Электронная схема магния
- Степень окисления магния
- Ионы магния
- Валентность Mg
- Квантовые числа Mg
- Энергия ионизации
- Строение атома магния
- Общие сведения о строении атома магния
- Электронное строение атома магния
- Примеры решения задач
- 1. Изобразите схемы строения электронных оболочек атомов Mg(магний) и S (сера) исходя из положения их периодической таблице Д?
- Изобразите схемы электронного строения атомов химических элементов азота и магния?
- Изобразите схемы строения атомов натрия и магния?
- Умоляю помогите?
- Пожалуйста помогите, в школе не поняла тему?
- Изобразите схемы строения атомов натрия и магния?
- Изобразите схемы строения атомов фосфора, серы, хлора?
- Охарактеризуйте элемент с атомным номером 15, изотоп с массовым числом 31, исходя из его положения в периодической системе химических элементов и строения атома, последующему плану : а)химический сисв?
- Исходя из положения азота в периодической системе элементов Д?
- Охарактеризуйте элемент с атомным номером 7?
- Охарактеризуйте элемент с атомным номером 7 ?
- § 33. Строение электронных оболочек атомов
Магний Mg
Магний в таблице менделеева занимает 12 место, в 3 периоде.
| Символ | Mg |
| Номер | 12 |
| Атомный вес | 24.3040000 |
| Латинское название | Magnesium |
| Русское название | Магний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема магния
Одинаковую электронную конфигурацию имеют атом магния и Na -1 , Al +1 , Si +2 , P +3 , S +4 , Cl +5
Порядок заполнения оболочек атома магния (Mg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Магний имеет 12 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы магния
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mg
Квантовые числа определяются последним электроном в конфигурации, для атома Mg эти числа имеют значение N = 3, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
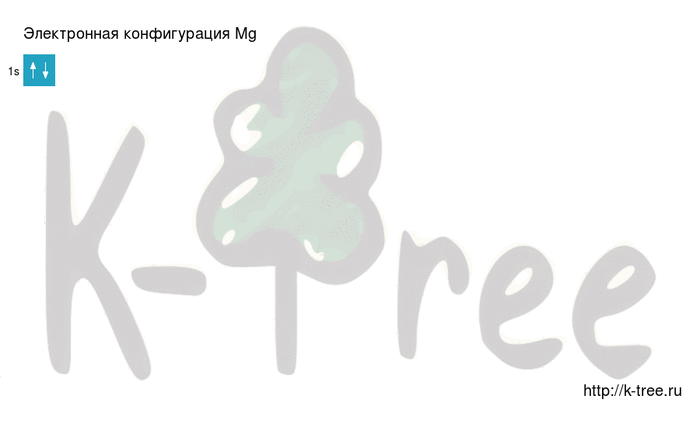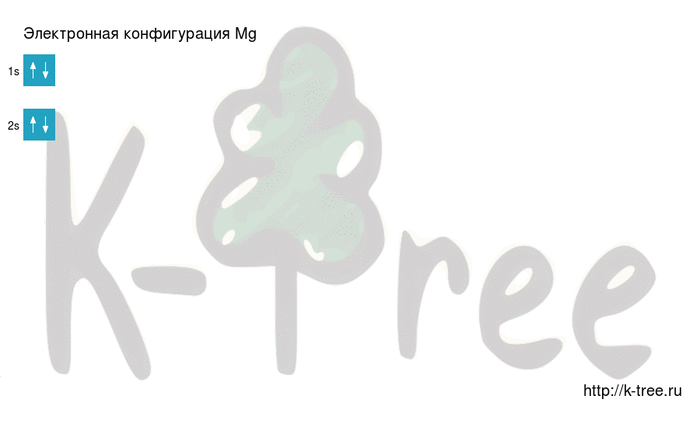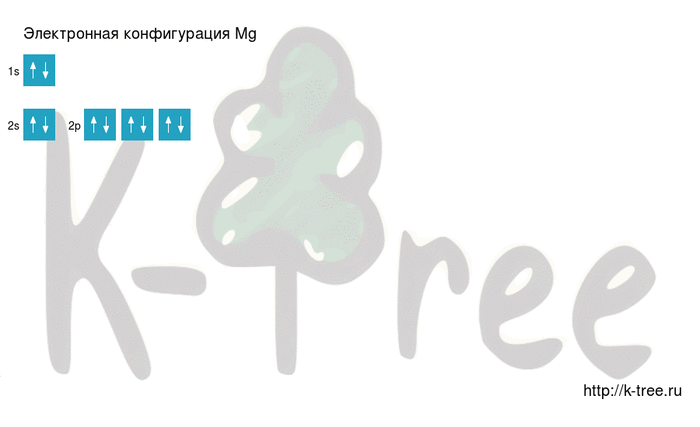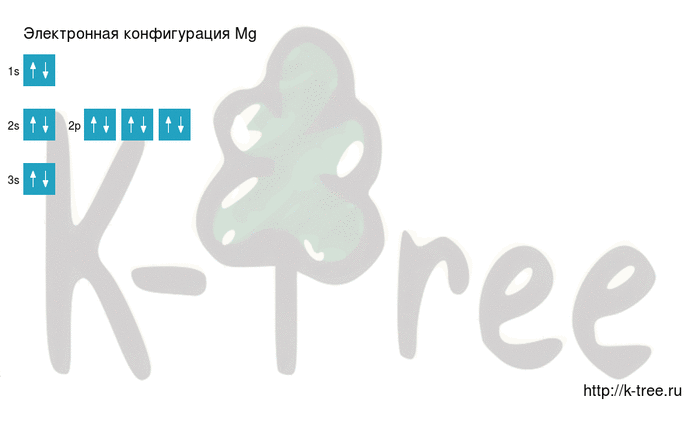
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Магний Mg
Магний в таблице менделеева занимает 12 место, в 3 периоде.
| Символ | Mg |
| Номер | 12 |
| Атомный вес | 24.3040000 |
| Латинское название | Magnesium |
| Русское название | Магний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема магния
Одинаковую электронную конфигурацию имеют атом магния и Na -1 , Al +1 , Si +2 , P +3 , S +4 , Cl +5
Порядок заполнения оболочек атома магния (Mg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Магний имеет 12 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы магния
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mg
Квантовые числа определяются последним электроном в конфигурации, для атома Mg эти числа имеют значение N = 3, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
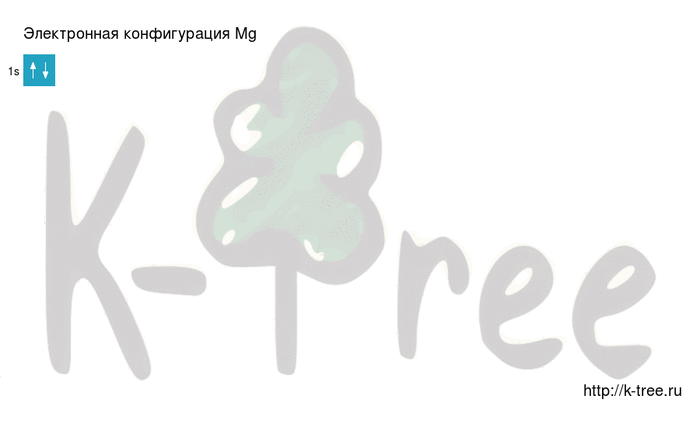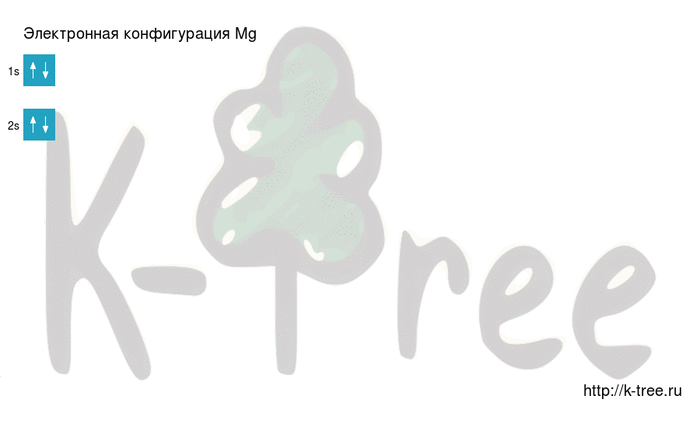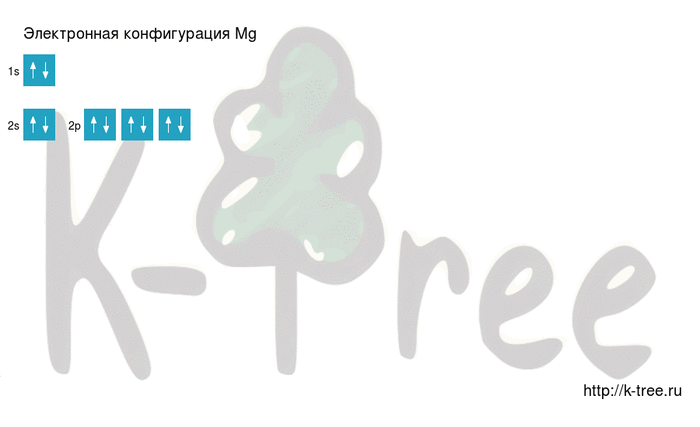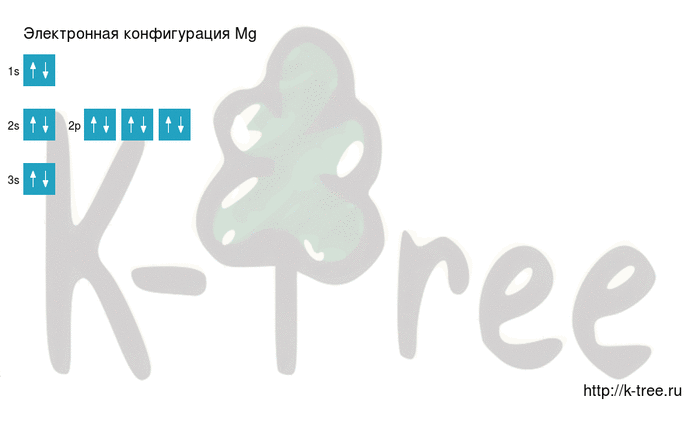
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Строение атома магния
Общие сведения о строении атома магния
Порядковый номер равен 12. Заряд ядра равен +12. Атомный вес – 24,132 а.е.м.
Электронное строение атома магния
Магний расположен в третьем периоде, значит, он имеет три оболочки, одна из которых внешняя, содержащая валентные электроны. Атом магния имеет положительно заряженное ядро (+12), в котором имеется 12 протонов и 12 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 12 электронов.
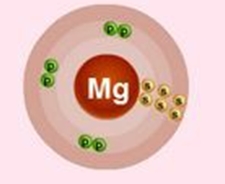
Рис. 1. Схематичное изображение строения атома магния.
Электронную конфигурацию атома магния можно записать двояко:
Магний относится к семейству s-элементов. Энергетическая диаграмма атома магния (на ней изображаются только валентные электроны) имеет вид:

В результате химического взаимодействия магний теряет свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион (Mg 2+ ):
В соединениях магний проявляет степень окисления +2.
Примеры решения задач
| Задание | Химическому элементу главной подгруппы соответствует высший оксид состава RO3. Какова электронная конфигурация внешнего энергетического уровня атома этого элемента? |
| Ответ | Необходимо определить к какой группе Периодической системы относится элемент, образующий высший оксид состава RO3. Поскольку в оксидах кислород проявляет постоянную валентность равную II, то высшая валентность элемента в оксиде R VI O II 3 равна VI. |
Отсюда следует, что это элемент VIA группы, в его атоме 6 валентных электронов. Этому требованию соответствует элемент с электронной формулой ns 2 np 4 .
| Задание | Исходя из строения внешнего уровня атома меди, объясните, какие значения степени окисления могут быть характерны для меди. |
| Решение | Напишем электронную формулу атома меди в основном состоянии, учитывая, что для меди характерен проскок электрона с 4s –подуровня на 3d-подуровень, который объясняется тем, что завершенный подуровень энергетически более выгоден: |
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
4s-электрон является валентным.
В возбужденном состоянии один из d-электронов возвращается на 4-й уровень, таким образом там оказывается 2 валентных электрона.
Итак, для меди характерны два значения степени окисления: +1 и +2.
Источник
1. Изобразите схемы строения электронных оболочек атомов Mg(магний) и S (сера) исходя из положения их периодической таблице Д?
1. Изобразите схемы строения электронных оболочек атомов Mg(магний) и S (сера) исходя из положения их периодической таблице Д.
Укажите признаки сходства и различия между ними.
2. Напишите не менее трёх знаков атомов химических элементов, у которых на внешнем энергетическом уровне по 1è.
Составьте схемы строения их атомов.

магний по строению является s — элементом, а сера — р — элементом.
Кроме того, атома магния имеет на последнем внешнем энергетическом уровне 2 электрона, которые слабее притягиваются к ядру и поэтому он проявляет металлические свойства.
Атом, серы имеет на внешнем энерг.
Уровне 6 электронов, котороым до заполнения эл.
Оболочки необходимо еще4 электрона, следовательно сера проявляет неметаллические свойства.
Число энергетических уровне у данных атомов элементов равное.

Изобразите схемы электронного строения атомов химических элементов азота и магния?
Изобразите схемы электронного строения атомов химических элементов азота и магния.

Изобразите схемы строения атомов натрия и магния?
Изобразите схемы строения атомов натрия и магния.
Укажите сходства и различия в строении атомов данных химических элементов.

Умоляю помогите?
1. Изобразите схемы строения электронных оболочек атомов Mg(магний) и S (сера) исходя из положения их периодической таблице Д.
Укажите признаки сходства и различия между ними.
2. Напишите не менее трёх знаков атомов химических элементов, у которых на внешнем энергетическом уровне по 1è.
Составьте схемы строения их атомов.

Пожалуйста помогите, в школе не поняла тему?
Пожалуйста помогите, в школе не поняла тему.
№1)Изобразите схемы строение атомов Углерода и Кремния.
Укажите сходства и различия в строении атомов этих химических элементов.
№2)Изобразите схемы строения атомов натрия и магния.
Укажите сходства и различия в строении атомов данных химических элементов.

Изобразите схемы строения атомов натрия и магния?
Изобразите схемы строения атомов натрия и магния.
Укажите сходства и различия в строении атомов данных химических элементов.

Изобразите схемы строения атомов фосфора, серы, хлора?
Изобразите схемы строения атомов фосфора, серы, хлора.
Укажите признаки сходства и различия в строении их атомов.

Охарактеризуйте элемент с атомным номером 15, изотоп с массовым числом 31, исходя из его положения в периодической системе химических элементов и строения атома, последующему плану : а)химический сисв?
Охарактеризуйте элемент с атомным номером 15, изотоп с массовым числом 31, исходя из его положения в периодической системе химических элементов и строения атома, последующему плану : а)химический сисвол и название элемента б)номера периода, группы и вид подгруппы в)заряд и состав ядра атома г)общее число электронов в атоме и число электронов на внешнем энергетическом уровне д)схема строения электронной оболочки атома е)свойства простого вещества, образованного атомами этого элемента(металлические и неметаллические) Составьте схему образования химической связи между атомами этого элемента и атомами элемента водорода, укажите вид химической связи между атомами и в сторону атомов какого элемента смещаются общие электронные пары.

Исходя из положения азота в периодической системе элементов Д?
Исходя из положения азота в периодической системе элементов Д.
И. Менделеева , приведите схему электронного строения атома.

Охарактеризуйте элемент с атомным номером 7?
Охарактеризуйте элемент с атомным номером 7.
Исходя из его положения в Периодической системе химических элементов и строения атома, по следующему плану :
а) химический символ и название элемента ; б) номер периода, группы и вид подгруппы ; в) заряд и состав ядра атома ; г) общее число электронов в атоме и число электронов на внешнем энергетическом уровне ; д) схема строения электронной оболочки атома ; е) свойства простого вещества, образуемого атомами этого элемента.

Охарактеризуйте элемент с атомным номером 7 ?
Охарактеризуйте элемент с атомным номером 7 .
Исходя из его положения в периодической системе химических элементов и строения атома , по следующему Плану : а) химический символ и название элемента ; б) номер периода , группы и вид подгруппы ; в) заряд и состав ядра атома ; г) общее число элемента в атоме и число электронов в атоме и число электронов на внешнем энергетическом уровне ; д) схема строения электронной оболочки атома ; е) свойства простого вещества , образуемого атома этого элемента.
Если вам необходимо получить ответ на вопрос 1. Изобразите схемы строения электронных оболочек атомов Mg(магний) и S (сера) исходя из положения их периодической таблице Д?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Источник
§ 33. Строение электронных оболочек атомов
Чему равно число электронов в атоме фосфора? Сколько электронных слоев они образуют?
У атома фосфора 15 электронов расположены на трёх электронных слоях.
Сколько электронных слоев в атомах кислорода и серы?
У атома кислорода 2 электронных слоя, серы — три.
Чем объясняется сходство химических свойств атомов хлора и брома?
Сходство химических свойств хлора и брома объясняется тем, что они расположены в одной группе и у них на внешнем электронном слое находится одинаковое число электронов — 7.
Чем различается строение внешнего электронного слоя у атомов углерода и азота?
Отличие заключается в том, что на внешнем слое углерода находится четыре электрона, а у азота — пять.
Составьте электронные схемы следующих атомов: магния, бора, фтора, кремния, хлора, углерода
Укажите недостающее число электронов на внешнем электронном слое до его завершения у следующих атомов: а) серы и кислорода; б) бора и алюминия; в) хлора и фтора.
а) По два; б) по пять; в) по одному.
У каких электронов — второго или третьего слоя — связь с ядром прочнее? Почему?
У электронов второго слоя. Потому что они расположены ближе к ядру и сильнее с ним взаимодействуют.
Что является причиной периодичности свойств атомов химических элементов?
Причиной периодичности повторения свойств атомов химических элементов является тот факт, что при монотонном увеличении заряда ядра наблюдается периодически повторяющееся строение внешнего электронного слоя атома.
О каких элементах идет речь, если строение их электронной оболочки выражается следующим распределением электронов по слоям: а) 2, 8, 1; б) 2, 1; в) 2, 8, 4; г) 2, 3; д) 2, 8, 8; е) 2, 8.
Почему первый период содержит только два химических элемента, а второй — восемь?
Это объясняется современной теорией строения атома. Периоды могут содержать разное количество химических элементов, в зависимости от количества электронов на внешнем уровне. В первом периоде у атомов химических элементов только один энергетический уровень, на котором максимально может размещаться 2 электрона, во втором периоде — два энергетических уровня и максимум 8 электронов.
Источник
Содержание
- Строение атома магния
- Общие сведения о строении атома магния
- Электронное строение атома магния
- Примеры решения задач
- Схема строения атома распределение электронов по энергоуровням завершенность внешнего уровня магния
- Электронная конфигурация атома
- Для чего изучать электронную конфигурацию элементов?
- Сколько электронов в атоме?
- Где искать электрон?
- Орбиталь
- Орбитальное квантовое число l
- Магнитное квантовое число ml
- Спиновое квантовое число ms
- Главное квантовое число n
- Номер электрона
- Элементы
Строение атома магния
Общие сведения о строении атома магния
Порядковый номер равен 12. Заряд ядра равен +12. Атомный вес – 24,132 а.е.м.
Электронное строение атома магния
Магний расположен в третьем периоде, значит, он имеет три оболочки, одна из которых внешняя, содержащая валентные электроны. Атом магния имеет положительно заряженное ядро (+12), в котором имеется 12 протонов и 12 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 12 электронов.

Рис. 1. Схематичное изображение строения атома магния.
Электронную конфигурацию атома магния можно записать двояко:
1s 2 2s 2 2p 6 3s 2 .
Магний относится к семейству s-элементов. Энергетическая диаграмма атома магния (на ней изображаются только валентные электроны) имеет вид:

В результате химического взаимодействия магний теряет свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион (Mg 2+ ):
В соединениях магний проявляет степень окисления +2.
Примеры решения задач
| Задание | Химическому элементу главной подгруппы соответствует высший оксид состава RO3. Какова электронная конфигурация внешнего энергетического уровня атома этого элемента? |
| Ответ | Необходимо определить к какой группе Периодической системы относится элемент, образующий высший оксид состава RO3. Поскольку в оксидах кислород проявляет постоянную валентность равную II, то высшая валентность элемента в оксиде R VI O II 3 равна VI. |
Отсюда следует, что это элемент VIA группы, в его атоме 6 валентных электронов. Этому требованию соответствует элемент с электронной формулой ns 2 np 4 .
| Задание | Исходя из строения внешнего уровня атома меди, объясните, какие значения степени окисления могут быть характерны для меди. |
| Решение | Напишем электронную формулу атома меди в основном состоянии, учитывая, что для меди характерен проскок электрона с 4s –подуровня на 3d-подуровень, который объясняется тем, что завершенный подуровень энергетически более выгоден: |
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
4s-электрон является валентным.
В возбужденном состоянии один из d-электронов возвращается на 4-й уровень, таким образом там оказывается 2 валентных электрона.
Итак, для меди характерны два значения степени окисления: +1 и +2.
Источник
Схема строения атома распределение электронов по энергоуровням завершенность внешнего уровня магния

Ответ:) Магний — это элемент главной подгруппы II группы 3-ого периода, порядковый номер 12, т.е. заряд ядра +12, это означает, что в составе ядра магния 12 протонов, а так как атомная масса составляет 24 а.е.м., то число нейтронов в ядре также 12.
Так как магний находится в 3-ем периоде, то в его атоме электроны распределены по энергетическим уровням (электроны каждого уровня формируют его электронную оболочку, а электроны каждого подуровня — электронную подоболочку). Так как магний находится во второй группе, то у него 2 валентных электрона (внешних электрона), которые он отдаёт в химических реакциях, превращаясь в положительно заряженный ион — катион (Mg2+), то есть для магния характерно только двухвалентное состояние. Магний — металл, сильный восстановитель, окислителем (т.е. принимающим электроны) он быть не может.
2) Азот — это элемент главной подгруппы V группы 2-ого периода, порядковый номер 7, т.е. заряд ядра +7(в ядре 7 протонов), относительная атомная масса — 14 а.е.м., т.е. в ядре 7 нейтронов. Так как элемент находится во втором периоде, то у него электроны распределены по 2 энергетическим уровням, причём 5 валентных электронов. Обычно азот трёхвалентен, но макисмальная его валентность 4 (азот не может быть пятивалентным, потому что на внешнем энергетическим уровне только 4 орбитали — 1 s-орбиталь и 3 p-орбитали, т.е. возможное число неспаренных электронов только 4, а этим и обуславливается валентная возможность.
Азот может проявлять свойства восстановителя с более ЭО элементами (кислород), но чаще он окислитель, т.е. принимает электроны.
3) Хлор — элемент главной подгруппы VII группы 3-ого периода, т.е.:
1) заряд ядра +17 (ядро содержит 17 протонов)
2) 35,5 а.е.м. (относительная атомная масса).
Хлор представлен двумя изотопами с массовыми числами 35 и 37, причём первого в природе 76%, второго — 24%, тогда и число нейтронов различно: для первого изотопа 18, для второго — 20.
Значение атомной массы 35,5 является средним значением атомной массы хлора с учётом распространённости всех его изотопов в природе:
35 * 0,76 + 37 * 0,24 = 35,4
Все электроны хлора находятся на 3-х энергетических уровнях, причём из них 7 внешних, или валентных.
Высшая валентность хлора по кислороду — 7, низшая в галогенводородах и хлоридах (1), есть также промежуточные нечётные валентности: 3, 5.
Источник
Электронная конфигурация атома
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему. Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину. Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона, грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
Ml — номер орбитали
Ms — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии, облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой. На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно принимает значения 0,1,2 или 3.

На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1». Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0, Ml=1,Ml=2.
Спиновое квантовое число ms
Спин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней, каждый обозначается арабской цифрой: 1,2,3. 7. Количество оболочек на каждом уровне равно номеру уровня: на первом уровне одна оболочка, на втором две и т.д.
Номер электрона

Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни и цветом разделены подуровни:
| 1 |
|---|
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
| Таблица 1. Распределение электронов по энергетическим уровням |
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у 24Cr, 29Cu, 41Nb, 42Mo, 44Ru, 45Rh, 46Pd, 47Ag, 78Pt, 79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #3, #9 и #16, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 2 2s 1 | 2 |
| 4 | Be | бериллий | 1s 2 2s 2 | 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 | 2 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 | 2 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | 2 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | 2 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | 2 |
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 | 3 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | 3 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | 3 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | 3 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | 3 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | 3 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | 3 |
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 | 4 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | 4 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | 4 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | 4 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | 4 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 | 4 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | 4 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | 4 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | 4 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | 4 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 | 4 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | 4 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | 4 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | 4 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | 4 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | 4 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 | 4 |
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 | 5 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 | 5 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 | 5 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 | 5 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 | 5 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 | 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 | 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 | 5 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 | 5 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 | 5 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 | 5 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 | 5 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 | 5 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 | 5 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 3 | 5 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 | 5 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 | 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 | 5 |
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 | 6 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 | 6 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 | 6 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 | 6 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 | 6 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 | 6 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 | 6 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 | 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 | 6 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 | 6 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 | 6 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 | 6 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 | 6 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 | 6 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 | 6 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 | 6 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 | 6 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 | 6 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 | 6 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 | 6 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 | 6 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 | 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 | 6 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 | 6 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 | 6 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 | 6 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 | 6 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 | 6 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 | 6 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 | 6 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 | 6 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 | 6 |
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 | 7 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 | 7 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 | 7 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f 0 | 7 |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 | 7 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 | 7 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 | 7 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 | 7 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 | 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 | 7 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 | 7 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 | 7 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 | 7 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 | 7 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 | 7 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 | 7 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 | 7 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 | 7 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 | 7 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 | 7 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 | 7 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 | 7 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 | 7 |
| 110 | Ds | дармштадтий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 8 | 7 |
| 111 | Rg | рентгений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 9 | 7 |
| 112 | Cn | коперниций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 | 7 |
| 113 | Nh | нихоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 1 | 7 |
| 114 | Fl | флеровий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 2 | 7 |
| 115 | Mc | московий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 3 | 7 |
| 116 | Lv | ливерморий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 4 | 7 |
| 117 | Ts | теннесcин | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 5 | 7 |
| 118 | Og | оганесон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 | 7 |
| Таблица 2. Электронная конфигурация атомов |
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье «как написать электронную конфигурацию»
Источник
