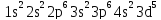Mn (марганец) – элемент с прядковым номером 25 в периодической системе.
Находится в IV периоде. Температура плавления: 1244 ℃. Плотность: 7.44 г/см3.
Электронная формула атома марганца в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Электронная формула атома марганца в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d5 4s2
Сокращенная электронная конфигурация Mn:
[Ar] 3d5 4s2
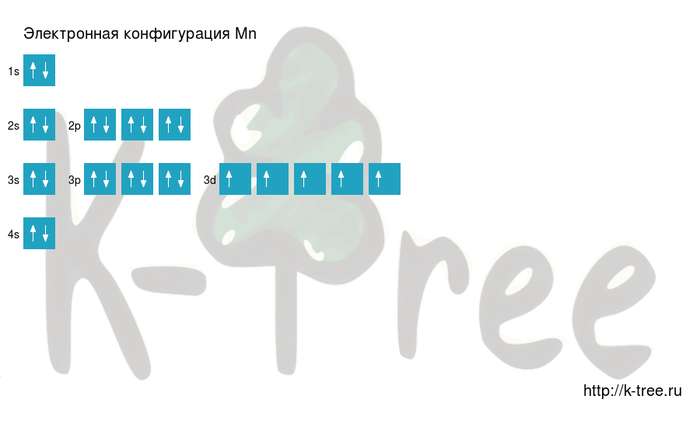
Ниже приведена электронно-графическая схема атома марганца
Распределение электронов по энергетическим уровням в атоме Mn
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 13
4-й уровень (N): 2
Валентные электроны марганца
Количество валентных электронов в атоме марганца – 7.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | 0 | +1/2 |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
Степени окисления, которые может проявлять марганец: +1, +2, +3, +4, +5, +6, +7
Электронное строение атома марганца
Электронное строение нейтрального атома марганца в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме марганца.
Mn
+25
2
8
13
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме марганца.
| 4 | ↑↓ | |||||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома марганца выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома марганца.
25Mn 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Сокращённая электронная конфигурация атома марганца.
25Mn [Ar] 3d5 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома марганца.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3d | 3 | 2 | -2 | +½ |
| 0 | +½ | |||
| 1 | +½ | |||
| 2 | +½ | |||
| 3 | +½ | |||
| 4s | 4 | 0 | 0 | +½ |
| -½ |
Марганец в таблице менделеева занимает 25 место, в 4 периоде.
| Символ | Mn |
| Номер | 25 |
| Атомный вес | 54.9380440 |
| Латинское название | Manganum,Manganesium |
| Русское название | Марганец |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема марганца
Mn: 1s2 2s2 2p6 3s2 3p6 4s2 3d5
Короткая запись:
Mn: [Ar]4s2 3d5
Одинаковую электронную конфигурацию имеют
атом марганца и
V-2, Fe+1, Co+2, Ni+3
Порядок заполнения оболочек атома марганца (Mn) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Марганец имеет 25 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления марганца
Атомы марганца в соединениях имеют степени окисления 7, 6, 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы марганца
Валентность Mn
Атомы марганца в соединениях проявляют валентность VII, VI, V, IV, III, II, I.
Валентность марганца характеризует способность атома Mn к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mn
Квантовые числа определяются последним электроном в конфигурации,
для атома Mn эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Mn:
Eo = 717 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Mn в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Содержание
- Строение электронной оболочки марганца
- Общие сведения о строении атома марганца
- Электронное строение атома марганца
- Электронная схема марганца
- Степень окисления марганца
- Ионы марганца
- Валентность Mn
- Квантовые числа Mn
- Энергия ионизации
- Строение атома марганца (mn), схема и примеры
- Свойства марганца | Дистанционные уроки
- Обсуждение: «Свойства марганца»
- Марганец -общая характеристика элемента, химические свойства хрома и его соединений
- Mn — Марганец
Строение электронной оболочки марганца
Общие сведения о строении атома марганца
Относится к элементам d — семейства. Металл. Обозначение – Mn. Порядковый номер – 25. Относительная атомная масса – 54,931 а.е.м.
Электронное строение атома марганца
Атом марганца состоит из положительно заряженного ядра (+25), внутри которого есть 25 протонов и 30 нейтронов, а вокруг, по четырем орбитам движутся 25 электронов.
Рис.1. Схематическое строение атома марганца.
Распределение электронов по орбиталям выглядит следующим образом:
Состояние считается более энергетически выгодным, если на d-подуровне находится 5 или 10 электронов.
Энергетическая диаграмма основного состояния принимает следующий вид:
«МАТИ-РГТУ им. К.Э.Циолковского»
По дисциплине : Химия
Тема:Строение и Свойства Марганеца
Студент 1 курса
Бессонов Илья Игоревич
Евдокимов Сергей Васильевич
1)Электронная формула атома Марганца
2)Физический смысл всех индексов у атома Марганца в таб.Менделеева
3)Электронная конфигурация атома Марганца
4)Распределение валентных электронов Марганца по энергетическим ячейкам
5)Наборы квантовых чисел валентных электронов
6)Принадлежность Марганца к классу веществ
7)Степени окисления Марганца
8)Прогнозирование типа гибридизации валентных атомных орбиталей при образовании бинарных соединений
Mn
Атомный номер Mn — 25. Он показывает заряд ядра атома, кол-во протонов в ядре, кол-во электронов в атоме.
Mn располагается в IV периоде. Период показывает кол-во энергетических уровней.
Mn располагается в VII группе. Номер группы совпадает с числом валентных электронов, способных участвовать в образовании химических связей
Mn — d-элемент. Его валентные подуровни : 4s^2,3d^5.
Марганец в таблице менделеева занимает 25 место, в 4 периоде.
| Символ | Mn |
| Номер | 25 |
| Атомный вес | 54.9380440 |
| Латинское название | Manganum,Manganesium |
| Русское название | Марганец |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема марганца
Mn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5
Короткая запись:
Mn: [Ar] 4s 2 3d 5
Одинаковую электронную конфигурацию имеют атом марганца и V -2 , Fe +1 , Co +2 , Ni +3
Порядок заполнения оболочек атома марганца (Mn) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Марганец имеет 25 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления марганца
Атомы марганца в соединениях имеют степени окисления 7, 6, 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы марганца
Валентность Mn
Атомы марганца в соединениях проявляют валентность VII, VI, V, IV, III, II, I.
Валентность марганца характеризует способность атома Mn к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mn
Квантовые числа определяются последним электроном в конфигурации, для атома Mn эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Строение атома марганца (mn), схема и примеры
Относится к элементам d — семейства. Металл. Обозначение – Mn. Порядковый номер – 25. Относительная атомная масса – 54,931 а.е.м.
Атом марганца состоит из положительно заряженного ядра (+25), внутри которого есть 25 протонов и 30 нейтронов, а вокруг, по четырем орбитам движутся 25 электронов.
Рис.1. Схематическое строение атома марганца.
- Распределение электронов по орбиталям выглядит следующим образом:
- Состояние считается более энергетически выгодным, если на d-подуровне находится 5 или 10 электронов.
- Энергетическая диаграмма основного состояния принимает следующий вид:
- Еще один d-элемент — марганец — Mn.
- Электронное строение атома
В отличие от Хрома , у марганца не наблюдается провала электронов. На внешнем уровне их 7 (2 s-электрона и 5 d-электронов). Соответственно, степень окисления марганца может быть +2, +3, +4, +6, +7 (+1, +5 — очень редкие, мало характерны).
Серебристо-белый металл. Так же, как и хром, малоактивный — легко на воздухе пассивируется — окисляется кислородом.
- Взаимодействие с кислородом: Mn + O2 = MnO2
Оксиды марганца:
- MnO — серо-зеленый , быстро окисляется до MnO2,
- Mn2O3 — коричнево-черный ,
- MnO2 — темно-коричневый ,
- Mn2 O 7 — кислотный оксид, очень сильный окислитель — жидкость зелено-бурого цвета . Очень неустойчивый
- Взаимодействие с водой: Mn + 2H2O = (t) =Mn(OH)2 + H2
- Взаимодействие с кислотами:
- Mn + HNO3 (конц) ≠
- 3Mn + 8HNO3 (разб) = 3Mn(NO3)2 + 2NO + 4H2O
- Mn + 2H2SO4 (конц)= MnSO4 + SO2 + 2H2O
- Mn + H2SO4 (разб) = MnSO4 + H2
с кислотами-неокислителями:
В школьном курсе химии чаще всего встречаются соединения марганца: соли Mn(+2), оксид MnO2 и соли — перманганаты. Их свойства мы и рассмотрим.
- Mn(2+) — вступает в обычные обменные реакции: MnCl2 + H2SO4 = MnSO4 + 2HCl MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl
- MnO2 — часто реагирует как окислитель: MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O.
Тонкое непроводящее кольцо радиуса r
- Оксиду Mn2O7 соответствует кислота HMnO4 — марганцовая кислота. В свободном виде она встречается очень редко. А вот соли ее используются широко и обычно это растворы малинового цвета . Это очень мощные окислители: 2KMnO4 + 2H2S = 2MnO2 + SO2 + K2S + 2H2O
При нагревании перманганат калия разлагается: 2KMnO4 = K2MnO4 (манганат калия) + MnO2 + O2
- Манганаты: K2MnO4 раствор зеленого цвета — тоже очень сильные окислители.
- Восстановление перманаганатов происходит следующим образом:
- в кислой среде — до соединений Mn(2+)
- в нейтральной — до Mn(4+) — MnO2, например.
- в щелочной — до Mn (6+)
Эта схема отражает изменение цветов соединений марганца при повышении степени окисления.
«МАТИ-РГТУ им. К.Э.Циолковского»
- По дисциплине : Химия
- Тема:Строение и Свойства Марганеца
- Студент 1 курса
- Бессонов Илья Игоревич
- Евдокимов Сергей Васильевич
- 1)Электронная формула атома Марганца
- 2)Физический смысл всех индексов у атома Марганца в таб.Менделеева
- 3)Электронная конфигурация атома Марганца
- 4)Распределение валентных электронов Марганца по энергетическим ячейкам
- 5)Наборы квантовых чисел валентных электронов
- 6)Принадлежность Марганца к классу веществ
- 7)Степени окисления Марганца
- 8)Прогнозирование типа гибридизации валентных атомных орбиталей при образовании бинарных соединений
Атомный номер Mn — 25. Он показывает заряд ядра атома, кол-во протонов в ядре, кол-во электронов в атоме.
Mn располагается в IV периоде. Период показывает кол-во энергетических уровней.
Mn располагается в VII группе. Номер группы совпадает с числом валентных электронов, способных участвовать в образовании химических связей
Mn — d-элемент. Его валентные подуровни : 4s^2,3d^5.
Свойства марганца | Дистанционные уроки
- Еще один d-элемент — марганец — Mn.
- Электронное строение атома
В отличие от Хрома, у марганца не наблюдается провала электронов. На внешнем уровне их 7 (2 s-электрона и 5 d-электронов). Соответственно, степень окисления марганца может быть +2, +3, +4, +6, +7 (+1, +5 — очень редкие, мало характерны).
Серебристо-белый металл. Так же, как и хром, малоактивный — легко на воздухе пассивируется — окисляется кислородом.
- Взаимодействие с кислородом: Mn + O2 = MnO2
Оксиды марганца:
- MnO — серо-зеленый, быстро окисляется до MnO2,
- Mn2O3 — коричнево-черный,
- MnO2 — темно-коричневый,
- Mn2O7 — кислотный оксид, очень сильный окислитель — жидкость зелено-бурого цвета. Очень неустойчивый
- Взаимодействие с водой: Mn + 2H2O = (t) =Mn(OH)2 + H2
- Взаимодействие с кислотами:
c кислотами-окислителями- Mn + HNO3 (конц) ≠
- 3Mn + 8HNO3 (разб) = 3Mn(NO3)2 + 2NO + 4H2O
- Mn + 2H2SO4 (конц)= MnSO4 + SO2 + 2H2O
- Mn + H2SO4 (разб) = MnSO4 + H2
с кислотами-неокислителями:
В школьном курсе химии чаще всего встречаются соединения марганца: соли Mn(+2), оксид MnO2 и соли — перманганаты. Их свойства мы и рассмотрим.
- Mn(2+) — вступает в обычные обменные реакции:
MnCl2 + H2SO4 = MnSO4 + 2HCl
MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl - MnO2 — часто реагирует как окислитель:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O.
- Оксиду Mn2O7 соответствует кислота HMnO4 — марганцовая кислота. В свободном виде она встречается очень редко. А вот соли ее используются широко и обычно это растворы малинового цвета. Это очень мощные окислители:
2KMnO4 + 2H2S = 2MnO2 + SO2 + K2S + 2H2O
При нагревании перманганат калия разлагается: 2KMnO4 = K2MnO4 (манганат калия) + MnO2 + O2
- Манганаты: K2MnO4 раствор зеленого цвета— тоже очень сильные окислители.
- Восстановление перманаганатов происходит следующим образом:
- в кислой среде — до соединений Mn(2+)
- в нейтральной — до Mn(4+) — MnO2, например.
- в щелочной — до Mn (6+)
Эта схема отражает изменение цветов соединений марганца при повышении степени окисления.
Обсуждение: «Свойства марганца»
Марганец -общая характеристика элемента, химические свойства хрома и его соединений
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd54s2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
- Шкала степеней окисления марганца:
- +7 — Mn2O7 , MnO4— ,HMnO4 ,KMnO4
- + 6 — MnO42- , K2MnO4
- +4 — MnO2 , Mn(SO4)2 ,MnF4 ,K3[MnF6]
- +3 — Mn2O3, MnO(OH),Mn2(SO4)3 ,MnF , K3[MnF6]
- + 2 — Mn2+ , MnO, Mn(OH)2 , MnSO4 ,MnCl2
- 0 — Mn
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl).
Соединения Мn‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn‖‖‖ и Мn IV — амфотерные свойства, для соединений МnVI и МnVII характерно почти полное преобладание кислотных свойств.
Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
- При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
- Mn→(O2, до450oC) MnO2 →(O2, до 800oC) Mn2O3
- Mn→MnO+(MnIIMn2II)O4“окалина“ ( O2, выше 800oC)
- Mn+Cl2→MnCl2 , (200oC) Mn+S→ MnS (до1580oC)
- В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
- Мn (порошок) + 2Н+ = Мn2+ + Н2↑
- Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
- Мn + 2Н2SO4 (конц.) = МnSO4 + SO2↑+ 2Н2O
- 3Мn + 8HNO3 (разб.) = 3Мn(NO3)2 + 2NO↑ + 4Н2O
- Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (МnIIMnIII)O4 коксом или алюминием:
- МnO2 + С (кокс) = Мn + СO2 (600 °С)
- 3(МnII MnIII)O4 + 8Аl = 9Мn + 4А12O3(700-900 °С)
- Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
- 2MnSO4+2H2O→2Mn↓+O2↑+2H2SO4 (40oC, эликтролиз)
- Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
- Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O.
Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе.
Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
- Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
- Уравнения важнейших реакций:
- 4МnO2 = 2Мn2O3 + O2 (530-585 °С)
- 2МnO2 + 2Н2SO4(конц.) = МnSO4 + O2↑ + 2Н2O (кипячение)
- МnO2 + 4НС1(конц.) = МnС12 + С12↑ + 2Н2O
- МnO2 + Н2SO4 (гор.) + КNO2 = МnSO4 + КNO3 + Н2O
- МnO2 + 2Н2SO4 + 2FeSO4 = МnSO4 + Fе2(SO4)3 + 2Н2O
- МnO2 + 2КОН + КNO3 = К2MnO4 + KNO2 + Н2O (350-450 °С)
- ЗМnO2 + ЗК2CO3 + КС1O3 = ЗК2MnO4+ КС1 + ЗCO2 (400 °С)
- В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO42-. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
- Уравнения важнейших реакций:
- 3K2MnO4(конц) +2H2O→(t) 2KMnO4+MnO2↓+4KOH
- 3K2MnO4(разб)+4HCl=2KMnO4+MnO2↓+2H2O+4KCl
- K2 MnO4 +8HCl(конц)=MnCl2+2Cl2↑+4H2O+2KCl
- 3K2MnO4+2H2O+4CO2(г)=2KMnO4+MnO2↓+4KHCO3
- 2K2 MnO4+Cl2(насыщ)=2KMnO4+2KCl
- 2K2MnO4+2H2O→ H2↑+2KMnO4+KOH (эликтролиз)
- Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления.
Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах.
Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до МnII , в нейтральной среде – до Mn IV в сильнощелочной среде — до МnVI
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
- 2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
- 4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
- 2КМnO4(т) + 16НСl(конц.) = 2МnС12 + 5С12↑ + 8Н2O + 2КС1 (80°С)
- 2КМnO4(т) + 2Н2SO4 (96%) = 2КНSO4 + Мn2O7 + Н2O (на холоду)
- 4КМnO4 (насыщ.) + 4КОН (15%) = 4К2МnO4+ O2↑ + 2Н2O (100 °С)
- 2КМnO4 + 2(NН3• Н2O)= 2МnO2↓ + N2↑ + 4Н2O+ 2КОН (50 °С)
- 2МnO4— + 16Н+ +10I— = 5I2+2Мn2+ + 8Н2O
- 2МnO4— + 6Н+ + 5Н2O2 (разб.) = 2Мn2+ + 5O2↑+ 8Н2O
- 2МnO4— + 6Н+ + 5SO32- =2Мn2+ + 5SO42- + ЗН2O
- МnO4— + 8Н+ + 5Fе2+ = Мn2+ + 5Fе3+ + 4Н2O
- 2МnO4— + 6Н+ + 5NO2— = 2Мn2+ + 5NО3— + 3Н2O
- 2МnO4— + 3Н2S (насыщ.) = 2МnO2↓ + 3S↓ + 2Н2O + 2OН—
- 2МnO4— + Н2O + 3SO32- = 2МnO2↓ + 3SO42-+ 2OH—
- 2МnO4— + 2Н2O + ЗМn2+ = 5МnO2↓ + 4Н+ (50-80 °С)
- 2МnO4— + 2OH— (конц.) + SO32- = 2МnO42-+ SO42- + Н2O
- Получение — электролиз раствора К2MnO4
Mn — Марганец
МАРГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций и рений, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn2+ — 0,080-0,104 нм, иона Mn7+ — 0,039-0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов.
Марганец в компактном виде — твердый серебристо-белый металл.
Физические и химические свойства: марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив a-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм3.
В интервале температур 710-1090°C существует b-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C — g-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив d-Mn с параметром решетки а = 0,30750 нм.
Модификации a, b, и d хрупкие, g-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO.
Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества.
Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO3 = MnO + CO2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn2O3. Этот же оксид марганца образуется при нагревании MnO2 на воздухе при температуре примерно 600°C:
- 4MnO2 = 2Mn2O3 + O2
- Оксид Mn2O3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO2.
- Если MnO2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn3O4:
- 3MnO2 = Mn3O4 + O2
- Этот оксид можно представить как MnO·Mn2О3, и по свойствам Mn3О4 соответствует смеси этих оксидов.
Диоксид марганца MnO2 — наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая b-модификация MnO2 — это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, g-MnO2 также встречается в природе. Это — минерал рамсделит (другое название — полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, — основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO2 можно восстановить водородом до MnO.
- Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами:
- 2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
- Mn2O7 — кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO4.
При взаимодействии марганца с галогенами образуются дигалогениды MnHal2. В случае фтора возможно также образование фторидов состава MnF3 и MnF4, а в случае хлора — также трихлорида MnCl3. Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS2. Известна целая группа нитридов марганца: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2.
С фосфором марганец образует фосфиды составов MnР, MnP3, Mn2P, Mn3P, Mn3P2 и Mn4P. Известно несколько карбидов и силицидов марганца.
- С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH)2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца (II):
- Mn + 2HCl = MnCl2 + H2.
- Из растворов солей Mn2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH)2:
- Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
- Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4).
- Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
- 2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH,
- так и восстановителей
- 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
- В водных растворах манганаты диспропорционируют на соединения марганца (+4) и марганца (+7):
- 3K2MnO4 + 3Н2О = 2KMnO4 + MnO2·Н2О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном.
- Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата:
- 2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4.
- При давлении около 10 МПа безводный MnCl2 в присутствии металлоорганических соединений реагирует с оксидом углерода (II) CO с образованием биядерного карбонила Mn2(CO)10.
История открытия: один из основных материалов марганца — пиролюзит — был известен в древности как черная магнезия и использовался при варке стекла для его осветления.
Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю.
Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Нахождение в природе: в земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается.
Из руд наиболее распространены пиролюзит MnO2 (содержит 63,2 % марганца), манганит MnO2·Mn(OH)2 (62,5 % марганца), браунит Mn2O3 (69,5 % марганца), родохрозит MnCo3 (47,8 % марганца), псиломелан mMnO·MnO2·nH2O (45-60% марганца) и ряд других.
Марганец содержат железо-марганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10–8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию.
Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний.
Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе при восстановлении руд железа и марганца коксом. В ферромарганце содержание углерода составляет 6-8 % по массе.
Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4, который проводят в присутствии сульфата аммония (NH4)2SO4.
Применение: более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других), а также для легирования сталей, т. е.
улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту.
Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10.
Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений.
Биологическая роль: марганец — микроэлемент, постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности.
Содержание марганца в растениях составляет 10–4-10–2 %, в животных 10–3-10–5 %, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца.
Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на проветривание и минеральный обмен.
Человек с пищей получает ежедневно 0,4-10 мг марганца. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия).
Однако избыток марганца для человеческого организма вреден. При отравлении соединениями марганца происходит поражение нервной системы, развивается так называемый марганцевый паркинсонизм. ПДК в расчете на марганец для воздуха 0,03 мг/м3. Токсическая доза (для крыс) — 10-20 мг.
Источник