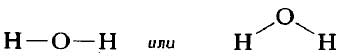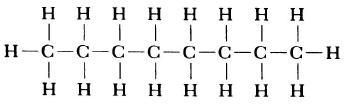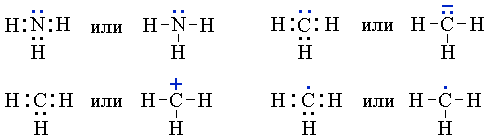В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Содержание
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
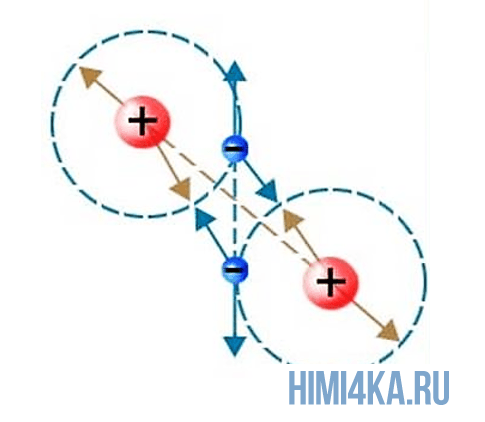
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
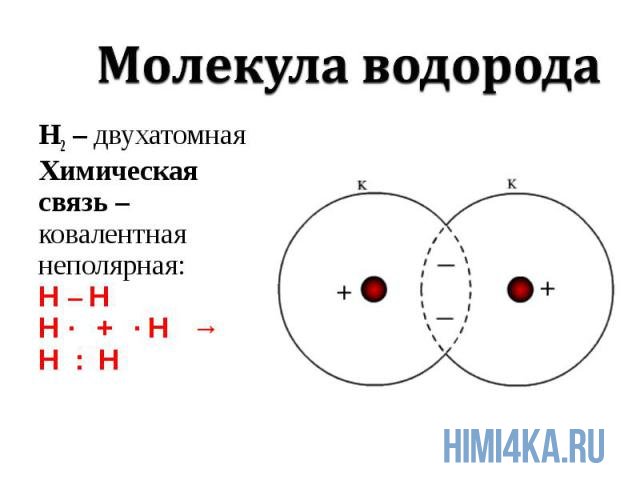
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
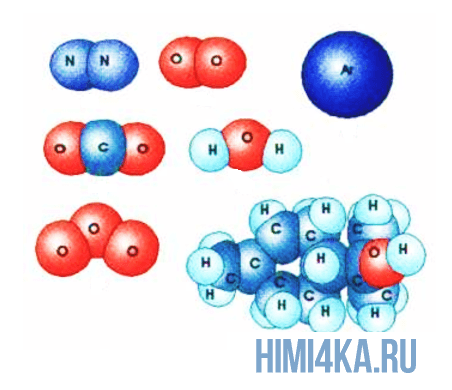
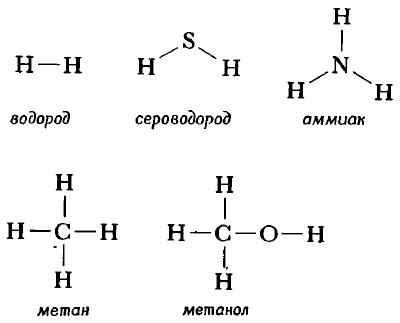
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
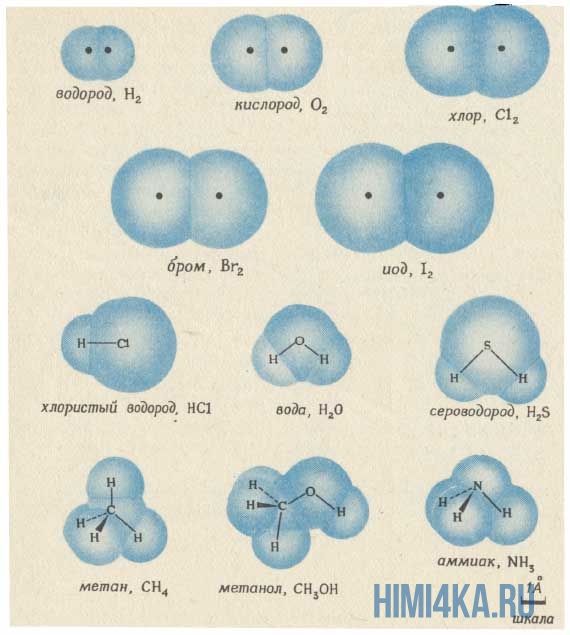
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- 1×2 + 16 = 18
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положения метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).
Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются ss. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s < σ *1s < σ 2s <σ *2s < σ 2pz < π 2рх = π 2ру < π *2рх = π *2ру < σ *2pz.
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
σ 1s < σ *1s < σ 2s <σ *2s < π 2px = π 2ру < σ 2pz <π *2рх = π *2ру < σ *2pz.
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
Процесс образования частицы H2+ можно представить следующим образом:
Н[1s] + Н+ → H2+[σ 1s].
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2+ равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s)2]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2— имеет электронную конфигурацию:
H2— [(σ 1s)2(σ *1s)1]
Кратность связи в H2— составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s)2]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s2) Ве2 [KK*(σ 2s)2 (σ *2s)2]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s)2 (π *2s)2 (π2px)2 (π2py)2 (σ 2pz)2]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
O2 [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)1]
Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2+ и O2— . В ионе O2+ на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1]
или
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2py)1]
Кратность связи в ионе О2+ равна (8–3):2 = 2,5. В ионе O2— на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)1]
или
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)2]
Кратность связи в ионе О2— равна (8 – 5):2 = 1,5. Ионы О2— и О2+ являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
F2 [KK(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)2]
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2— , О2, О2+ кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO+, CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ2pz)2]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2px)1] или
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2py)1]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO— :
NO— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 (π*2px)1(π*2py)1]
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO+ имеет следующее электронное строение:
NO+ [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO+ равна трём.
В ряду NO— , NO, NO+ избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF+; NF —; NF.
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO—; CO; CO+.
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2+; Be2; Be2+.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
6. Используя метод МО, определите кратность связи в молекуле С2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
7. На основе метода МО объясните, почему не существует молекулы Ne2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
9. Распределите электроны на молекулярных орбиталях для иона CN—. Определите кратность связи в этом ионе.
|
CN— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]. |
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN+, CN, CN—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: CN+ [KK*(σ2s)2 (σ*2s2 (π2px)2 (π2py)2 ]; CN [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)1]; CN— [KK*(σ2s) 2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 ]. Избыток связывающих электронов в CN+, CN, CN— соответственно составляет 4, 5, 6. |
Электронные формулы молекул
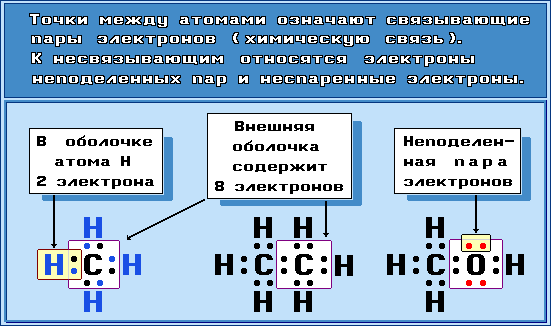
Для изображения электронного строения молекул, ионов или радикалов используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа – октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т.е. 2 валентных электрона.
Примеры электронных формул
- Элементы 3-го и последующих периодов, имеющие на внешнем валентном уровне относительно низкие по энергии 3d-орбитали, могут за счет участия этих орбиталей образовывать более 4-х ковалентных связей. В этом случае правило октета теряет свою силу, например, в соединениях фосфора и серы: (C2H5)3P=O,
CH3-SO3H.
Связывающие электронные пары, соответствующие ковалентным связям между атомами, чаще изображают валентной чертой. Несвязывающие электроны (электроны неподеленных пар, неспаренные электроны в свободных радикалах) обозначают точками, формальные заряды в ионах – знаками “+” или “–”:
Электронные формулы молекул (а также ионов и свободных радикалов) нашли широкое применение в органической химии. Однако они не отражают пространственного строения молекул. Поэтому в тех случаях, когда необходимо иметь представление не только о распределении электронов, но и о пространственном строении органических соединений, используются атомно-орбитальные модели, которые служат основой для построения стереохимических (пространственных) формул молекул.
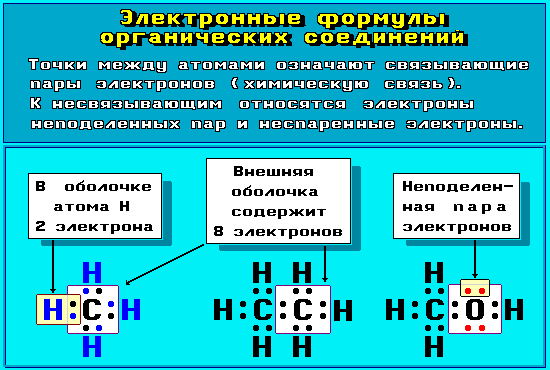
Для
изображения электронного строения
молекул, ионов или радикалов используются
электронные формулы (структуры Льюиса,
октетные формулы). При написании
электронной формулы должно выполняться
правило
октета,
согласно которому атом, участвуя в
образовании химической связи (отдавая
или принимая электроны), стремится
приобрести электронную конфигурацию
инертного газа – октет (восемь) валентных
электронов (рис. 4.8.1 и 4.8.2). Исключение
составляет атом водорода, для которого
устойчивой является конфигурация гелия,
т.е. 2 валентных электрона.
Рис.
4.8.1. Электронные формулы органических
соединений
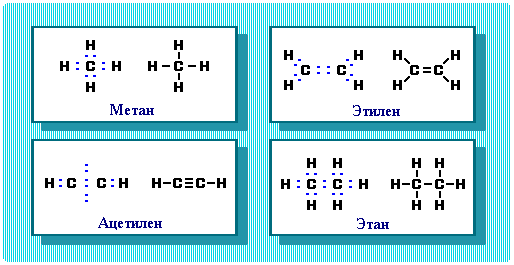
Рис.
4.8.2. Примеры электронных формул
Электронные
формулы молекул (а также ионов и свободных
радикалов) нашли широкое применение в
органической химии. Однако они не
отражают пространственного строения
молекул. Поэтому в тех случаях, когда
необходимо иметь представление не
только о распределении электронов, но
и о пространственном строении органических
соединений, используются атомно-орбитальные
модели,
которые служат основой для построения
стереохимических (пространственных)
формул молекул.
ЛЬЮИС
Гилберт
Ньютон
(23.X.1875 – 23.III.1946)
Американский физико-химик, член
Национальной АН США (с 1913). Родился в
Уэймуте (штат Массачусетс). Окончил
Гарвардский университет (1896), совершенствовал
образование (1900-1901) в Лейпцигском
университете (у В.Ф. Оствальда) и в
Геттингенском университете (у В.Ф.
Нернста). Работал в Гарвардском
университете (1896-1900, 1901-1903, 1906-1907). 1904-1905
– управляющий Палаты мер и весов и химиком
в Бюро науки в Маниле (Филиппины).
1907-1912 – ассистент профессора, затем
профессор в Массачусетском технологическом
институте в Кембридже. С 1912 – Калифорнийский
университет в Беркли. Во время первой
мировой войны – полковник Военно-химической
службы США (разрабатывал способы защиты
от отравляющих газов). Иностранный
почетный член АН СССР (с 1942).
Основные работы посвящены химической
термодинамике и теории строения вещества.
-
Определил свободную энергию многих
соединений. Ввел (1907) понятие
термодинамической активности. -
Уточнил формулировку закона действующих
масс, предложенную К.М. Гульдбергом и
П. Вааге. -
Развил (1916) теорию ковалентной связи.
Его концепция обобщенной электронной
пары оказалась очень плодотворной для
органической химии. -
Предложил новую теорию кислот как
акцепторов пары электронов и оснований
как доноров пары электронов. -
Ввел (1929) термин “фотон”.
-
Совместно с Р. Макдональдом и Ф. Спеддингом
разработал (1933) метод получения тяжелой
воды.
4.9. Атомно-орбитальные модели
Для наглядного
изображения пространственного и
электронного строения молекул, ионов,
свободных радикалов удобно использовать
атомно-орбитальные модели, отражающие
на основе электронных представлений
взаимное расположение атомных орбиталей
разного типа:
-
участвующих
в образовании ковалентных связей; -
с
неспаренным электроном; -
с
неподеленной электронной парой; -
вакантных
(например, в карбокатионах).
В виде
электронного облака изображают обычно
р-АО и не участвующие в образовании
-связей
гибридные АО; остальные АО обозначаются
валентной чертой или клиньями в
зависимости от их ориентации в
пространстве.
Простая
линия (валентная черта) изображает оси
орбиталей, лежащие в
плоскости
рисунка; сплошной клин соответствует
АО, расположенной над
плоскостью рисунка; штрихованный клин
изображает АО, направленную за
эту плоскость.
Для построения
АО-моделей сначала следует определить
тип гибридизации каждого атома и затем
последовательно в порядке химического
связывания атомов изобразить их атомные
орбитали с учетом образуемых углов.
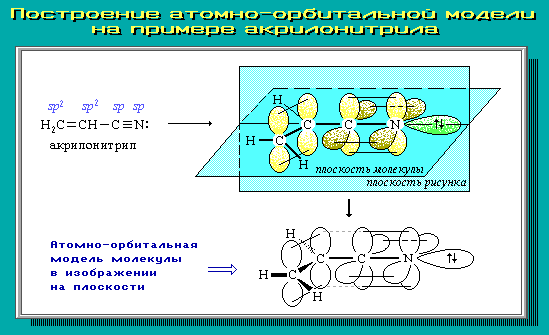
Примеры АО-моделей
некоторых молекул:
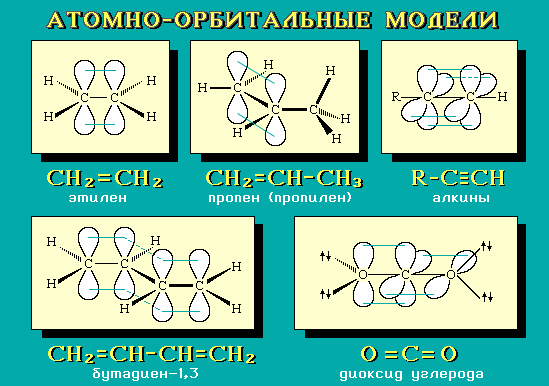
Умение
представить молекулу в виде
атомно-орбитальной модели помогает
понять не только особенности ее
электронного и пространственного
строения, но и механизмы передачи
взаимного влияния атомов (электронные
и пространственные эффекты), которые
определяют поведение органических
соединений в химических реакциях. Кроме
того, с помощью АО-моделей можно объяснить
существование делокализованных
-связей.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
26.03.2016108.03 Кб231.doc
- #
- #
- #
- #
- #
- #
- #
Метод молекулярных орбиталей (ММО, МО).
Глава 4. Химическая связь и строение молекул
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2+ одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
4.5.1. Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:
3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе молекулярных орбиталей ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).
Рис. 12. Энергетическая схема образования молекулы водорода Н2
Рассмотрение химических связей в методе молекулярных орбиталей заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1—3, объясним образование молекулы H2 с точки зрения метода молекулярных орбиталей. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E1 < E2, а энергия второй E2 < E3.
Молекулярная орбиталь, энергия которой меньше энергии атомной орбитали изолированного атома, называется связывающей (обозначается символом св), а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр), а находящиеся на ней электроны — разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую молекулярную орбиталь, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу молекулярных орбиталей образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода молекулярных орбиталей реакцию образования молекулы водорода из атомов записывают так:
2H[1s1] = H2[(σ CB1s)2],
т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой молекулярной орбитали заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:
В молекуле водорода В = (2—0) : 2=1, водород одновалентен. Молекула Н2 диамагнитна (электроны спарены).
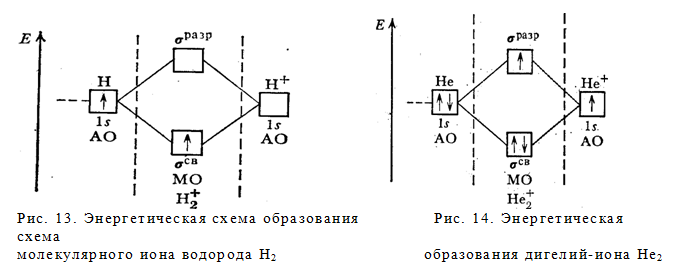
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н2+ (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь св1s. Уравнение процесса:
H[1s1] + H+ = H2+[(σсв1s)1], ∆H = — 259,4 кДж
Число связей в ионе H2+ равно ½ (связь одним электроном). Ион H2+ — парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не2+ (рис.14). Уравнение его образования
He[1s2] + He+[1s1] = He2+ [(σCB 1s)2 (σ разр1s)1], ∆H = — 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2—1) : 2 = 1/2. Ион— парамагнитен (имеет неспаренный электрон).
Рис. 15 . Энергетическая схема образования двухатомных гомонуклеарных молекул элементов второго периода
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода. Рассмотренный принцип построения молекулярных орбиталей из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2рx-, 2рy— и 2рz-орбиталей.
Участием внутренних электронов 1s-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2s-орбиталь одного атома взаимодействует только с 2s-орбиталью другого атома (должна быть близость значений энергий взаимодействующих орбиталей), образуя МО σ2sсв и σ2sразр. При перекрывании (взаимодействии) 2р-орбиталей обоих атомов образуются МО: σхсв, σхразр, πусв, πуразр, πzсв, πzразр
(рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть молекулярных орбиталей – три связывающих и три разрыхляющих. Молекулярные орбитали, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой , а из ру— и рz— – буквой . С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода молекулярных орбиталей.
Рис. 16. Энергетическая схема образования молекулы Li2
Пример 1. Молекула лития Li2. Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K:
2Li[K2s] = Li2[KK(σCB2s)2]
Число связей равно 1.
Пример 2. Молекула бериллия Be2. Восемь электронов молекулы размещены на МО следующим образом:
Ве2[KK(σ CB2s)2 (σ разр2s)2]
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3. Молекула азота N2 (рис. 17). Распределение 14 электронов по МО записывается так:

Рис. 17. Энергетическая схема образования молекулы N2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O2 (рис. 18). Электроны размещаются по молекулярным орбиталям в последовательности:
В молекуле две валентные связи. Последние два электрона разместились на различных π-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.

Рис. 18. Энергетическая схема образования молекулы O2
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования молекулярных орбиталей гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.
Рис. 19 . Энергетическая схема образования двух атомных гетеронуклеарных молекул элементов второго периода
Пример 5.Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s22p2, а кислорода 2s22p4. Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали σ2sсв , два – на орбитали σ2sразр, четыре – на орбиталях πyCB и πzCB, а девятый и десятый – на σхсв. Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:
Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N2). Молекула диамагнитна – все электроны спарены.
Пример 6. Молекула NO. На МО молекулы оксида азота (II) должны разместиться 11 электронов: пять азота – 2s22p3 и шесть кислорода – 2s22p4. Десять из них размещаются так же, как и электроны молекулы оксида углерода (II) (пример 5), а одиннадцатый разместится на одной из разрыхляющих орбиталей – πy разр или πZ разр (эти орбитали энергетически эквивалентны между собой). Тогда
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая —677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.
Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора 3s23р3 (учитывая правило Хунда, ) по квантовым ячейкам имеет вид:
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:
Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 8. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp2-, sp3-гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Таблица 13.
Гибридизация орбиталей и пространственная конфигурация молекул
Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F+2 и О+2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N+2 , чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σCB1s<σразр1s<σCB2s<σразр2s<σCB2px<πCB2py =
= πCB2pz<πразр2py=πразр2pz< σразр2x
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей 2рx-орбитали больше энергии связывающих 2ру— и 2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих 2ру— и 2рz-орбиталей больше энергии связывающей 2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).
Рис.20. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами . Так, электронная конфигурация молекулы O2 записывается следующим образом:
O2 [КК (σsCB)2 (σsразр)2(σpxCB)2 (πpyCB)2 πpzразр πpyразр πpzразр]
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.