Для химии большой интерес представляет строение электронной оболочки атомов. Под электронной оболочкой атомов понимают совокупность всех электронов в атоме. Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, которые обладают близкими значениями энергии, образуют единый энергетический уровень. Число энергетических уровней в атоме = номеру периода в ПСХЭ, которому принадлежит химический элемент.
-s-орбиталь, максимум на ней находится 2 электрона,
– p-орбиталь, максимум на ней находится 6 электронов,
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
– d-орбиталь, максимум на ней находится 10 электронов,
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
– f-орбиталь, максимум на ней находится 14 электронов.
1. Составление электронной формулы химического элемента
Вот как выглядит порядок заполнения уровней и подуровней в многоэлектронных атомах (это атомы большинства элементов):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7р
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами (рис. 1). При этом нельзя располагать на каждой орбитали более двух электронов.
3. Записываем электронную формулу химического элемента.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
Запись электронной формулы проще показать на конкретном примере.
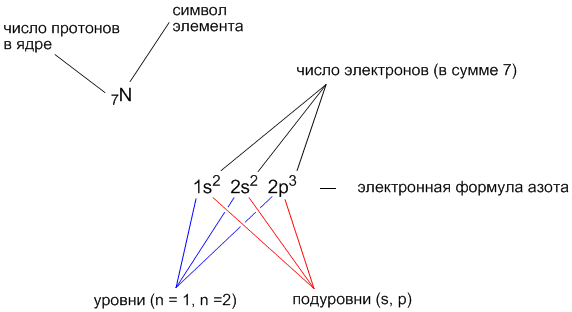
Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона – на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
7N
1s 2s 2p
Рис. 1. Электронная и структурная формулы атома азота N
Максимальное количество электронов ē на энергетическом уровне можно определить по формуле: N=2*n2, где N – максимальное количество электронов на энергетическом уровне; n – номер энергетического уровня.
Алгоритм характеристики химического элемента (ХЭ) по положению в ПСХЭ:
- Знак ХЭ
- Порядковый номер ХЭ
- Номер периода, в котором находится ХЭ
- Характеристика периода (малый или большой)
- Номер группы, в которой находится ХЭ
- Тип подгруппы (главная (а) или побочная (б))
- Относительная атомная масса ХЭ
- Число протонов в атоме ХЭ (равняется порядковому номеру ХЭ)
- Число нейтронов в атоме ХЭ (из относительной атомной массы вычесть порядковый номер ХЭ)
- Число электронов в атоме ХЭ (равняется количеству протонов)
- Число энергетических уровней в атоме ХЭ (равняется номеру периода, в котором находится ХЭ)
- Расположение электронов на энергетических уровнях
- Сравнение металлических свойств ХЭ с соседями по периоду
- Сравнение металлических свойств ХЭ с соседями по подгруппе
- Формула высшего оксида
- Если описываете Металл, то формула высшего гидроксида Меn+(ОН)–n
Если описываете НеМеталл, то формула соответствующей кислоты
Просмотр содержимого документа
«Практическая работа по теме “Составление электронного паспорта химического элемента. Характеристика химического элемента по его положению в ПСХЭ”»
Практическая работа №2
Тема: Составление электронного паспорта химического элемента. Характеристика химического элемента по его положению в ПСХЭ
Цель: научиться составлять электронный паспорт химического элемента и характеризовать ХЭ по положению в ПСХЭ.
Оборудование: ПСХЭ Д.И. Менделеева, учебник, калькулятор.
Ход работы:
1 Краткая теоретическая часть. Прочитайте и сделайте краткий конспект в тетрадь.
Для химии большой интерес представляет строение электронной оболочки атомов. Под электронной оболочкой атомов понимают совокупность всех электронов в атоме. Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, которые обладают близкими значениями энергии, образуют единый энергетический уровень. Число энергетических уровней в атоме = номеру периода в ПСХЭ, которому принадлежит химический элемент.
|
↑↓ |
-s-орбиталь, максимум на ней находится 2 электрона,
|
↑↓ |
↑↓ |
↑↓ |
– p-орбиталь, максимум на ней находится 6 электронов,
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
– d-орбиталь, максимум на ней находится 10 электронов,
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
– f-орбиталь, максимум на ней находится 14 электронов.
1. Составление электронной формулы химического элемента
Вот как выглядит порядок заполнения уровней и подуровней в многоэлектронных атомах (это атомы большинства элементов):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7р
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами (рис. 1). При этом нельзя располагать на каждой орбитали более двух электронов.
3. Записываем электронную формулу химического элемента.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
Запись электронной формулы проще показать на конкретном примере.
Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона – на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
↑↓
↑↓
↑
↑
↑
↑
↑
7N
1s 2s 2p
Рис. 1. Электронная и структурная формулы атома азота N
Максимальное количество электронов ē на энергетическом уровне можно определить по формуле: N=2*n2, где N – максимальное количество электронов на энергетическом уровне; n – номер энергетического уровня.
Алгоритм характеристики химического элемента (ХЭ) по положению в ПСХЭ:
-
Знак ХЭ
-
Порядковый номер ХЭ
-
Номер периода, в котором находится ХЭ
-
Характеристика периода (малый или большой)
-
Номер группы, в которой находится ХЭ
-
Тип подгруппы (главная (а) или побочная (б))
-
Относительная атомная масса ХЭ
-
Число протонов в атоме ХЭ (равняется порядковому номеру ХЭ)
-
Число нейтронов в атоме ХЭ (из относительной атомной массы вычесть порядковый номер ХЭ)
-
Число электронов в атоме ХЭ (равняется количеству протонов)
-
Число энергетических уровней в атоме ХЭ (равняется номеру периода, в котором находится ХЭ)
-
Расположение электронов на энергетических уровнях
-
Сравнение металлических свойств ХЭ с соседями по периоду
-
Сравнение металлических свойств ХЭ с соседями по подгруппе
-
Формула высшего оксида
-
Если описываете Металл, то формула высшего гидроксида Меn+(ОН)–n
Если описываете НеМеталл, то формула соответствующей кислоты
-
Выполните следующие задания самостоятельно:
2.1.Составьте электронный паспорт для элементов: Ga, Kr, Fe, Ag, Rb, I, Si, Ba, Mo.
-
Охарактеризуйте по положению в ПСХЭ элементы: Ва, Fe.
3. Напишите вывод о проделанной работе.
Загрузить PDF
Загрузить PDF
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
-
1
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
-
2
Определите заряд атома. Нейтральные атомы будут иметь столько же электронов, сколько показано в таблице Менделеева. Однако заряженные атомы будут иметь большее или меньшее число электронов — в зависимости от величины их заряда. Если вы работаете с заряженным атомом, добавляйте или вычитайте электроны следующим образом: добавляйте один электрон на каждый отрицательный заряд и вычитайте один на каждый положительный.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
-
3
Запомните базовый список орбиталей. По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома согласно определенной последовательности. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов. Имеются следующие подуровни:
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой “s”) содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема:[1]
Sober Physicists Don’t Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
-
4
Разберитесь в записи электронной конфигурации. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Орбитали записываются последовательно, причем количество атомов в каждой орбитали записывается как верхний индекс справа от названия орбитали. Завершенная электронная конфигурация имеет вид последовательности обозначений подуровней и верхних индексов.
- Вот, например, простейшая электронная конфигурация: 1s2 2s2 2p6. Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
-
5
Запомните порядок орбиталей. Имейте в виду, что электронные орбитали нумеруются в порядке возрастания номера электронной оболочки, но располагаются по возрастанию энергии. Например, заполненная орбиталь 4s2 имеет меньшую энергию (или менее подвижна), чем частично заполненная или заполненная 3d10, поэтому сначала записывается орбиталь 4s. Как только вы будете знать порядок орбиталей, вы сможете с легкостью заполнять их в соответствии с количеством электронов в атоме. Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
-
6
Заполняйте орбитали согласно количеству электронов в вашем атоме. Например, если мы хотим записать электронную конфигурацию нейтрального атома кальция, мы должны начать с поиска его атомного номера в таблице Менделеева. Его атомный номер — 20, поэтому мы напишем конфигурацию атома с 20 электронами согласно приведенному выше порядку.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2.
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
-
7
Используйте таблицу Менделеева как визуальную подсказку. Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях. Например, атомы во второй колонке слева всегда заканчиваются на “s2“, а атомы на правом краю тонкой средней части оканчиваются на “d10” и т.д. Используйте периодическую систему как визуальное руководство к написанию конфигураций — как порядок, согласно которому вы добавляете к орбиталям соответствует вашему положению в таблице. Смотрите ниже:
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: “Этот атом расположен в третьем ряду (или “периоде”) таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на …3p5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
-
8
Выучите сокращения написания длинных электронных конфигураций. Атомы на правом краю периодической системы называются благородными газами. Эти элементы химически очень устойчивы. Чтобы сократить процесс написания длинных электронных конфигураций, просто записывайте в квадратных скобках химический символ ближайшего благородного газа с меньшим по сравнению с вашим атомом числом электронов, а затем продолжайте писать электронную конфигурацию последующих орбитальных уровней. Смотрите ниже:
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Однако мы видим, что 1s2 2s2 2p6 3s2 3p6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s2 3d10.
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
Реклама
-
1
Освойте периодическую таблицу ADOMAH. Данный метод записи электронной конфигурации не требует запоминания, однако требует наличия переделанной периодической таблицы, поскольку в традиционной таблице Менделеева, начиная с четвертого периода, номер периода не соответствует электронной оболочке. Найдите периодическую таблицу ADOMAH — особый тип периодической таблицы, разработанный ученым Валерием Циммерманом. Ее легко найти посредством короткого поиска в интернете.[2]
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые “каскады” (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
-
2
Найдите ваш атом в таблице ADOMAH. Чтобы записать электронную конфигурацию элемента, найдите его символ в периодической таблице ADOMAH и вычеркните все элементы с большим атомным номером. Например, если вам нужно записать электронную конфигурацию эрбия (68), вычеркните все элементы от 69 до 120.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
-
3
Посчитайте орбитальные подуровни до вашего элемента. Смотря на символы блоков, приведенные справа от таблицы (s, p, d, and f), и на номера колонок, показанные в основании, игнорируйте диагональные линии между блоками и разбейте колонки на блоки-колонки, перечислив их по порядку снизу вверх. И снова игнорируйте блоки, в которых вычеркнуты все элементы. Запишите блоки-колонки, начиная от номера колонки, за которым следует символ блока, таким образом: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. В нашем примере это электронная конфигурация эрбия.
-
5
Учитывайте неправильные электронные конфигурации. Существует восемнадцать типичных исключений, относящихся к электронным конфигурациям атомов в состоянии с наименьшей энергией, также называемом основным энергетическим состоянием. Они не подчиняются общему правилу только по последним двум-трем положениям, занимаемым электронами. При этом действительная электронная конфигурация предполагает нахождение электронов в состоянии с более низкой энергией в сравнении со стандартной конфигурацией атома. К атомам-исключениям относятся:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) и Cm (…, 5f7, 6d1, 7s2).
Реклама
Советы
- Чтобы найти атомный номер атома, когда он записан в форме электронной конфигурации, просто сложите все числа, которые идут за буквами (s, p, d, и f). Это работает только для нейтральных атомов, если вы имеете дело с ионом, то ничего не получится — вам придется добавить или вычесть количество дополнительных или потерянных электронов.
- Число, идущее за буквой — это верхний индекс, не сделайте ошибку в контрольной.
- “Стабильности полузаполненного” подуровня не существует. Это упрощение. Любая стабильность, которая относится к “наполовину заполненным” подуровням, имеет место из-за того, что каждая орбиталь занята одним электроном, поэтому минимизируется отталкивание между электронами.
- Каждый атом стремится к стабильному состоянию, а самые стабильные конфигурации имеют заполненные подуровни s и p (s2 и p6). Такая конфигурация есть у благородных газов, поэтому они редко вступают в реакции и в таблице Менделеева расположены справа. Поэтому, если конфигурация заканчивается на 3p4, то для достижения стабильного состояния ей необходимо два электрона (чтобы потерять шесть, включая электроны s-подуровня, потребуется больше энергии, поэтому потерять четыре легче). А если конфигурация оканчивается на 4d3, то для достижения стабильного состояния ей необходимо потерять три электрона. Кроме того, полузаполненные подуровни (s1, p3, d5..) являются более стабильными, чем, например, p4 или p2; однако s2 и p6 будут еще более устойчивыми.
- Когда вы имеете дело с ионом, это значит, что количество протонов не равно количеству электронов. Заряд атома в этом случае будет изображен сверху справа (как правило) от химического символа. Поэтому атом сурьмы с зарядом +2 имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1. Обратите внимание, что 5p3 изменилось на 5p1. Будьте внимательны, когда конфигурация нейтрального атома заканчивается на подуровни, отличные от s и p. Когда вы забираете электроны, вы можете забрать их только с валентных орбиталей (s и p орбиталей). Поэтому, если конфигурация заканчивается на 4s2 3d7 и атом получает заряд +2, то конфигурация будет заканчиваться 4s0 3d7. Обратите внимание, что 3d7 не меняется, вместо этого теряются электроны s-орбитали.
- Существуют условия, когда электрон вынужден “перейти на более высокий энергетический уровень”. Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон.
- Имеется два варианта записи электронной конфигурации. Их можно записывать в порядке возрастания номеров энергетических уровней или в порядке заполнения электронных орбиталей, как было показано выше для эрбия.
- Также вы можете записывать электронную конфигурацию элемента, записав лишь валентную конфигурацию, которая представляет собой последний s и p подуровень. Таким образом, валентная конфигурация сурьмы будет иметь вид 5s2 5p3.
- Ионы не то же самое. С ними гораздо сложнее. Пропустите два уровня и действуйте по той же схеме в зависимости от того, где вы начали, и от того, насколько велико количество электронов.
Реклама
Об этой статье
Эту страницу просматривали 482 608 раз.
Была ли эта статья полезной?
Процесс написания электронной конфигурации атома любого элемента можно разбить в несколько этапов:
- Определение числа электронов
- Размещение электронов по уровням, подуровням и квантовым ячейкам в соответствии с нижеуказанным правилам.
Первое правило – принцип Паули.
Принцип Паули гласит, что в атоме не может быть двух электронов, для которых одинаковы значения всех четырех квантовых чисел. Они должны находиться в различных квантовых состояниях и отличаться хотя бы одним из четырех квантовых чисел.
Таким образом, с помощью математических преобразований было выяснено, что максимальное число электронов на s-, p-, d-. f- подуровнях соответственно равно 2,6, 10 и 14 независимо от значения n ( где n – характеризует энергетический уровень).
Второе правило – принцип наименьшей энергии.
Этот принцип заключается в том, что размещение электронов по уровням и подуровням должно отвечать энергии наибольшей связи их с ядрами. В связи с этим была найдена следующая экспериментальная последовательность:
1s – 2s – 2p – 3s – 3p – 4s – 3d – 4p – 5s – 4d – 5p – 6s – (5d^2) – 4f – 5d – 6p – 7s – (6d^2) – 5f – 6d – 7p
Третье правило – правило Гунда.
Этому правилу подчиняется размещение электронов по квантовым ячейкам.
Согласно ему, электроны в пределах подуровня (s-, p-, d-, f-) располагаются сначала каждый в отдельной квантовой ячейки в виде неспареных электронов.
Рассмотрим на примере атома хлора.
1 шаг. Открываем таблицу Менделеева и смотрим порядковый номер элемента. В нашем случае порядковый номер равен 17ти. Значит, атом хлора содержит 17 электронов.
2 шаг. Глядя на вышеописанные правила записываем электронную конфигурацию, при этом помним, что в подуровне s максимум мб 2 электрона, в подуровне p – 6.
Значит, у нас максимально заполняются подуровни 1s (два электрона), 2s (два электрона), 2p (6 электронов), 3s (два электрона).
Складывая все электроны (2+2+6+2), которые мы разместили по подуровням, получаем значение 12.
Для того, чтобы нам заполнить оставшийся 3p уровень, мы от общего кол-ва электронов (17) отнимаем полученное выше значение 12. Итого мы получаем, что надо разместить оставшиеся пять электронов на подуровне 3p, а это значит, что на 3p уровне 5 электронов (17-12=5).
Таким образом, электронная конфигурация имеет вид:
Cl: 1s2 2s2 2p6 3s2 3p5
3 шаг. Далее рисуется графически электронная конфигурация.
Ниже всего расположен квадрат 1s подуровня. И дальше в порядке увелечения по принципу сохранения энергии. В соответствии с правилом Гунда, в ячейке расположена два электрона с противоположными спинами (смотрящие в разные стороны стрелочки). Подобным образом заполняем все остальные ячейки.
Дойдя до подуровня 3p, мы помним, что у нас 5 электронов. Поэтому сначала рисуем стрелочки вверх, т.к. 3 ячейки, значит и 3 стрелочки вверх, а затем рисуем стрелочки вниз. Итого получаем, что в последней ячейке у нас есть один неспареный электрон.
С помощью электронной конфигурации мы можем определить все возможные степени окисления того или иного элемента.
Так, например, глядя на выше описанную электронную конфигурацию, мы видим, что у атома хлора есть один неспаренный электрон. Это значит, что для него характерны степени окисление +1, -1 и 0.
Если вам необходимо написать электронную конфигурацию Cl- (хлор минус), то вы прибавляете 1 электрон у уже имеющимся на 3p подуровне. Итого получаете – 1s2 2s2 2p6 3s2 3p6
Для хлор плюс наоборот отнимаете один электрон.
Также не стоит забыть, что атомы отличаются возбужденной и невозбужденной электронной конфигурацией, что обязательно указывается в виде символа *.
В случае, если у нас Cl*, то один спаренный электрон на подуровне 3p переходит на уровень 3d, таким образом получаем три неспаренных электрона, что свидетельствуют о возможной степени окисления +3.
У нас остаются еще неспаренные элетроны, это значит, что может существовать и Cl**, в таком случае с еще одной ячейки 3p перебегает электрон на 3d, таким образом возможна степень окисления хлора +5.
Также может перебегать и электрон с уровня 3s, в этом же случае степень оксиления будет равна +7.
24,2 K
Комментировать ответ…Комментировать…
Электронная формула химического элемента показывает то, как происходит распределение электронов на орбиталях в атоме по энергетическим уровням и подуровням.
Вот что нужно обязательно знать, чтобы правильно составить электронную формулу элемента:
I.
Все орбитали и находящееся на ней электроны характеризуют несколько квантовых чисел.
Среди них в первую очередь стоит выделить числа n и l.
- n – главное квантовое число, определяет общую энергию электрона на орбитали. Это число характеризует энергетический уровень и может принимать значение от 1 до 7.
- l – орбитальное квантовое число. Это число характеризует форму орбитали и энергетический подуровень.
Существует 4 вида орбиталей, различающихся своей формой и направленностью в пространстве.
- s-орбитали (l = 0),
- p-орбитали (l = 1),
- d-орбитали (l = 2),
- f-орбитали (l = 3).
Самое простое строение у s-орбитали, самое сложное – у f-орбитали.
II.
Каждый энергетический уровень содержит n подуровней (то есть чем больше главное квантовое число, тем больше подуровней).
Количество орбиталей, которое может быть на том или ином подуровне, определяется по формуле 2l + 1.
Согласно принципу Паули на одной орбитали может быть максимум 2 электрона (если находится 1 электрон, то он называется неспаренным, если 2 электрона – то это электронная пара).
Таким образом, будет нетрудно посчитать, сколько орбиталей и электронов может включать в себя каждый подуровень.
-
s-подуровень включает 2 * 0 + 1 = 1 орбиталь и 1 * 2 = 2 электрона.
-
p-подуровень включает 2 * 1 + 1 = 3 орбитали и 3 * 2 = 6 электронов.
-
d-подуровень включает 2 * 2 + 1 = 5 орбиталей и 5 * 2 = 10 электронов.
-
f-подуровень включает 2 * 3 + 1 = 7 орбиталей и 7 * 2 = 14 электронов.
III.
Заполнение орбиталей электронами осуществляется по правилу Клечковского (в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n).
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Здесь действует принцип минимума энергии, при котором электроны заполняют орбитали начиная с подуровня с наименьшей энергией.
IV.
Максимальное количество электронов на энергетическом уровне определяется по формуле N = 2n².
Эта формула вытекает из принципа из принципа Паули.
Исходя из формулы на первом уровне может быть максимум 2 электрона (s2), на втором уровне – максимум 8 электронов (2s2 2p6), на третьем уровне – максимум 18 электронов (3s2 3p6 3d10).
V.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда.
Согласно этому правилу каждая орбиталь подуровня заполняется сначала одним электроном, а после исчерпания свободных орбиталей к имеющемуся электрону на орбитали добавляется парный электрон.
**
При составлении электронных формул элементов также понадобится периодическая система Д.И. Менделеева.
С её помощью можно определить:
-
Количество электронов в атоме – оно равно порядковому номеру элемента в периодической таблице.
-
Число энергетических уровней – оно равно номеру периода данного элемента.
-
Число электронов на последнем уровне – оно равно номеру группы.
**
Пример.
Сера (S).
Это 16 элемент по счёту: количество электронов в атоме будет равно 16.
Находится в 3 периоде: всего будет 3 уровня.
Сначала заполняем 1 уровень: 1s2, на нём будет только 2 электрона.
Далее заполняем 2 уровень: 2s2 2p6, на нём будет 8 электронов.
Оставшиеся 6 электронов будет на 3 уровне (а это как раз номер группы): 3s2 3p4.
В результате получаем следующее:
1s2 2s2 2p6 3s2 3p4.
Впервые идея заменить бумажные паспорта на электронные была озвучена еще в 2013 году. Однако последовавшие затем санкции и другие проблемы заставили правительство временно заморозить проект. И новый импульс идея цифровизации документов получила только в феврале 2023 года. О том, будет ли введен электронный паспорт в РФ в 2023 году, как его оформить и что будет с бумажными оригиналами, читайте в нашем материале.
Содержание статьи
- 1 Что такое электронный паспорт РФ
- 2 История развития проекта
- 3 Зачем вводится цифровой паспорт
- 4 Как будет работать электронный паспорт гражданина РФ
- 4.1 Как выглядит электронный паспорт
- 4.2 Какую информацию будет содержать
- 4.3 Заменит ли цифровой паспорт бумажный вариант
- 4.4 Где будет храниться электронный паспорт
- 4.5 Где можно будет его предъявить
- 4.6 Куда будет проставляться прописка
- 5 Когда введут цифровой паспорт в РФ
- 6 Как получить электронный паспорт гражданина РФ
- 7 Нужно ли будет менять бумажный паспорт на цифровой
- 8 В каких еще странах действуют электронные удостоверения личности
- 9 Аналоги в регионах России
- 10 Плюсы и минусы введения электронного паспорта в РФ
Что такое электронный паспорт РФ
Цифровой, он же электронный паспорт — это пластиковая карта, оснащенная бесконтактным чипом, на котором хранится основная информация о человеке. Электронный паспорт гражданина РФ, как следует из проекта, должен содержать в себе персональные данные его владельца, ИНН, СНИЛС, водительское удостоверение, биометрические данные и даже электронную подпись.
При необходимости его можно будет использовать и без доступа к данным с чипа – основная информация о человеке и его фото будут размещаться на лицевой стороне.
На оборотной стороне карты будет размещен QR-код, который смогут при необходимости отсканировать представители правоохранительных органов или чиновники. Дополнительно для более точной идентификации личности предусмотрен голографический портрет владельца.
История развития проекта
Концепция перехода на электронное удостоверение личности в России существует уже 10 лет – она была прописана еще в распоряжении правительства РФ № 1699-р от 19 сентября 2013 года. С тех пор несколько лет выпускались Универсальные электронные карты (УЭК), которые должны были объединять в себе электронный кошелек и паспорт. Но массовыми они не стали из-за ряда недостатков.
Затем к идее вернулись в июле 2019 года. О скором запуске пилотного проекта заявлял заместитель председателя правительства Максим Акимов. Как предполагалось, первыми цифровые паспорта должны были начать выдавать жителям Москвы, а уже дальше в процесс цифровизации включались новые регионы. Более того, по первоначальной задумке выпуск бумажных паспортов хотели прекратить уже в 2022 году (чего, очевидно, не произошло).
Потом сроки опять сдвинулись – массовая выдача цифровых паспортов должна была только стартовать в 2022 году. В Минцифры подготовили проект указа президента РФ, по которому должны были вводиться электронные паспорта в России, он был опубликован 19 марта 2021 года.
Однако и потом всё шло не очень гладко, а сроки ввода цифровых паспортов постоянно смещались. В начале 2022 года было объявлено, что цифровые паспорта будут выдавать с начала 2023 года в пилотном режиме в трех регионах – Москве, Московской области и Татарстане. Уже тогда появилась идея дополнить пластиковую смарт-карту приложением для смартфона.
Но после февраля 2022 года и всех введенных против России санкций было решено заморозить проект на неопределенный срок. Тогда называлось две причины:
- Высокая стоимость. Электронное удостоверение личности могло стоить для граждан примерно 1000 рублей, тогда как бумажный вариант обходится всего в 300.
- Отсутствие чипов. Из-за ограничений на ввоз чипов в Россию невозможно получить достаточно комплектующих для выпуска документа для всех, кому нужен паспорт.
Новый этап в истории создания и внедрения электронных паспортов начался в феврале 2023 года, когда на встрече президента РФ и главы Минцифры Максута Шадаева глава государства указал на то, что внедрение технологии нужно ускорить. Проект указа президента о разработке цифровых паспортов был опубликован на портале проектов НПА уже 13 апреля 2023 года.
Зачем вводится цифровой паспорт
Главное, для чего вводится электронный документ, — это повышение безопасности личных данных граждан. Дело в том, что изготовить подделку такого документа намного сложнее, чем для бумажного аналога. Кроме того, цифровой паспорт гражданина РФ позволить сократить бумажную волокиту и сделает документооборот в госучреждениях более быстрым и удобным.
О том, зачем нужно внедрять электронное удостоверение личности, еще в 2019 году говорил Дмитрий Медведев (на тот момент премьер-министр):
Электронный документ по задумке правительства должен помочь:
- сократить срок межведомственных согласований;
- упростить получение гражданами России государственных услуг;
- свести к минимуму вероятность ошибок при обработке документов.
Другими словами, россиянам больше не придется заполнять многочисленные анкеты, а сотрудникам госорганов – перепечатывать информацию из них. И благодаря этому риск допустить ошибку будет сведен к минимуму. А потому и весь процесс обслуживания в госучреждениях станет гораздо быстрее.
Как будет работать электронный паспорт гражданина РФ
Россияне уже привыкли к электронной коммуникации с государственными органами. Например, при оформлении детских пособий уже не нужно собирать справки — чиновники получают необходимую информацию по системе межведомственного взаимодействия. Принцип работы электронных паспортов будет аналогичным — при сканировании данных будет предоставлен доступ к записи о конкретном человеке из базы данных.
Как выглядит электронный паспорт
Пока нет точного представления о том, как будут выглядеть цифровые паспорта в России. Изначально планировалось, что это будет пластиковая карта с изображением гражданина, на которой будет напечатаны его ФИО, дата и место рождения, личная подпись, а также дата оформления паспорта и срок окончания его действия. Также карта будет оснащена бесконтактным чипом.
К примеру, в АиФ нарисовали примерно такой формат удостоверения на основе открытой информации:
Но окончательный вид документа будет ясен не раньше, чем будет подписан указ о его запуске, а также остальные подзаконные акты (в которых прописывается и регламент выдачи документа, и его внешний вид).
Кроме того, согласно проекту Минцифры, россияне смогут предъявлять электронные документы в приложении Госуслуги. Чтобы это сделать, необходимо будет загрузить в него фотографию с биометрического паспорта (сейчас это – только загранпаспорт нового поколения). В приложении будет вся та же информация – данные о человеке, его фото и QR-код со ссылкой на основные сведения из базы данных.
Другими словами, возможны два варианта цифрового паспорта:
- пластиковая карта с чипом (ПЭН – паспорт с электронным носителем) – по юридической силе будет полностью приравниваться к бумажному паспорту;
- паспорт в приложении на смартфоне (МИГ – мобильный идентификатор гражданина) – его можно будет использовать в отдельных случаях.
Соответствующий раздел в Госуслугах уже заработал в тестовом режиме. Для его использования нужен смартфон с NFC-модулем и биометрический паспорт. Кстати, примерно так же работает сервис «Госключ» – через NFC он получает данные с загранпаспорта и формирует ЭЦП.
Чтобы включить эту функцию, нужно:
- в приложении «Госуслуги» зайти в раздел с документами;
- там — внизу страницы нажать «Добавить» фото;
- затем — ввести данные загранпаспорта — его серию, номер и срок действия;
- потом — приложить смартфон к загранпаспорту (к странице с чипом);
- после проверки системой фотография загрузится на Госуслуги.
В будущем в Минцифры обещают, что можно будет ограничиться селфи с камеры телефона, а не сканировать загранпаспорт.
Чтобы предъявить паспорт, нужно зайти во вкладку «Паспорт РФ» или «Загранпаспорт».
Какую информацию будет содержать
Все данные о человеке будут храниться на чипе, но некоторую информацию пропечатают и на самом пластиковом носителе:
- ФИО;
- дата рождения;
- место рождения;
- номер водительского удостоверения (если оно есть у человека);
- личная подпись.
На обратной стороне электронного удостоверения личности будет размещена голографическая фотография и двумерный код.
При считывании информации с QR-кода будет предоставлен доступ к информации о регистрации по месту жительства или пребывания, биометрии, ИНН, СНИЛС, ЭП (оформлять электронную подпись нужно будет отдельно).
Кроме того, вся эта информация будет доступна еще и при считывании данных с бесконтактного чипа (по аналогии с оплатой картой по терминалу).
Заменит ли цифровой паспорт бумажный вариант
Когда проект только разрабатывался, с 2022 года хотели уже прекращать выдачу бумажных паспортов. В целом, идея выглядела здраво – во многих странах мира бумажные документы давно заменили на пластиковую ID-карту. И даже если у человека нет смартфона, он все равно получит «физический» документ на руки.
Но потом всё откладывалось несколько раз. И на сегодняшний день дата, когда перестанут выдавать бумажные паспорта, еще не определена (впрочем, как не начат даже пилотный проект).
Как полагают эксперты, сразу перейти на электронные паспорта не получится. На первых этапах внедрения цифровой паспорт в РФ будет иметь ту же силу, что и бумажный оригинал. И лишь со временем бумажные будут выходить из оборота по мере того, как будет заканчиваться их срок действия.
Где будет храниться электронный паспорт
Вся основная информация о человеке будет храниться в базах, а доступ к данным о себе гражданин сможет предоставлять через Госуслуги. Храниться данные будут:
- в паспорте в виде пластиковой карты – в бесконтактном чипе и в базе по ссылке с QR-кода;
- в паспорте в приложении «Госуслуги» – фото добавляется с биометрического паспорта, а основные данные анкеты есть в системе, также там будет QR-код.
Правда, пока неясно, на какие данные будет ссылаться QR-код. По словам главы Минцифры, при его сканировании в приложении можно будет проверить личные данные – ФИО и возраст.
Где можно будет его предъявить
Электронный паспорт в виде пластиковой карты будет иметь абсолютно ту же силу, что и бумажный. Соответственно, им можно будет пользоваться во всех сферах жизни – обращаться в банки, в поликлиники, оформлять сделки и путешествовать по стране.
Что касается мобильного приложения, то перечень сфер, где его будет достаточно для предъявления, определит позже Правительство своим постановлением. По предположениям Минцифры, использовать такое электронное удостоверение личности можно будет при покупках в магазине, например, если приобретается алкоголь или сигареты, при посадке на поезд, а также при обращении в МФЦ.
Куда будет проставляться прописка
По закону любой гражданин РФ обязан иметь регистрацию по месту жительства (так называемая прописка) или по месту пребывания. Сейчас эти данные обычно проставляются в виде штампа в паспорт, но еще в 2021 году в МВД решили перевести регистрацию на электронные системы.
И на сегодняшний день уже есть возможность оформить регистрацию по месту жительства в электронном виде. Вся процедура оформления, а также сам документ (электронное свидетельство о регистрации) уже доступны на портале Госуслуги. Конечно, есть ограничения (собственник жилья должен дать согласие на это в электронном виде), но сервис работает уже по всей России.
Соответственно, в электронном паспорте и регистрация по месту проживания тоже будет только электронная. Тем более, что такой сервис уже существует, а цифровые паспорта только тестируются.
Когда введут цифровой паспорт в РФ
Точных сроков введения цифровых паспортов на территории Российской Федерации нет. Проект указа находится только на стадии обсуждения до 27 апреля 2023 года. Если он в итоге будет подписан президентом, то после этого в течение 90 дней правительство должно будет утвердить порядок его применения и прочие юридические тонкости.
Скорее всего, какое-то время цифровые паспорта в России в 2023 году сначала будут выдавать в тестовом режиме, в том числе на Госуслугах.
Как получить электронный паспорт гражданина РФ
Нет на сегодняшний день и точных разъяснений, как будет проходить оформление электронного паспорта. По данным, которые были опубликованы на сайте Минцифры РФ еще в 2021 году, чтобы оформить электронное удостоверение, гражданин России должен будет сдать биометрические данные (отпечатки пальцев, изображение лица) в уполномоченных органах МВД. Также потребуется доступ к порталу «Госуслуги».
Окончательный порядок оформления цифровых паспортов будет опубликован после того, как Правительство разработает необходимые нормативно-правовые акты. Мы обновим эту статью по мере появления новой информации, добавьте ее в закладки, чтобы не потерять.
Нужно ли будет менять бумажный паспорт на цифровой
В России планируется поэтапное внедрение электронных паспортов. Предполагается, что от бумажных паспортов можно будет уйти к 2030 году, но это пока ориентировочные сроки.
Можно предположить, что переход будет постепенным:
- если у человека есть бумажный паспорт, он сможет им пользоваться без ограничений;
- оформив вместо бумажного документа электронный, «бумага» теряет законную силу (у человека не может быть два паспорта, а электронный имеет ту же силу, что и обычный);
- цифровой паспорт в мобильном приложении будет лишь дополнительным документом к пластиковой смарт-карте.
В любом случае, в обозримом будущем никто не будет аннулировать бумажные паспорта россиян – просто потому, что моментально выдать более 100 миллионов пластиковых документов невозможно чисто физически. Поэтому можно спрогнозировать длительный переходный период, когда будут доступны два варианта документа.
Важно: ВЦИОМ в 2020 году проводил опрос населения, хотели бы жители России получить электронный паспорт или нет. Против этой инициативы выступает 73%. Только 16% граждан, большая часть из которых – молодежь, выступает за введение цифрового паспорта.
В каких еще странах действуют электронные удостоверения личности
Опыт использования электронных паспортов на сегодняшний день достаточно большой. Но ближайшим аналогом можно назвать эстонскую ID-карту, которая выдается гражданам Эстонии с 2002 года. По своему виду она напоминает пластиковую карту, которая также имеет чип. Выдается пластиковая карта всем гражданам, чей возраст достигает 15 лет.
В ноябре 2022 года цифровой паспорт стал доступен гражданам Казахстана. Им можно пользоваться, скачав на мобильный телефон программу eGov Mobile. Паспорт по юридической силе приравнивается к бумажному аналогу. Действует только на территории Казахстана.
Похожие системы также представлены в США, Германии, Израиле и Китае.
Аналоги в регионах России
В России был опыт внедрения универсальных электронных карт в 2013 году, однако уже в 2017-м этот эксперимент свернули. Одной из причин стала разработка национальной платежной системы «МИР», на базе которой сегодня работают карты жителей отдельных регионов:
- Один из самых ярких примеров — карта жителя Самарской области. Это банковская карта «МИР», но ее можно использовать как аналог медицинского полиса, платить ей за проезд и получать некоторые другие услуги.
- Еще один пример — Карта москвича, которая позволяет облегчить процесс получения социальных пособий, пенсий, стипендий. Кроме того, с помощью этой электронной карты можно оплачивать услуги, обращаться за помощью в поликлиники (аналог полиса ОМС).
Плюсы и минусы введения электронного паспорта в РФ
Главное достоинство оцифрованного паспорта состоит в том, что один документ объединяет в себе почти всё, что нужно человеку. Благодаря этому действительно упрощается процесс получения государственных услуг. Второе преимущество электронного удостоверения личности — безопасность. Подделать такой паспорт сложно, так как он содержит в себе биометрические данные.
Среди минусов, как бы это странно ни звучало, также можно назвать безопасность. Многие граждане убеждены, что с цифровизацией личных данных риски утечки информации станут еще более высокими. Еще одним минусом электронного документа многие мнительные люди считают «тотальную» слежку за гражданами со стороны государства.




