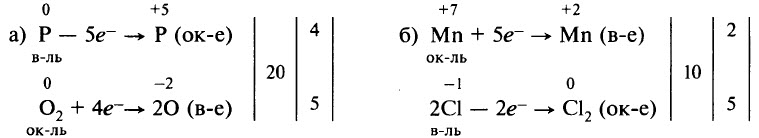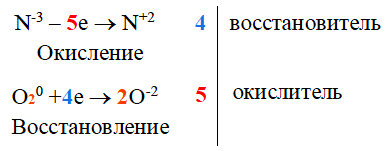МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Ключевые слова конспекта: окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление, расстановка коэффициентов.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Темы, связанные с настоящим конспектом:
- Степень окисления химических элементов
- Окислительно-восстановительные реакции
- Окислители и восстановители
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
- Запишем схемы реакций, вычислим степени окисления элементов и определим элементы, у которых они меняются:
- Составим схемы, отражающие процессы перехода электронов:
- Определим, какой процесс является окислением, а какой – восстановлением; какой элемент является окислителем, а какой – восстановителем:
- Уравняем число отданных и принятых электронов. Для этого найдём наименьшее общее кратное для числа отданных и числа принятых электронов. В результате деления наименьшего общего кратного на число отданных и принятых электронов находим коэффициенты:
- Перенесём коэффициенты в исходную схему (п. 1), преобразуя её в уравнение реакции:
Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl– участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).
Алгоритм расстановки коэффициентов на примерах
Пример 1. Cu + HNO3 → Cu(NO3)2 + NO + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс
Число принятых и отданных электронов переносим крест –накрест и сокращаем. Это множители, которые позволяют осуществить закон сохранения: число принятых электронов должно быть равно числу отданных электронов.
Теперь эти множители нужно внести в схему реакции, они должны стать коэффициентами. Перед атомами меди в левой и правой части уравнения нужно поставить коэффициент 3. В этом действии можно не сомневаться, так как медь в левой и правой части встречается только по одному разу.
3Cu + HNO3 → 3Cu(NO3)2 + NO + H2O
А вот с азотом возникает вопрос: к какому из атомов азота относится коэффициент 2? Ответ: к тому, степень окисления которого в уравнении встречается единожды, то есть +2. Ставим коэффициент 2 перед NO.
3Cu + HNO3 → 3Cu(NO3)2 + 2NO + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: в правой части после выставления коэффициентов из баланса перед всеми атомами азота есть коэффициенты, пересчитаем азот в правой части – 8, ставим этот коэффициент перед азотной кислотой.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
Теперь в левой части поставлен коэффициент перед водородом, число его атомов 8. Ставим в правую часть перед водой 4.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 24 = 24.
Если равно – коэффициенты расставлены правильно, если нет – ищем ошибку.
Пример 2. KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс
Перед атомами марганца в левой и правой части уравнения нужно поставить коэффициент 2. В этом действии можно не сомневаться, так как марганец в левой и правой части встречается только по одному разу.
2KMnO4 + K2SO3 + H2SO4 → 2MnSO4 + K2SO4 + H2O
С серой возникает вопрос: к какому из атомов серы относится коэффициент 5? К тому, степень окисления которого в уравнении встречается единожды, то есть +4. Ставим коэффициент 5 перед K2SO3.
2KMnO4 + 5K2SO3 + H2SO4 → 2MnSO4 + K2SO4 + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: калий (в левой части 10+2=12, перед K2SO4 поставим 6.
2KMnO4 + 5K2SO3 + H2SO4 → 2MnSO4 + 6K2SO4 + H2O
Теперь в правой части поставлены коэффициенты перед серой, число её атомов 8. В левой части уже есть коэффициент перед серой 5, не хватает еще 3.
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + H2O
Сравниваем число атомов водорода. Ставим перед водой 3.
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + 3H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 35 = 35.
Случаи, когда индекс при химическом элементе
вносится в электронный баланс.
Случай 1. Если формула простого вещества записывается с индексом: NH3 + O2 → NO + H2O
5 ставим перед простым веществом – кислородом,
4 – перед азотом в левой и правой части уравнения,
уравниваем водород, проверяем кислород.
4NH3 + 5O2 = 4NO + 6H2O
Случай 2. Если в молекуле атомы одного элемента соединены между собой (то есть присутствует ковалентная неполярная связь): пероксиды, дисульфиды, тиосульфат, веселящий газ, органические вещества: Cr(OH)3 + H2O2 + KOH –> K2CrO4 + H2O
3 ставим перед пероксидом водорода,
2 – перед хромом в левой и правой части уравнения,
уравниваем калий, потом – водород, проверяем кислород.
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Случай 3. Если у одного элемента в левой и правой части уравнения есть одинаковый индекс: K2Cr2O7 + K2SO3 + H2SO4 –> Cr2(SO4)3 + K2SO4 + H2O
Перед сульфитом ставим 3, перед хромом в левой и правой части коэффициент не нужен, уравниваем калий (в правой части перед сульфатом калия ставим 4), затем – серу (в левой части перед серной кислотой – 4), водород – перед водой 4, проверяем кислород.
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O
Вы смотрели конспект урока по химии «Метод электронного баланса».
Следующая тема: «Окислители и восстановители».
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
…
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Определить окислитель и восстановитель
Найдем степень окисления элементов:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 | 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
|
При разложении нитрата аммония NH4NO3 образуется не азот N2, а оксид азота(I) N2O |
NH4Cl (aq) + NaNO2 (aq) → N2 (g) + NaCl (aq) + 2 H2O (l)
Это окислительно-восстановительная (редокс) реакция:
N-III – 3 e– → N0 (окисление)
NIII + 3 e– → N0 (восстановле́ние)
NH4Cl является восстановителем, NaNO2 является окислителем (конпропорционирования).
Это реакция газовыделения, N2 является образованным газом.
Реактанты:
- NH4Cl
- Названия: Хлорид аммония
, NH4Cl
, Е510
- Внешность (состояние): Не имеющее запаха от бесцветного до белого цвета гигроскопичное твердое вещество в различных формах
- Названия: Хлорид аммония
- NaNO2
- Названия: Нитрит натрия
, Е 250
, Е250
- Внешность (состояние): Гигроскопичное от белого до жёлтого цвета твердое вещество в различных формах
- Названия: Нитрит натрия
Продукты:
- N2
- Названия: Молекулярный азот
, Азот (газ под авлением)
, Азот (жидкий)
- Внешность (состояние): Не имеющий запаха бесцветный сжатый газ
; Не имеющая запаха бесцветная особая холодная жидкость
- Названия: Молекулярный азот
- NaCl – Хлорид натрия
- Другие названия: Соль
, Поваренная соль
, Столовая соль
- Другие названия: Соль
- H2O