…
Мы уже знаем, что в атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
- При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
- Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее) средней энергии взятых АО.
- МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
- АО, которые обладают сопоставимой энергией, комбинируются наиболее эффективно.
- Эффективность, с которой комбинируют две атомные орбитали, пропорциональна их перекрыванию друг с другом.
- При образовании МО при перекрывании двух неэквивалентных АО связывающая МО содержит больший вклад АО с наиболее низкой энергией, а разрыхляющая орбиталь – вклад АО с более высокой энергией.
Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
Теперь на примерах рассмотрим как строить молекулярные орбитали с применением этих правил.
Молекулярно-орбитальные диаграммы элементов первого периода
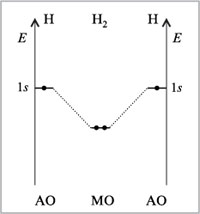
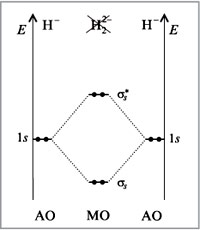
Диаграмма МО молекулы Н2
Пример образования молекулы водорода из двух атомов водорода.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали.
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Электроны, в соответствии с принципом Паули, занимают сначала орбиталь с самой низкой энергией σ-орбиталь.
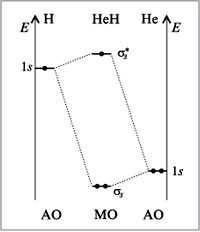
Диаграмма МО молекулы Не2
Теперь рассмотрим пример образования молекулы гелия He2, при сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую.
σ *— орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*— орбиталь, дестабилизируют молекулу He2. Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Как узнать несколько велика прочность молекулы? Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная. Как видно из диаграммы разница в заполненности орбиталей молекулы водорода больше, чем молекулы гелия, поэтому молекула водорода намного более прочная, чем молекула гелия.
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями.
Т.к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют σ- и π-молекулярные орбитали. Пользуясь обобщенной диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода, которые приведены в таблице.
Так, образование молекулы, например, фтора F2 из атомов в системе обозначений теории молекулярных орбиталей может быть записано следующим образом:
2F [1s22s22p5] =F2[(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2pz)2(π*2py)2(π*2pz)2].
Т.к. перекрывание 1s-облаков незначительно, то участием электронов на этих орбиталях можно пренебречь. Тогда электронная конфигурация молекулы фтора будет такой:
F2[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)2(π*z)2],
где К — электронная конфигурация К-слоя.
В таблице приведены молекулярные орбитали двухатомных молекул элементов второго периода бора (B2), углерода (C2), азота (N2), кислорода (O2), фтора (F2)
Рассмотрим подробнее пример образования молекулы лития Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия.
Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны.
Это действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.
В итоге, для щелочных металлов, молекулярно-орбитальная диаграмма будет иметь вид подобный рассмотренной нами диаграмме молекулы Li2.
Порядок связи n в молекуле Li2 равен 1
Молекулярные орбитали полярных двухатомных молекул
Учение о МО позволяет объяснить и образование двухатомных гетероядерных молекул. Если атомы в молекуле не слишком отличаются друг от друга (например, NO, CO, CN), то можно воспользоваться диаграммой, приведенной выше для элементов 2 периода.
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется.
Чем больше электроотрицательность атома, тем более низко на диаграмме обозначают атомные орбитали.
Диаграмма МО молекулы HF
Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p — орбитали. Взаимодействие 1s-орбитали атома водорода и 2p — орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Для связывающей орбитали молекулы HF 2p — орбиталь атома фтора играет более важную роль, чем 1s — орбиталь атома водорода.
Для разрыхляющей орбитали молекулы HF наоборот: 1s — орбиталь атома водорода играет более важную роль, чем 2p — орбиталь атома фтора
Т.к. электроотрицательность фтора больше, чем электроотрицательность водорода, то на диаграмме, атомные орбитали фтора расположени ниже, чем атомная орбиталь водорода.
Определим порядок связи, т.е. кратность связи:
Т.о. в молекуле H-F связь одинарная.
Диаграмма МО молекулы СО
Электронная конфигурация внешнего слоя атомов углерода и кислорода:
С+6 1s2 2s2 2p2
O+8 1s2 2s2 2p4
Кислород более электроотрицательный элемент, поэтому его атомная орбиталь на диаграмме расположена ниже орбитали углерода.
Диаграмма МО молекулы СО имеет вид:
СO[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)]
Кратность связи равна:
n=(8-2)/2 = 3
Диаграмма молекулы NO приведена в разделе Задачи к разделу Химическая связь и строение молекул
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положения метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).

Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются ss. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s < σ *1s < σ 2s <σ *2s < σ 2pz < π 2рх = π 2ру < π *2рх = π *2ру < σ *2pz.
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
σ 1s < σ *1s < σ 2s <σ *2s < π 2px = π 2ру < σ 2pz <π *2рх = π *2ру < σ *2pz.
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
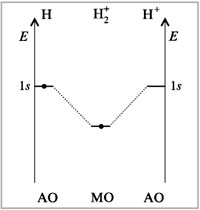
Процесс образования частицы H2+ можно представить следующим образом:
Н[1s] + Н+ → H2+[σ 1s].
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2+ равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s)2]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
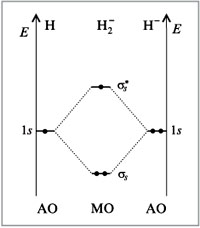
Молекулярный ион H2— имеет электронную конфигурацию:
H2— [(σ 1s)2(σ *1s)1]
Кратность связи в H2— составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s)2]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s2) Ве2 [KK*(σ 2s)2 (σ *2s)2]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s)2 (π *2s)2 (π2px)2 (π2py)2 (σ 2pz)2]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
O2 [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)1]

Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2+ и O2— . В ионе O2+ на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1]
или
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2py)1]
Кратность связи в ионе О2+ равна (8–3):2 = 2,5. В ионе O2— на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)1]
или
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)2]
Кратность связи в ионе О2— равна (8 – 5):2 = 1,5. Ионы О2— и О2+ являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
F2 [KK(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)2]
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2— , О2, О2+ кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO+, CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ2pz)2]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2px)1] или
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2py)1]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO— :
NO— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 (π*2px)1(π*2py)1]
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO+ имеет следующее электронное строение:
NO+ [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO+ равна трём.
В ряду NO— , NO, NO+ избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF+; NF —; NF.
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO—; CO; CO+.
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2+; Be2; Be2+.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
6. Используя метод МО, определите кратность связи в молекуле С2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
7. На основе метода МО объясните, почему не существует молекулы Ne2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
9. Распределите электроны на молекулярных орбиталях для иона CN—. Определите кратность связи в этом ионе.
|
CN— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]. |
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN+, CN, CN—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: CN+ [KK*(σ2s)2 (σ*2s2 (π2px)2 (π2py)2 ]; CN [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)1]; CN— [KK*(σ2s) 2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 ]. Избыток связывающих электронов в CN+, CN, CN— соответственно составляет 4, 5, 6. |
Метод молекулярных орбиталей
Теория
молекулярных орбиталей (МО) дает
представление о распределении электронной
плотности и объясняет свойства молекул.
В этой теории квантовомеханические
зависимости дляатомараспространены на более сложную систему
— молекулу. Молекула рассматривается
как целое, а не как совокупность
сохранивших индивидуальность атомов.
В молекуле (как и в атоме) имеются
дискретные энергетические состояния
отдельныхэлектронов(молекулярные орбитали) с их самосогласованным
движением в поле друг друга и всех ядер
молекулы.
Предполагается,
что все электроны данной молекулы (как
и в атоме) распределяются по соответствующим
орбиталям.
Состояние электрона в атоме описывается
одноэлектроннойволновой
функциейψ, являющейся решениемуравнения
Шрёдингера. Волновая функция ψ,
зависящая от четырёх квантовых чисел,
имеющая конкретный математический вид
и удовлетворяющая условию нормировки
и однозначности называется молекулярной
орбиталью (МО) (по аналогии с атомной).
Каждая орбиталь характеризуется своим
наборомквантовых
чисел, отражающих свойства электронов
в данном энергетическом состоянии. В
отличие от одноцентровых орбиталей
атомов, орбитали молекул многоцентровые,
то есть молекулы имеют общие орбитали
для двух или более атомных ядер. Каждая
молекулярная орбиталь обладает
определённой энергией, приближённо
характеризующейся соответствующим
потенциалом ионизации.
По
аналогии с атомными s-, p-, d-, f- орбиталями
молекулярные орбитали обозначают
греческими буквами σ-, π-, δ-, -.
МО образуются при комбинировании атомных
орбиталей при достаточном сближении.
Совокупность МО молекулы с указанием
её типа и количеством электронов на ней
даёт электронную конфигурацию молекулы.
Существуют 3 типа молекулярных орбиталей:
связывающие,
разрыхляющие и несвязывающие.
Заполнение молекулярных орбиталей
происходит так же, как и атомных, с
соблюдением принципа Паули, принципа
наименьшей энергии и правила Хунда; на
каждой МО может находиться не более
двух электронов.Электроны
на связывающих молекулярных орбиталях
упрочняют связь, на разрыхляющих как
бы дестабилизируют (расшатывают).
Молекула является устойчивой лишь в
том случае, если число электронов на
связывающих орбиталях превышает число
электронов на разрыхляющих. Электроны,
находящиеся на несвязывающих молекулярных
орбиталях, участие в образовании
химической связи не принимают. Из
исходных атомных орбиталей возникает
n МО. Так, при образовании двухатомной
молекулы H2
из атомов Н из s-орбиталей двух атомов
Н возникают две двухцентровые МО — одна
энергетически более выгодная (связывающая
σsсв),
другая менее выгодная (разрыхляющая
σsразр),
чем исходные атомные орбитали. На
связывающей МО электрон большую часть
времени пребывает между ядрами (повышается
электронная плотность), способствуя их
химическому связыванию. Нa разрыхляющей
же МО электрон большую часть времени
находится за ядрами, вызывая отталкивание
ядер друг от друга.
Основные
положения метода:
1. Число
образующихся МО должно быть равно числу
исходных АО.
2. АО,
образующие МО, должны иметь близкие или
одинаковые значения энергий.
3. Взаимодействующие
АО должны иметь одинаковую симметрию
относительно линии связи в молекуле.
4. АО
должны в достаточной степени перекрываться
при образовании МО. Поэтому орбитали
внутренних слоев атомов практически
не участвуют в образовании связи и в
методе МО обычно не рассматриваются.
В
методе МО образование молекулярных
орбиталей рассматривается как результат
сложения и вычитания комбинируемых АО.
Молекулярная орбиталь, возникающая в
результате сложения АО, отвечает более
низкому значению энергий, чем исходные
АО. Такая МО имеет повышенную электронную
плотность в пространстве между ядрами
и способствует образованию химической
связи, она называется связывающей
(св.).
Молекулярная
орбиталь, возникающая в результате
вычитания АО, отвечает более высокому
значению энергий, чем исходные АО.
Электронная плотность в этом случае
сконцентрирована за ядрами атомов, а
между ними равна нулю. Подобные МО
энергетически менее устойчивы, они
приводят к ослаблению химической связи
и называются разрыхляющими
(разр. или
*).
Образование
молекулярных орбиталей из атомных
орбиталей изображают схематически в
виде энергетических диаграмм, на которых
молекулярные и атомные орбитали
обозначаются либо в виде клеточек ,
либо в виде кружочков О, а электроны на
них – стрелками, направленными вверх
(↑) или вниз (↓). Орбитали на диаграммах
размещают в соответствии с их энергией.
Рассмотрим
построение такой энергетической
диаграммы на примере молекулы водорода
Н2
:

НА(1s1)
+ НВ(1s1)
→ H2(1s)2
Электроны,
занимающие связывающие и разрыхляющие
МО, называются соответственно связывающими
и разрыхляющими. Устойчивая молекула
образуется в случае, если сумма электронов,
расположенных на связывающих МО,
превышает сумму электронов на разрыхляющих
МО.
Кратность
(порядок) связи
равна половине разности числа электронов
на связывающих Nсв
и разрыхляющих
Nразр
МО:
К.
с. =
 .
.
Чем
выше кратность связи, тем прочнее
молекула.
Рассмотрим
использование метода МО на примере
двухатомных гомоядерных молекул
элементов II
периода периодической системы. Согласно
спектроскопическим данным, молекулярные
орбитали двухатомных гомоядерных
молекул элементов II
периода по энергии располагаются
следующим образом:
а)
для молекул Li2,
Be2,
B2,
C2,
N2
этот порядок 

 =
=
=



= 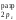

представлен энергетической диаграммой:
АО МО АО




б)
для молекул О2,
F2,
Ne2
этот порядок 



= = 
 =
= 

представлен энергетической диаграммой,
изображенной на рис.:
АО МО АО




К.
Записав
электронную конфигурацию молекулы,
можно сделать вывод о прочности и длине
связи в молекуле, а также определить ее
магнитные свойства.

Метод
МО позволяет характеризовать не только
молекулы, но и молекулярные
ионы. Рассмотрим строение О2 и
 .
.
Изобразим
заполненную электронами энергетическую
диаграмму каждой из этих частиц. в
соответствии с принципом наименьшей
энергии, принципом Паули и правилом
Хунда:

МО
(О2)
КК( )2(
)2( )2(
)2( )2
)2
( )2(
)2(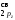 )2(
)2( )1(
)1( )1,
)1,
где
К – электронная конфигурация К-слоя
атомов кислорода, которые практически
не участвуют в образовании связи.
Порядок
связи (О2)
=
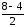 = 2.
= 2.
МО
 КК(
КК( )2(
)2( )2(
)2( )2
)2
( )2(
)2(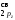 )2(
)2( )1
)1
Порядок
связи
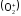 =
= = 2,5.
= 2,5.
Так
как порядок связи иона
 выше, чем молекулы О2,
выше, чем молекулы О2,
то ион
 более устойчив, чем молекула О2,
более устойчив, чем молекула О2,
длина связи в ионе
 меньше,
меньше,
чем в молекуле О2.
Наличие неспаренных электронов в МО О2
и ионе
 определяет ихпарамагнитные
определяет ихпарамагнитные
свойства.
В случае отсутствия неспаренных
электронов в МО проявляются диамагнитные
свойства
молекул.
Гетероядерные
двухатомные молекулы метод МО описывает
так же, как и гомоядерные двухатомные
молекулы. В этом случае энергии атомных
орбиталей разных атомов различаются.
В связывающую орбиталь большой вклад
вносит орбиталь более электроотрицательного
атома, а в разрыхляющую – орбиталь менее
электроотрицательного атома. Энергетические
диаграммы молекул типа АВ, где атом В
более электроотрицателен, чем атом А,
имеют следующий вид :
![]()


х

В
случае молекул, имеющих три и более
атома, энергетические диаграммы все
более усложняются. Поэтому описание
многоатомных молекул с позиций метода
МО становится менее наглядным, а
следовательно, и менее удобным.
Соседние файлы в предмете Теоретические основы химии
- #
- #
- #
- #
26.03.20151.24 Mб50Теоретические основы химии для з.о. ИД.pdf
- #
- #
КУРСЫ ПОВЫШЕНИЯ
КВАЛИФИКАЦИИ
Л.С.ГУЗЕЙ
Фундаментальные понятия
общей химии в школьном курсе
Учебный план курса
| № газеты | Учебный материал |
|---|---|
| 17 | Лекция № 1. Стехиометрия |
| 18 | Лекция № 2. Элементы химической кинетики |
| 19 | Лекция № 3. Элементы химической термодинамики. Kонтрольная работа № 1. Стехиометрия. Закономерности протекания химических реакций(срок выполнения – до 15 ноября 2005 г.) |
| 20 | Лекция № 4. Химическое равновесие в растворах электролитов |
| 21 | Лекция № 5. Окислительно-восстановительные процессы.Kонтрольная работа № 2. Равновесия в растворах электролитов (срок выполнения – до 15 декабря 2005 г.) |
| 22 | Лекция № 6. Строение атома и химическая связь |
| 23 | Лекция № 7. Химическая связь и строение молекул |
| 24 | Лекция № 8. Строение вещества. Дисперсные системы |
| Итоговая работа. Разработка урока для основной или старшей профильной школы. Итоговые работы, сопровождаемые справками из учебного заведения, должны быть направлены в Педагогический университет не позднее 28 февраля 2006 г. |
ЛЕКЦИЯ № 7
Химическая связь и строение молекул
Требования образовательного стандарта, рассмотренные
в лекции:
типы химических связей: ковалентная (полярная и
неполярная), ионная;
пространственное строение молекул,
гибридизация атомных орбиталей, полярность
молекул, комплексные соединения, единая природа
химических связей;
типы кристаллических решеток (атомная,
молекулярная, ионная и металлическая),
межмолекулярные взаимодействия, водородная
связь.
Введение
Все следует сделать простым,
насколько это возможно, но не проще.
А.Эйнштейн
В предыдущей лекции мы рассмотрели
электронное строение атома и механизм
образования химической связи. Этот механизм для
всех типов химической связи един: при
перекрывании АО образуются МО и все электроны
переходят с исходных атомных на образовавшиеся
молекулярные орбитали. Тип химической связи
зависит главным образом от относительных
размеров соединяющихся атомов.
Энергия химической связи
Изменение энергии при образовании химической
связи будем рассматривать с помощью
энергетических диаграмм, аналогичных таковым
для атомов. Энергию орбитали будем отмечать
черточкой на соответствующей оси энергий. При
заполнении орбиталей электронами будем
соблюдать те же три принципа:
1) наименьшая энергия;
2) не более двух электронов на одной МО;
3) заполнение максимального числа МО, если они
имеют одинаковую энергию.
Начнем с молекулы Н2. На рис. 1 изображена
ее энергетическая диаграмма.
|
|
Рис. 1.
|
Слева и справа на вертикальных осях
энергии отмечены энергии перекрывающихся 1s-АО
двух атомов Н, а посередине — электроны на
энергетическом уровне молекулы. Энергия МО ниже,
чем исходных АО.
Разность энергий АО и МО, т.е. энергия,
выделяющаяся при переходе электронов с АО на МО,
является энергией связи.
Чтобы разорвать связь, т.е. вернуть электроны на
исходные АО, необходимо такую же энергию
затратить.
Энергия связи тем больше, а связь тем прочнее,
чем выше электронная плотность между ядрами.
Последняя, при прочих равных условиях, зависит от
размеров соединяющихся атомов. Чем атомы меньше,
тем выше электронная плотность на их АО,
следовательно, и на образующихся МО.
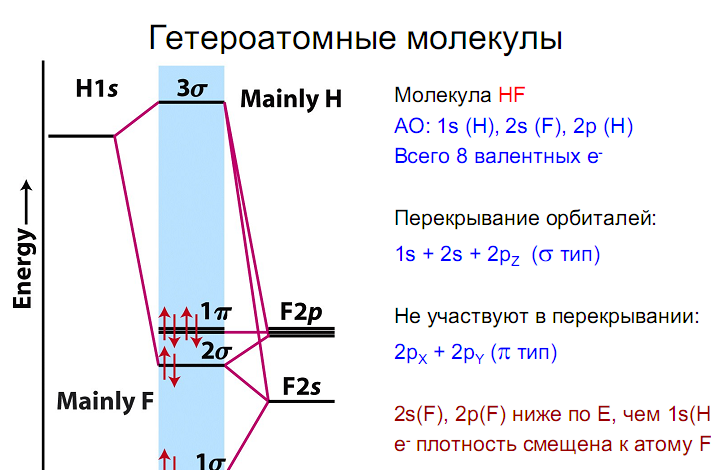
На рис. 2 вверху показано перекрывание
валентных s-АО атомов водорода, лития и
натрия, а ниже – соответствующие энергетические
диаграммы двухатомных молекул.
 |
Рис. 2
|
И пусть вас не удивляют молекулы Li2
и Na2. Молекулы металлов существуют в
газообразном состоянии, но они непрочны, т.к.
образованы сравнительно большими атомами.
Обратите внимание на значения энергии связи в
молекулах Li2 и Na2 по сравнению с
молекулой Н2 (их содержание и равновесная
концентрация в пара’х малы).
Повышенная электронная плотность между ядрами
может быть обеспечена не только двумя
электронами, как в молекуле Н2, но и одним. И
поистине простейшая молекула1
— ион Н2+.
Естественно, что электронная плотность между
ядрами, т.е. в области перекрывания, в этой
молекуле меньше, чем в Н2, следовательно,
энергия связи ниже (она составляет 256 кДж/моль)
(рис. 3).
|
|
Рис. 3.
|
Попробуем добавить электрон в молекулу
Н2, т.е. рассмотрим ион Н2–.
На имеющейся МО третьему электрону места нет. И
он занимает другую МО, на которой электронная
плотность между ядрами понижена, как показано на
рис. 4.
|
|
Рис. 4.
|
Такое распределение электронной
плотности приводит к отталкиванию «обнаженных»
ядер и повышению потенциальной энергии системы.
Эта МО называется антисвязывающей2,
ослабляющей связь, в отличие от ранее
рассмотренной связывающей МО.
Энергетическая диаграмма иона Н2–
показана на рис. 5.
|
|
Рис. 5.
|
На этой диаграмме приведены и принятые
обозначения МО. В данном случае связь – ![]() , звездочка
, звездочка
обозначает антисвязывающую МО.
Трехэлектронная связь в ионе Н2–
слабая. Здесь на связывающей МО на один электрон
больше, чем на антисвязывающей, как и в ионе Н2+.
Однако межэлектронное отталкивание (между тремя
электронами) существенно уменьшает выигрыш в
энергии. Энергия связи в молекуле-ионе Н2–
составляет всего 17 кДж/моль.
Это общее положение для соединений с
трехэлектронными связями. Но именно такие связи
образуются в соединениях благородных газов (VIIIа
группа), у которых на всех АО имеется по два
электрона. Поэтому их соединения неустойчивы.
Если в молекулу Н2– ввести
еще один электрон, т.е. рассмотреть ион Н22–,
то он займет место на антисвязывающей МО (рис. 6).
Энергия связи равна 0, и молекула не существует.
|
|
Рис. 6.
|
На рис. 7 показана энергетическая
диаграмма гетеронуклеарной (т.е. содержащей ядра
разных химических элементов) молекулы НеН. В
отличие от уже рассмотренных молекул,
образованных одинаковыми атомами (водорода), в
этой молекуле исходные АО имеют разную энергию.
|
|
Рис. 7.
|
Эта молекула существует, но очень
неустойчива из-за большой разницы в энергиях
перекрывающихся АО. Видно, что энергия
связывающей МО мало отличается от энергии АО
атома Не, и переход электронов с АО на МО дает
лишь очень малый выигрыш в энергии.
Подведем первые итоги.
1. При перекрывании атомных орбиталей
образуется два вида молекулярных орбиталей —
связывающие и антисвязывающие. При этом в
результате перекрывания каждых двух АО
образуется две МО – одна связывающая и одна
антисвязывающая. Число МО, таким образом, равно
числу исходных АО, сколько бы их ни было. Дальше
мы постоянно будем использовать это положение.
Можно сказать, что при образовании молекулы из
атомов действуют законы сохранения. Сохраняется
число атомных ядер, число электронов, число
орбиталей, описывающих состояние электронов в
исходных атомах и в образовавшейся молекуле.
2. Энергия связывающей МО ниже, а
антисвязывающей МО выше, чем энергии исходных АО.
Поэтому при переходе электронов на связывающие
МО потенциальная энергия системы понижается,
энергия выделяется, рассеивается в пространстве
(возрастание энтропии Мира). При переходе
электронов на антисвязывающую МО энергия
системы повышается.
Связывающие и антисвязывающие МО на оси
энергий располагаются приблизительно
симметрично относительно исходных АО, так что
проигрыш и выигрыш энергии при переходе
электронов с АО на соответствующие МО
приблизительно одинаков. Разность энергий
электронов на связывающих и антисвязывающих МО
есть энергия связи.
3. Связь образуется, если число электронов на
связывающих МО больше, чем на антисвязывающих.
Учитывая, что при перекрывании каждых двух АО
образуется две МО (связывающая и
антисвязывающая), энергия системы понижается
только в тех случаях, когда на образовавшиеся МО
переходят один, два или три электрона.
Если исходные АО заняты полностью, т.е. содержат
по два электрона, то связь не образуется. Поэтому
валентными АО, т.е. участвующими в образовании
связи между атомами, оказываются только орбитали
внешнего энергетического уровня, которые
частично свободны. В то же время у
d-элементов валентными могут быть и АО
предпоследнего уровня, занятые электронами не
полностью.
4. Наиболее прочная связь при перекрывании двух
АО реализуется, если на МО переходит два
электрона. Поэтому она и оказывается самой
распространенной в природе. Отсюда
предположение (оно было высказано в 1910-е гг. и
упоминается в большинстве школьных учебников до
сих пор) об образовании химической связи
электронными парами. Но причина этого лежит не в
выигрыше энергии за счет образования
электронной пары (выше говорилось об
энергетической невыгодности спаривания
электронов, об их взаимном отталкивании), а в
обеспечении максимальной электронной плотности
между ядрами соединившихся атомов с учетом того,
что на одной орбитали не может быть больше двух
электронов (вот откуда электронная пара).
Многоэлектронные молекулы
Мы описали образование молекул атомами
элементов 1-го периода периодической системы
Д.И.Менделеева. Эти атомы имели по одной АО,
соответственно в двухатомных молекулах
возникало по две МО.
Теперь рассмотрим образование молекул атомами
элементов 2-го периода. Валентными орбиталями у
любого из них являются четыре АО: одна 2s-АО и
три 2р-АО. Следовательно, в двухатомных
молекулах должно образоваться восемь МО, причем
одинаковых у всех молекул. Энергетические
диаграммы МО таких молекул одинаковы. Отличие
состоит в числе электронов на них.
Перекрывание АО и образование МО
При перекрывании двух 2s-АО образуются две
МО — связывающая ![]() s и антисвязывающая
s и антисвязывающая ![]() s* (рис. 8).
s* (рис. 8).
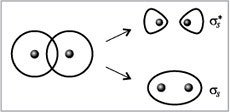 |
Рис. 8
|
На рис. 9 показано перекрывание рх-АО,
т.е. р-орбиталей, вытянутых вдоль оси х,
которой мы назовем линию, соединяющую ядра
атомов3. Образуется
связывающая ![]() x-МО
x-МО
и антисвязывающая ![]() x*-МО.
x*-МО.
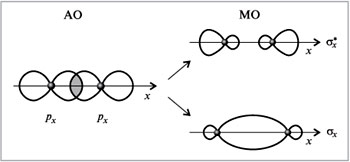 |
Рис. 9.
|
py-АО и pz-АО
перекрываются по ![]() -типу
-типу
(рис. 10), образуя по паре одинаковых по энергии, но
взаимно перпендикулярно ориентированных в
пространстве ![]() -МО.
-МО.
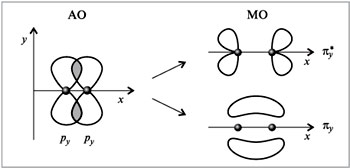 |
Рис. 10.
|
Таким образом, при перекрывании
валентных атомных орбиталей атомов элементов
2-го периода с образованием двухатомной молекулы
образуется восемь МО, из которых четыре являются
связывающими и четыре – антисвязывающими, как
показано на рис. 11.
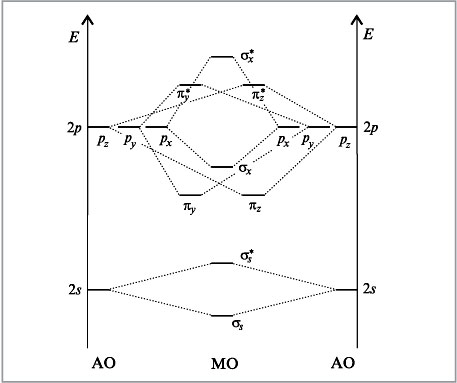 |
Рис. 11.
|
На рисунке отсутствуют 1s-АО и
образованные ими ![]() s-МО. Посмотрите на рис. 6, на
s-МО. Посмотрите на рис. 6, на
котором видно, что при перекрывании двух АО,
занятых парами электронов, число электронов на
связывающей и антисвязывающей МО одинаково.
Иными словами, они не дают вклада в энергию связи.
Поэтому на энергетических диаграммах молекул
изображаются только валентные АО (об этом уже
говорилось выше).
На рис. 11 приведена общая схема для любых (гомо-
и гетероядерных4) двухатомных
молекул, образованных атомами элементов 2-го
периода. Ее следует один раз нарисовать и
сохранить как образец, возможно, на стене
кабинета химии.
Пусть вас не смущает расположение связывающих ![]() -МО ниже, чем
-МО ниже, чем ![]() x-МО. На
x-МО. На
самом деле
![]() -связи не всегда
-связи не всегда
прочнее ![]() -связей, в
-связей, в
противоположность тому, что принято считать в
школьном курсе органической химии.
На рис. 12 показано последовательное заполнение
молекулярных орбиталей электронами в
гомоядерных молекулах, образованных атомами
элементов 2-го периода.
В молекуле Li2 оба электрона с 2s-АО двух
атомов лития занимают самую нижнюю МО
(связывающую) – ![]() s
s
(рис. 12, а). В молекуле образуется одинарная
связь, осуществляемая одной парой электронов.
В молекуле Be2 четыре электрона с 2s-АО
двух атомов бериллия занимают две самые нижние
МО (связывающую и антисвязывающую) — ![]() s и
s и ![]() s* (рис. 12, б). В
s* (рис. 12, б). В
возможной молекуле число электронов на
связывающей и несвязывающей МО одинаково, так
что выигрыш в энергии от перехода электронов с 2s-АО
на ![]() s-МО
s-МО
полностью компенсируется проигрышем от перехода
электронов на ![]() s*,
s*,
и изменение энергии системы равно 0, связь не
образуется. Поэтому существуют двухатомные
молекулы щелочных металлов и не существуют
молекулы щелочно-земельных металлов.
В молекуле B2 четыре электрона с 2s-АО
двух атомов бора занимают две самые нижние МО
(связывающую и антисвязывающую) – ![]() s и
s и ![]() s*, а два электрона
s*, а два электрона
с 2р-АО занимают ![]() у– и
у– и ![]() z-МО (рис. 12, в). Электроны с 2s-АО
z-МО (рис. 12, в). Электроны с 2s-АО
не дают вклада в энергию связи молекулы. Поэтому
на следующих рисунках эти АО и соответствующие
МО ![]() s и
s и ![]() s* мы
s* мы
больше изображать не будем. В молекуле В2
одна электронная пара осуществляет связь. Эта
связь, как и в молекуле Li2, одинарная.
Обращает на себя внимание согласующееся с
экспериментом наличие неспаренных электронов в
молекуле B2. Если в молекуле или веществе
есть неспаренные электроны, то такие молекулы (и
вещества) обладают парамагнетизмом —
притягиваются магнитом. (В отличие от веществ, в
которых неспаренных электронов нет и которые
выталкиваются магнитным полем, – диамагнетиков.)
Отметим также, что молекула В2 с
неспаренными электронами является поэтому
радикалом.
В молекуле С2, как было сказано выше, мы
рассматриваем только 2р-АО (рис. 12, г).
Четыре электрона с этих орбиталей занимают две
самые нижние МО (связывающие) – ![]() у и
у и ![]() z. Cвязь осуществляют две
z. Cвязь осуществляют две
электронные пары. Это двойная связь.
В молекуле N2 (рис. 12, д) шесть
электронов с 2р-АО занимают три самые нижние
МО (связывающие) – ![]() у,
у,
![]() z и
z и ![]() x. Связь
x. Связь
тройная.
В молекуле О2 (рис. 12, е) восемь
электронов с 2р-АО занимают три связывающие ![]() у-,
у-, ![]() z– и
z– и
![]() x-МО и
x-МО и
две антисвязывающие – ![]() у* и
у* и ![]() z*. На связывающих МО на
z*. На связывающих МО на
четыре электрона (две электронные пары) больше,
чем на антисвязывающих. Связь двойная. В молекуле
кислорода есть неспаренные электроны, поэтому
кислород парамагнитен. Струя жидкого кислорода
притягивается магнитом.
Как и в случае бора, молекула кислорода
является радикалом. В большинстве реакций с
участием кислорода (особенно с органическими
реагентами) на первой стадии происходит просто
присоединение молекулы кислорода к молекуле
окисляющегося вещества с образованием
соединений типа пероксидов. Поэтому так опасны
органические производства, связанные с
применением кислорода в качестве окислителя.
На рис. 12, ж показана энергетическая
диаграмма молекулы F2, а на рис. 12, з –
молекулы (несуществующей!) Ne2.
В таблице (см. с. 10) приведены характеристики
рассматриваемых молекул. Обратите внимание на
корреляцию между кратностью, длиной и энергией
связи. Вы сами легко построите диаграммы для
остальных молекул, приведенных в таблице, и
сделаете вывод о возможности существования
пероксидов.
Обратите внимание, что, обсуждая строение
молекул, мы говорим, в каких свойствах молекулы
это строение проявляется. Тем самым мы уходим от
схоластического обсуждения «непонятных» схем и
делаем их инструментом познания.
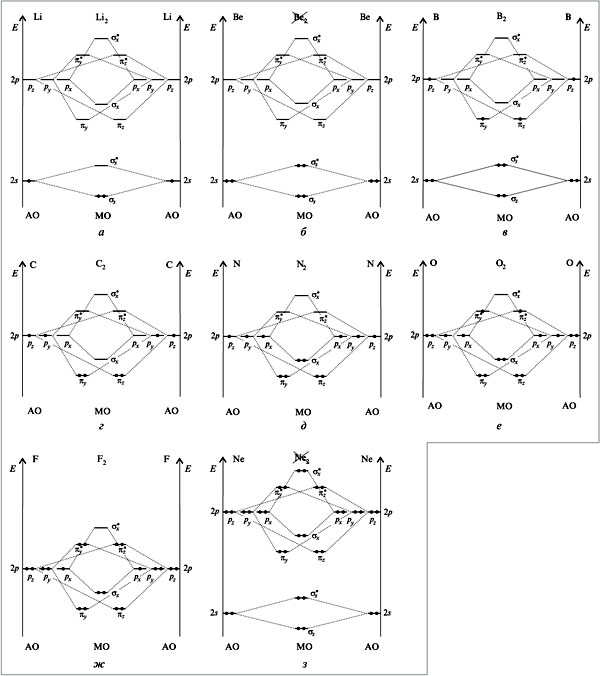 |
Рис. 12.
|
Гетеронуклеарные
двухатомные молекулы
Простейшая гетеронуклеарная молекула
образована простейшими атомами – Н и Не. Ее
диаграмма показана на рис. 7. Как мы уже отмечали,
эта молекула очень неустойчива. Тем не менее она
обнаружена экспериментально.
Приведем энергетические диаграммы еще
нескольких двухатомных молекул.
На рис. 13, а (см. с. 10) изображена
энергетическая диаграмма молекулы NO. (Для
экономии места 2р-АО изображены друг под
другом. Фигурная скобка является стандартным
обозначением одинаковости этих АО. Не показано
также перекрывание 2s-АО — ведь каждая из них
содержит по 2 электрона и так же, как в случае 1s-АО,
это перекрывание не дает вклада в энергию связи.)
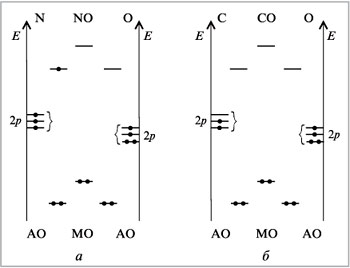 |
Рис. 13.
|
Из рис. 13, а виден радикальный
характер молекулы NO, обусловленный наличием
неспаренного электрона. Будучи радикалом, оксид
азота(II) легко вступает в реакции уже при
комнатной температуре (вспомните его реакцию с
кислородом воздуха).
На рис. 13, б приведена энергетическая
диаграмма самой прочной из известных
двухатомных молекул – СО.
Таблица
Характеристики двухатомных гомоядерных
молекул,
образованных атомами элементов 2-го периода
| Молекула | Избыток электронов на связывающих МО |
Kратность связи | Число неспаренных электронов |
Длина связи, нм |
Энергия связи при 0 K, кДж/моль |
|---|---|---|---|---|---|
| Li2 | 2 | 1 | 0 | 0,267 | 99 |
| Be2 | 0 | 0 | – | – | 0 |
| B2 | 2 | 1 | 2 | 0,159 | 276 |
| C2 | 4 | 2 | 0 | 0,124 | 605* |
| N2 | 6 | 3 | 0 | 0,109 | 945* |
| O2+ | 5 | 2,5 | 1 | 0,112 | 642 |
| O2 | 4 | 2 | 2 | 0,121 | 494 |
| O2– | 3 | 1,5 | 1 | 0,126 | 394 |
| O22– | 2 | 1 | 0 | 0,146 | ~140 |
| F2 | 2 | 1 | 0 | 0,144 | 155 |
| Ne2 | 0 | 0 | – | – | 0 |
* При 298 K.
В отличие от гомоядерных молекул в
гетероядерных молекулах связывающие МО
располагаются ближе к АО того атома, у которого
они ниже. Появляется асимметрия в распределении
электронной плотности между ядрами. Значит,
появляются электрические полюса у молекулы.
Иными словами, связи между разными атомами
всегда полярны.
Особенно ярко это выражается у соединений
металлов с неметаллами.
В качестве примера — молекула LiH (рис. 14).
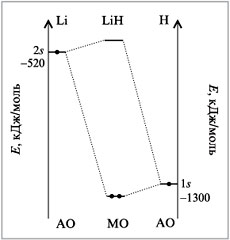 |
Рис. 14.
|
Отметим здесь, что в некоторых
учебниках написано, что молекул с ионной связью,
например NaCl, не существует. Но задумаемся: в каком
виде хлорид натрия переходит в пар при
достаточно высоких температурах? Молекул нет в
конденсированном (твердом или жидком) состоянии.
Но они существуют в газовой фазе. Правда, в таких
условиях их трудно назвать ионными.
На рис. 14. видно, что связывающая МО лежит очень
близко к 1s-АО атома водорода. Можно сказать,
что валентный электрон атома лития с его 2s-АО
перешел на 1s-АО атома водорода. На атоме
водорода поэтому появился отрицательный заряд, а
на атоме лития положительный. Образовалась ионная
связь. А откуда мы знаем, что 2s-АО Li лежит
намного выше, чем 1s-АО Н? Во-первых, это
показано на рис. 3 предыдущей лекции. Во-вторых,
все знают, что металлы отдают электроны легче,
чем неметаллы, т.е. их АО очень часто лежат выше,
чем у неметаллов.
Что же тогда такое ковалентная связь? При
образовании гомоядерной молекулы электроны с АО
переходят на МО, которые располагаются
симметрично относительно исходных атомов,
потому что это одинаковые атомы. Так образуется
ковалентная неполярная связь.
В любой гетероядерной молекуле максимум
электронной плотности между ядрами смещен к
одному из них. Это ковалентная полярная связь
(например, CO, NO). Ее крайний случай, никогда не
реализующийся в чистом виде, — ионная связь,
когда разность электроотрицательностей
соединяющихся атомов относительно велика
(например, LiH).
Многоатомные молекулы
Многоатомными считаются молекулы,
образованные более чем двумя атомами. Начнем их
рассмотрение с простейшей5
молекулы — молекулы СН4.
В многоатомной молекуле можно указать
центральный атом, с которого начинается
построение энергетической диаграммы.
Для такого атома выделяется одна
энергетическая ось. Энергетические диаграммы
лигандов6 будем изображать все
вместе на второй оси (рис. 15).
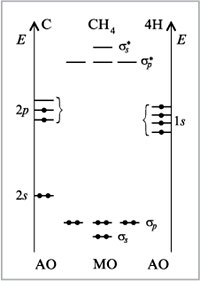 |
Рис. 15.
|
Строить энергетические диаграммы
сложных молекул можно по следующему алгоритму
(отвечая на вопросы, которые надо каждый раз
ставить для себя).
1) Какой атом центральный?
Атом углерода С. Его энергетическая диаграмма
слева на рисунке. На ней отмечены все валентные
АО, т.е. АО второго энергетического уровня.
Обращаем ваше внимание, что изображаются не
только АО с неспаренными электронами, но именно
все валентные АО. Нам не требуется понятие о
«возбужденных» состояниях.
2) Какие атомы – лиганды?
Четыре атома Н. На правой оси отмечаем энергии
АО лигандов, участвующих в образовании
![]() -связей, т.е. по
-связей, т.е. по
одной орбитали от каждого лиганда, именно той,
которая направлена к центральному атому. В
случае метана это требование излишне, т.к.
лиганды — атомы водорода — имеют лишь по одной
АО. Однако это правило приобретет смысл для более
сложных лигандов.
Отметим, что именно ![]() -связи определяют геометрию молекулы,
-связи определяют геометрию молекулы,
поэтому с них и начинаем.
Все 2р-АО одинаковы. Но в целях экономии
места на рисунке они изображены на разных
уровнях (мы об этом уже говорили).
При выборе положения уровня энергии АО
лигандов на энергетической оси желательно
согласовывать его по отношению к уровням энергии
центрального атома. Чем легче оторвать электрон
от атома, т.е. чем ниже ионизационный потенциал,
тем выше располагаются соответствующие АО на оси
энергий.
3) Сколько исходных АО принимает участие в
образовании связей?
Восемь (четыре орбитали атома С и четыре
орбитали четырех атомов Н).
4) Сколько МО образуется?
Восемь. Напомним, что число МО всегда равно
числу исходных АО.
5) Сколько образовалось связывающих МО?
Четыре. Число связывающих МО равно числу АО
того партнера, у которого их меньше. В данном
случае число АО центрального атома равно числу
АО лигандов, по четыре.
6) Сколько образовалось антисвязывающих МО?
Четыре. Число антисвязывающих МО равно числу
связывающих.
7) Сколько образовалось несвязывающих МО? (Об
этих орбиталях см. ниже: диаграммы для молекул NH3
и H2O.)
Нисколько.
8) Сколько типов (по способу перекрывания) МО
образовалось (сколько разных МО)?
Два. У лигандов все АО одинаковы (1s), а у
центрального атома их два вида (2s и 2р).
Поэтому образовалось два типа МО — одна,
обусловленная перекрыванием орбиталей лигандов
с единственной 2s-АО атома С (![]() s), и три – с тремя 2р-АО
s), и три – с тремя 2р-АО
атома С (![]() p).
p).
9) Сколько электронов находилось на
перекрывающихся АО и, следовательно, находится
на образовавшихся МО?
Восемь: четыре электрона атома С и четыре
электрона четырех атомов Н.
10) Последний шаг — заполнение МО электронами.
Как и в атоме, заполнение орбиталей происходит
снизу вверх, на одной орбитали находится не более
двух электронов, при наличии МО с одинаковой
энергией заполняется их максимальное число.
Мы видим, что в молекуле метана в соответствии с
результатом метода МО электроны располагаются
на двух энергетических уровнях, что
подтверждается экспериментом. Это не значит, что
в молекуле СН4 электроны обладают разной
энергией. Примирить одинаковость состояния всех
электронов в молекуле СН4 с наличием двух
энергетических уровней можно, если представить
себе, что каждый из восьми электронов 1/4 времени
проводит на ![]() s-уровне
s-уровне
и 3/4 времени на
![]() p-уровне.
p-уровне.
Теперь ответим на вопрос, какова геометрия
молекулы, т.е. каковы углы Н–С–Н между связями
С–Н.
Мы видим, что вокруг центрального атома имеется
четыре максимума электронной плотности (в
соответствии с существованием четырех ![]() -связей). Их
-связей). Их
взаимодействие между собой выражается в
отталкивании одноименных зарядов. Они будут
располагаться в пространстве максимально далеко
друг от друга. При этом, поскольку все лиганды
одинаковы, расположение будет симметрично. Эти
требования выполняются, если названные
максимумы электронной плотности (и лиганды
соответственно) будут направлены к углам
правильного тетраэдра. Говорят, что угол между
связями в таких молекулах тетраэдрический,
равный 109°28′ ![]() 109,5° (рис. 16).
109,5° (рис. 16).
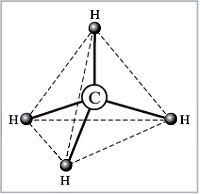 |
Рис. 16.
|
Одинаковость МО в молекуле метана
часто объясняют существованием так называемой
гибридизации атомных орбиталей при образовании
молекулы. Как видите, без этого можно, а значит,
нужно обходиться.
Соблюдая вышеприведенные правила, легко
построить энергетические диаграммы молекул
аммиака NH3 и воды Н2О (рис. 17).
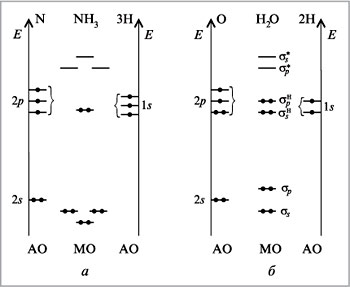 |
Рис. 17.
|
В молекуле аммиака в образовании
связей участвуют четыре АО атома азота (первый
партнер) и три АО трех атомов водорода (второй
партнер). Поэтому образуется три связывающих и
столько же антисвязывающих, т.е. всего шесть, МО. А
должно быть семь (по числу исходных АО). Остается
одна МО, которая и является несвязывающей.
В молекуле воды таких несвязывающих МО две.
Повторим вышеприведенный десятишаговый
алгоритм для молекулы воды.
1) Какой атом центральный?
Атом кислорода О. Его энергетическая диаграмма
показана на рис. 17, б.
2) Какие атомы – лиганды?
Два атома Н.
3) Сколько исходных АО принимает участие в
образовании связей?
Шесть (четыре орбитали атома О и две орбитали
двух атомов Н).
4) Сколько МО образуется?
Шесть.
5) Сколько образовалось связывающих МО?
Две. Число связывающих МО равно числу АО того
партнера, у которого их меньше.
6) Сколько образовалось антисвязывающих МО?
Две. Число антисвязывающих МО равно числу
связывающих.
7) Сколько образовалось несвязывающих МО?
Две. Число несвязывающих МО равно общему числу
МО за вычетом суммарного числа связывающих и
антисвязывающих МО, т.е. 6 – (2 + 2) = 2. Вы видите на
диаграмме, что несвязывающие МО находятся между
связывающими и антисвязывающими, т.е. не дают
вклада в энергию связи, отсюда их название. Такие
МО появляются, когда число перекрывающихся
атомных орбиталей неодинаково у
атомов-партнеров.
8) Сколько типов МО образовалось (сколько разных
МО)?
Два (![]() s
s
и ![]() p).
p).
9) Сколько электронов находилось на
перекрывающихся АО и, следовательно, находится
на образовавшихся МО?
Восемь.
10) Последний шаг — заполнение МО электронами.
Теперь о геометрии молекул. Если в молекуле
метана все максимумы электронной плотности
соответствовали связывающим МО (с одинаковыми
лигандами), то в молекулах аммиака и воды заняты
электронами разные МО — связывающие и
несвязывающие. Поэтому, несмотря на тенденцию к
образованию тетраэдрического угла между
четырьмя максимумами электронной плотности,
расположенными вокруг центрального атома, этот
угол оказывается искаженным тетраэдрическим
107,78° ![]() 108° в NH3 и 104°31′
108° в NH3 и 104°31′ ![]() 104,5° в Н2О.
104,5° в Н2О.
На рис. 18 представлены диаграммы молекул с
другой геометрией.
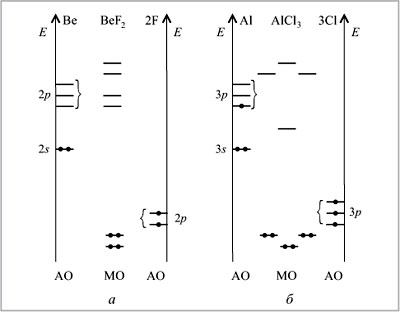 |
Рис. 18.
|
Обратите внимание, что от лигандов
взято только по одной орбитали, содержащей по
одному электрону. Это АО, участвующие в
образовании ![]() -связей.
-связей.
Молекула BeF2 имеет те же МО, что и молекула
Н2О. Однако в ней всего четыре электрона на
двух МО, т.е. имеется лишь два максимума
электронной плотности вокруг центрального
атома. Эти максимумы оказываются на наибольшем
удалении друг от друга, если угол между связями
F–Be–F будет равен 180°, что и наблюдается на самом
деле. Аналогичными рассуждениями получаем угол
Cl–Al–Cl в молекуле хлорида алюминия, равный 120°.
Выше мы отмечали, что любая гетероядерная связь
(связь между атомами разных элементов) полярна.
Но рассмотрим молекулу СН4. В ней четыре
полярных связи С–Н. Однако из-за полной
симметрии молекула неполярна. Полярными
оказываются лишь несимметричные гетероядерные
молекулы. Так, полярна угловая молекула воды Н2О
и неполярна линейная молекула BeF2, полярна
молекула NH3 и неполярна AlCl3.
Комплексные соединения
Примером комплексного7
соединения может служить ион аммония NH4+.
Отличие комплексных соединений от обычных
(симплексных8) состоит в том,
что в них число связей у центрального атома
больше, чем его валентность. Это оказывается
нетерпимым, если следовать наиболее
распространенному мнению, отождествляющему
валентность с числом связей, образуемых атомом.
Сравните симплексную частицу CH4 с
комплексной NH4+. Никакой
разницы в электронном строении. Разница только в
происхождении электронов. В первой частице на МО
перешли в равных количествах электроны обоих
партнеров, а во второй – число электронов одного
из партнеров больше. Говорят, что азот явился
донором электронной пары, а водород акцептором, и
потому связь называют донорно-акцепторной.
Формально комплексные частицы (ионы, молекулы)
можно определить как частицы, у которых степень
окисления (по абсолютной величине) центрального
атома меньше, чем суммарная степень окисления
лигандов или число лигандов.
Например, в ионе SO42– степень
окисления атома серы равна +6, суммарная степень
окисления атомов кислорода равна –8,
следовательно, это комплексный ион, как и все
остальные анионы оксокислот. В ионе Cu(H2O)42+
степень окисления атома меди равна +2, а число
молекул воды (лигандов) – 4. Это тоже комплексная
частица, как и все остальные гидраты катионов
металлов.
Комплексные соединения составляют большинство
среди неорганических соединений.
Вопросы и задания
1. Энергия связи в какой из молекул — H2,
Li2, Na2 — больше и почему?
Ответ. С увеличением атома (объема АО)
электронная плотность на АО и, следовательно, на
образующейся МО уменьшается, поэтому связь
ослабляется. Самая прочная из указанных молекул
— молекула водорода.
2. Почему 1s-АО Не имеет меньшую энергию,
чем 1s-АО Н?
Ответ. См. лекцию № 6, где рассмотрены
энергии внешних АО в зависимости от положения
элемента в периодической системе.
3. Что такое энергия химической связи?
Ответ. Энергия химической связи – это
энергия, которая выделяется при соединении
атомов между собой. Или, что то же, энергия,
которую надо затратить на разъединение двух
атомов.
4. Почему валентными орбиталями у элементов
2-го периода не являются 1s-АО?
Ответ. При перекрывании двух АО (в данном
случае 1s-АО) образуются две МО — связывающая
и антисвязывающая. На этих АО у элементов 2-го
периода находится четыре (по два от каждого
атома) электрона. Кратность связи поэтому равна 0,
т.е. эти МО не дают вклада в энергию связи и не
учитываются.
5. Изобразите энергетические диаграммы
двухатомных гомоядерных молекул 3-го периода: Na2,
Mg2, Al2, Cl2. Что вы можете сказать
об их свойствах?
Ответ. Диаграммы полностью повторяют
диаграммы их вышестоящих в группах аналогов. Но
поскольку атомы больше, то и прочность связи в
них меньше. А молекулы Mg2, конечно, не
существует. Самая прочная молекула из них — Cl2,
т.к. атомы хлора наименьшие при той же кратности
связи в молекулах.
6. Диа- или парамагнитна молекула С2?
Ответ. Молекула С2 диамагнитна.
7. Расположите в порядке возрастания
прочности связи молекулы азота, кислорода и
фтора. Ответ мотивируйте.
Ответ. С увеличением кратности связи ее
прочность в молекулах возрастает: F–F, O=O, N![]() N.
N.
8. Чему равна кратность связи в молекулах NО
и CO?
Ответ. В молекуле NO число валентных
электронов, перешедших на МО: 5 (N) + 6 (О) = 11 (NO). Число
электронов на связывающих МО — 8. Число
электронов на антисвязывающих МО — 3. Кратность
связи равна 1/2•(8 – 3) = 2,5. В молекуле СО кратность
связи равна 1/2•(8 – 2) = 3.
9. К какому атому смещена электронная
плотность в молекулах NO, HCl, NaBr?
Ответ. Электронная плотность смещена к
более электроотрицательному атому, т.е. к O, Cl, Br
соответственно.
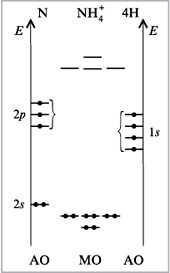
10. Постройте энергетическую диаграмму иона
NH4+. Какова его геометрия (углы
между связями
N–Н)? Полярна ли молекула?
Ответ. Полная аналогия с молекулой СН4
— одинаковое число МО, одинаковое число
электронов. Поэтому и угол между связями
идеальный тетраэдрический (рис. 19).
|
|
Рис. 19.
|
1 Обычно молекулой называют
электронейтральную частицу. Но при рассмотрении
химической связи молекулой называют любую
связанную электронно-ядерную систему, в том
числе не только сложные ионы, но и кристаллы.
2 В других учебниках вы часто
будете встречать устаревающий термин
«разрыхляющая» вместо современного термина
«антисвязывающая». В данном контексте это
слова-синонимы.
3 Часто эту линию называют осью z.
4 Гомоядерная молекула
образована одинаковыми атомами, гетероядерная —
разными.
5 Выбор «простейшей» молекулы,
конечно, условен и зависит от вкуса автора.
6 Лигандами называются атомы,
ионы или молекулы, окружающие центральный атом
(ион). Термин взят из химии комплексных
соединений, о которых речь пойдет позже.
7 От англ. complex – сложный.
8 От англ. simple – простой.
Олег Лебедь
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Электронная конфигурация атома
Определение 1
Электронная конфигурация атома – это запись распределения электронов в его атомах по оболочкам и подоболочкам. Химические свойства элемента зависят главным образом от строения электронной оболочки атома и от числа электронов на внешнем (валентном) слое. Электронная конфигурация обычно записывается для атомов в их основном состоянии. Для определения конкретной конфигурации атома в основном состоянии существуют три основных правила.
Правила Клечковского. Электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
1-е правило Клечковского: орбитали заполняются по мере увеличения сумм главного и орбитального квантовых чисел $n + l$.
2-е правило Клечковского: при одинаковых значениях суммы $n + l$ орбитали заполняются по мере увеличения главного квантового числа.
Принцип запрета Паули – на одной орбитали не может быть двух электронов с совпадающими квантовыми числами. То есть на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины. Принято обозначать спин $+1/2$ стрелкой, направленной вверх, а спин $-1/2$ – стрелкой, направленной вниз.
Правило Хунда – суммарный спин атома в $s-, p-, d-$ и других подоболочках должен быть максимальным. Другими словами, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами и лишь после того, как одиночные электроны займут все орбитали, происходит их окончательное заполнение оставшимися электронами с противоположными спинами.
Правилу Хунда отвечает минимум энергии атома. Такое состояние атома называется основным. Распределение электронов в атомах, которое приводится в таблице Периодической системы Д.И. Менделеева, отвечает основному состоянию атома. При других размещениях в атоме электроны будут находиться в возбужденном состоянии с более высокой энергией.
«Атомные и молекулярные орбитали» 👇
Примеры решения типовых задач на составление электронной конфигурации атома
Пример 1
Обосновать электронную конфигурацию атома водорода.
Решение. Атом водорода имеет атомный номер $1$, следовательно количество электронов в атоме – $1$. Этот единственный электрон должен занимать $s$-орбиталь $К$-оболочки, поскольку она имеет самую низкую энергию. Таким образом, электронная конфигурация атома водорода $1s^1$ (индекс $1$ указывает на число электронов, занимающих орбиталь $1s$).
Пример 2
Обосновать электронную конфигурацию атома лития.
Решение. Атомный номер лития – $3$, количество электронов – $3$. Орбиталь с самой низкой энергией – это $1s$-орбиталь. Согласно принципу запрета Паули, она может принять только два электрона, причем имеющие разные спиновые квантовые числа. Третий электрон в атоме лития должен занимать орбиталь, следующую по энергии за самой низкой $1s$-орбиталью, т.е. $2s$-орбиталь. Таким образом, литий имеет конфигурацию $1s^22s^1$.
Пример 3
Записать и изобразить графически электронную конфигу-рацию атома азота.
Решение. Азот имеет атомный номер $7$, следовательно, в атоме азота содержится $7$ электронов, а его электронная конфигурация записывается как $1s^22s^22p^3$. Три электрона. Находящиеся на $2р$-оболочке, должны располагаться поочередно на каждой из трех $2р$-орбиталей. При этом все три электрона должны иметь параллельные спины.
Графически это изображается как:
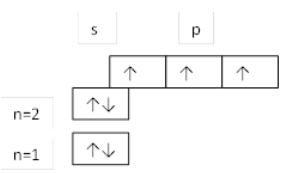
Рисунок 1.
Пример 4
Написать электронную формулу атома углерода в основ-ном и возбужденном состоянии.
Решение. Электронная формула атома углерода в основном состоянии $1s^22s^22p^2$. В возбужденном состоянии один из электронов из $2s$-подоболочки переходит на $2р$-уровень с образованием конфигурации $1s^22s^12p^3$. Такой переход сопровождается затратой энергии, но при образовании соединений четырехвалентного углерода эта затрата компенсируется выигрышем по энергии при образовании четырех связей.
Молекулярные орбитали
Заполнение молекулярных орбиталей $(МО)$ электронами происходит по тем же принципам, что и заполнение атомных орбиталей: на каждой молекулярной орбитали может находиться один или два электрона, причем с противоположными спинами. Существуют $МО$ трех типов: связывающие, несвязывающие и разрыхляющие.
Связывающие орбитали образуются в результате перекрывания (наложения) атомных орбиталей двух соседних атомов. В свою очередь, связывающие орбитали подразделяются на $sigma$-орбитали («сигма») и $pi$-орбитали («пи»), соответствующие $sigma$- и $pi$-связям. Образование $sigma$-связи происходит в результате лобового перекрывания между атомными орбиталями следующих типов:
-
двух $s$-орбиталей (рис. 1 а);
-
двух $р$-орбиталей, ориентированных вдоль одной оси (рис. 1 а);
-
одной $s$-орбитали и одной $р$-орбитали, ориентированной в сторону $s$-орбитали.
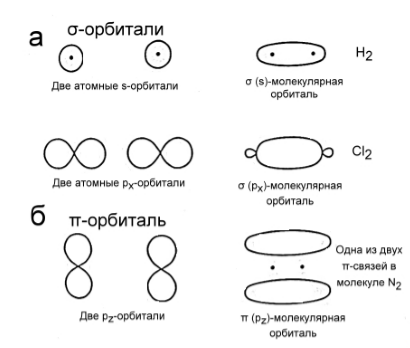
Рисунок 2. Схематическое изображение связывающих орбиталей
Образование $pi$-связи происходит в результате бокового (двойного) перекрывания $р$-орбиталей двух атомов (рис. 1 б). Такая связь возникает только в том случае, если между атомами уже существует $sigma$-связь.
Определение 2
Несвязывающие орбитали – это орбитали, на которых находятся неподеленные пары, т. е. не участвующие в образовании связей, электроны. Классическими примерами атомов, содержащих неподеленные пары электронов, являются кислород и азот.
Разрыхляющие орбитали. Каждая $sigma$- или $pi$-орбиталь состоит из двух перекрывающихся атомных орбиталей. Электроны на таких орбиталях связывают атомы в молекулу. Но электроны могут находиться и на других орбиталях, где они способствуют разрушению молекулы. Подобные орбитали называются разрыхляющими. Для их обозначения используется знак $«*»$, например, разрыхляющая $sigma$-орбиталь обозначается $sigma*$. Разрыхляющая орбиталь имеет более высокую энергию, чем соответствующая ей (однотипная) связывающая орбиталь. Поэтому разрыхляющие орбитали заселяются электронами в последнюю очередь.
Гибридные атомные орбитали
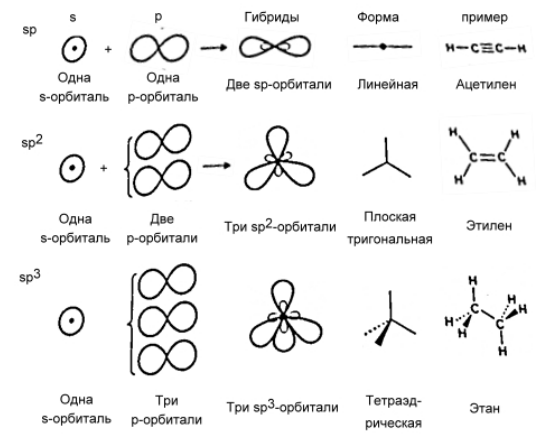
Рисунок 3. Гибридные атомные орбитали
Атомные орбитали, принимающие участие в образовании ковалентных связей, способны образовывать гибридные атомные орбитали. Особенно это характерно для молекул органических соединений. На рисунке 2 показана форма гибридных атомных орбиталей трех типов, образованных из $s-$ и $р$-орбиталей. При смешивании одной $s-$ и одной $р$-орбитали получаются две гибридные $sp$-орбитали. При смешивании одной $s-$ и двух $р$-орбиталей образуется $sp^2$-гибридная орбиталь и т.д. Гибридные орбитали из одного набора эквивалентны: из нельзя отличить друг от друга по форме или по энергии, они различаются лишь ориентацией в пространстве.
Метод молекулярных орбиталей
Молекулярные орбитали могут быть получены как линейная комбинация атомных орбиталей. Такая комбинация проводит к образованию связи, если энергии атомных орбиталей сравнимы по величине, зарядовые облака атомных орбиталей перекрываются, а исходные атомные орбитали обладают одинаковыми свойствами симметрии относительно оси молекулы.
Если на молекулярных орбиталях имеются неспаренные электроны, то молекула парамагнитна, если все электроны спарены – диамагнитна.
Порядок связи определяется как полуразность числа связывающих и разрыхляющих электронов. Например, в молекулярном ионе водорода порядок связи равен $½$ (рис.3).
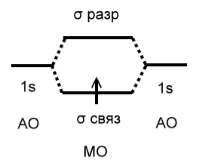
Рисунок 4. Энершетическая диаграмма $H_2^+$
Примеры решения типовых задач на составление энергетических диаграмм молекул
Пример 5
Составить энергетическую диаграмму молекулы $В_2$. Определить порядок связи и магнитные свойства.
Решение. Энергетическая диаграмма $В_2$ должна включать $МО$, обра-зованные из $2s-$ и $2p$-уровней изолированных атомов бора (рис. 4). По правилу Хунда происходит заполнение $pi$-связывающих уровней, так что молекула парамагнитна; порядок связи – единица.
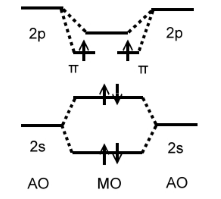
Рисунок 5. Энергетическая диаграмма $B_2$
Пример 6
На какую атомную орбиталь – бора или хлора – будут походить молекулярные орбитали молекулы $BCl_3$?
Решение. Ввиду большей электроотрицательности хлора электроны от атома бора перейдут на молекулярные орбитали, энергия которых будет ближе к энергиям атомных орбиталей атомов хлора.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме