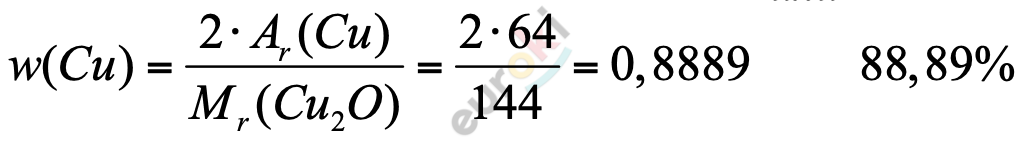Составьте формулы бинарных соединений металлов с двухвалентной серой − _ _ _ _ _ _ _ _ _ _ , рассчитайте их Mr и массовую долю металла:
а) лития _, Mr ( _ ) = _
ω(Li) = _ , или _%
б) бария _, Mr ( _ ) = _
ω(Ba) = _, или _%
в) алюминия _, Mr ( _ ) = _
ω(Al) = _, или _%
г) свинца (IV) _, Mr ( _ ) = _
ω(Pb) = _, или _%
reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §8. Часть II. Номер №1
Решение
Составьте формулы бинарных соединений металлов с двухвалентной серой − сульфидов, рассчитайте их Mr и массовую долю металла:
а) лития $Li_{2}S$, Mr ($Li_{2}S$) = 2 * 7 + 32 = 46
ω(Li) = 2 * 7 : 46 = 0,3043, или 30,43%
б) бария BaS, Mr (BaS) = 137 + 32 = 169
ω(Ba) = 137 : 169 = 0,81, или 81%
в) алюминия $Al_{2}S_{3}$, Mr ($Al_{2}S_{3}$) = 2 * 27 + 3 * 32 = 150
ω(Al) = 2 * 27 : 150 = 0,36, или 36%
г) свинца (IV) $PbS_{2}$, Mr ($PbS_{2}$) = 207 + 2 * 32 = 271
ω(Pb) = 207 : 271 = 0,76, или 76%
Содержание
- Формулы бинарных соединений
- Определение и формулы бинарных соединений
- Примеры решения задач
- Определение валентности химических элементов. Составление формул двухэлементных (бинарных) соединений
- Открытый урок по химии на тему:«Составление формул бинарных соединений» для 8х классов! методическая разработка по химии (8 класс) по теме
- Скачать:
- Предварительный просмотр:
Формулы бинарных соединений
Определение и формулы бинарных соединений
Их названия образуются от латинского корня названия более электроотрицательного элемента с окончанием –ид и русского названия менее электроотрицательного элемента в родительном падеже, причем в формулах бинарных соединений первым записывается символ менее электроотрицательного элемента. Например, Ag2O – оксид серебра (I), OF2 – фторид кислорода, KBr – бромид калия, Mg3N2 – нитрид магния, CaC2 – карбид кальция (однако названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот).
Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами степень его окисленности. Так, Cu2O – оксид меди (I), CuO – оксид меди (II), CO – оксид углерода (II), CO2 – оксид углерода (IV), SF6 – фторид серы (VI). Можно также вместо степени окисленности указывать с помощью греческих числительных приставок (моно, ди, три, тетра, пента, гекса и т.д.) число атомов более электроотрицательного элемента в формуле соединения: CO–монооксид углерода, CO2 – диоксид углерода, SF6 – гексафторид серы.
Для того, чтобы составить формулу бинарного соединения необходимо соблюдать следующую последовательность действий (рассмотрим подробно на примере оксида железа (III)):
- Изображаем химические знаки элементов, входящих в состав оксида
Проставляем над знаком каждого элемента валентность римской цифрой:
Примеры решения задач
| Задание | В состав вещества входят 30,7% калия, 25,2% серы, 44% кислорода. Вывести формулу этого соединения. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов калия в молекуле через «х», число атомов серы через «у» и число атомов кислорода через «z».
Найдем соответствующие относительные атомные массы элементов калия, серы и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(K) = 39; Ar(S) = 32; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O);
x:y:z= 30,7/39 : 25,2/32 : 44/16;
x:y:z= 0,787 : 0,787 : 2,75.
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 0,787):
0,787/0,787 : 0,787/0,787 : 2,75/0,787;
1 : 1: 3,5 = 2 : 2: 7.
Следовательно, простейшая формула соединения калия, серы и кислорода имеет вид K2S2O7.
Ответ K2S2O7
| Задание | Подвергнув анализу вещество, установили, что в его состав входят: натрий с массовой долей 0,4207 (или 42,07%), фосфор с массовой долей 0,189 (или 18,91%), кислород с массовой долей 0,3902 (или 39,02%). Найдите формулу соединения. |
| Решение | Обозначим число атомов натрия в молекуле через «х», число атомов фосфора через «у» и число атомов кислорода через «z». |
Найдем соответствующие относительные атомные массы элементов натрия, фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(Na) = 23; Ar(P) = 31; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
Na:P:O = 42,07/39 : 18,91/31 : 39,02/16;
Na:P:O = 1,829 : 0,61 : 2,43.
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 0,61):
1,829/0,61 : 0,61/0,61 : 2,43/0,61;
Следовательно, простейшая формула соединения натрия, фосфора и кислорода имеет вид Na3PO4. Это фосфат натрия.
Источник
Определение валентности химических элементов. Составление формул двухэлементных (бинарных) соединений
Пример. Сера содержится в VIa, а хлор — в VIIa группе. Значит, высшая валентность серы VI, а хлора — VII (рис. 12.2).
Значение валентности неметаллического элемента в соединении с водородом или металлическим элементом равно разности между числом VIII и номером соответствующей группы.
Пример. Азот содержится в Va группе. Следовательно, в соединениях с водородом и металлическими элементами он проявляет валентность III (VIII — V = III).
Применим приобретенные знания для составления формул двухэлементных (бинарных) соединений.
 |
| Рис. 12.2. Определение валентности химических элементов по расположению в периодической системе химических элементов |
Задание. Составь формулу соединения фосфора с кислородом, в котором фосфор проявляет высшую валентность.
В формулах бинарных соединений символ металлического элемента записывают первым
Составлять химические формулы бинарных соединений нужно по определенному плану:
Последовательность действий
Выполнение действия
1. Запиши химические символы фосфора и кислорода.
2. Помня, что кислород двухвалентный, обозначь в формуле его валентность римской цифрой над соответствующим символом.
3. По периодической системе определи высшую валентность фосфора. Он находится в Va группе, значит его высшая валентность — V. Обозначь ее над символом фосфора.
4. Найди наименьшее общее кратное для значений валентности фосфора и кислорода. Наименьшее число, которое делится без остатка на валентности обоих элементов, — 10. Запиши его арабской цифрой сверху между значениями валентностей.
5. Раздели наименьшее общее кратное на валентность фосфора (10 : V = 2). 2 — нижний индекс; запиши его арабскими цифрами возле символа фосфора справа.
6. Раздели наименьшее общее кратное на валентность кислорода (10 : II = 5). 5 — нижний индекс; запиши его арабскими цифрами возле символа кислорода справа.
7. Проверь правильность составления формулы соединения.
Суммарная валентность всех атомов одного элемента должна равняться суммарной валентности всех атомов другого элемента.
Умножь индексы на валентности соответствующих элементов и сравни полученные произведения: 2 • V = 10 и 5 • II = 10. Произведение индекса фосфора в формуле на его валентность равно про изведению индекса кислорода в формуле на его валентность. Следовательно, формула составлена правильно. Запиши ее.
Наши действия отображает схема (рис. 12.3):
 |
| Рис. 12.3. Составление формулы соединения фосфора (V) с кислородом |
В формулах бинарных соединений символ кислорода записывают вторым, за исключением соединения с фтором
Определение валентности по формулам бинарных соединений. Зная как соотносятся суммарные валентности атомов каждого из химических элементов в бинарном соединении, можно определить валентность одного из элементов в бинарном соединении по известной валентности другого химического элемента.
Задание. Определи валентность серы в соединении, формула которого H2S.
Последовательность действий
Выполнение действия
1. Запиши химическую формулу вещества.
2. Помня, что водород одновалентен, обозначь в формуле его валентность римской цифрой над со ответствующим символом.
3. Найди суммарную валентность атомов водорода, умножив его валентность на индекс: I • 2 = 2. Запиши ее арабской цифрой сверху между символами элементов.
4. Раздели суммарную валентность на количество атомов серы: 2 : Ь — II. Полученное частное и будет искомой валентностью серы. Запиши ее значение над соответствующим символом в фор муле соединения. Материал с сайта http://worldofschool.ru
5. Проверь правильность определения валентности серы.
Суммарная валентность всех атомов одного элемента должна равняться суммарной валентности всех атомов другого элемента.
Умножь индексы на валентности соответствующих элементов и сравни полученные произведения: 2 • I = 2 и 1 • II = 2. Произведение индекса водорода в формуле на его валентность равно произведению индекса серы в формуле на ее валентность. Следовательно, валентность серы определена правильно.
Источник
Открытый урок по химии на тему:«Составление формул бинарных соединений» для 8х классов!
методическая разработка по химии (8 класс) по теме
Тема урока. Составление химических формул бинарных соединений по степени окисления химических элементов и валентности. В материале присутствуют все этапы урока от организационной части до заключения и подведения итогов!
Скачать:
| Вложение | Размер |
|---|---|
| urok.docx | 50.32 КБ |
| prezentaciya_uroka_stepen_okisleniya.ppt | 1.45 МБ |
Предварительный просмотр:
Урок «Составление формул бинарных соединений»
Эпиграф: «Химические формулы говорят целую история вещества».
Тема урока. Составление химических формул бинарных соединений по степени окисления химических элементов и валентности.
Место данного урока в теме: второй урок в данной теме.
- Образовательные:
- закрепить у учащихся понятие степени окисления, бинарные соединения, химическая формула;
- научить правильно составлять химические формулы бинарных соединений по степени окисления химических элементов и валентности.
- Развивающие:
- научить приемам сравнения и обобщения изучаемых понятий ;
- отработать умения и навыки в определении степени окисления по химическим формулам;
- продолжить развитие навыков самостоятельной работы (через работу с учебником);
- умения работать в парах (при проверке домашнего задания) ;
- способствовать развитию логического мышления (через вопросы заставляющие логически мыслить)
- Воспитательные:
- формировать чувство толерантности (терпимости и уважения к чужому мнению), взаимопомощи
- осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентации)
- развивать уважение к мыслителям прошлого (при помощи высказываний великих людей).
Практическая направленность: умение составлять формулы веществ при решении практических задач.
Технические средства обучения:
- ПК, проектор, экран
- Периодическая система Д.И. Менделеева
- Презентация (авторская разработка)
- О.С.Габриелян, « Учебник. Химия 8 класс».
- Тест
- Алгоритм для составления формул бинарного соединения.
- Номенклатура бинарных соединений.
Тип урока: комбинированный
Методы и технологии:
- Словесно-наглядно-практический метод
- «Урок – упражнение»
- Использование информационных технологий
- Практический метод
- Коммуникативный метод
- Игровой метод
- Организационный момент. (Приветствие, готовность, мотивация)
- Проверка домашнего задания.
- Практическая значимость.(Видео фрагмент)
- Постановка темы урока и ее целей. Активизация мыслительных действий (через высказывания великий людей).
- Обобщение. Выведение алгоритма составления формулы бинарного соединения. (Раздаточный материал)
- Закрепление.
- Итоговое обобщение.
- Оценки за урок.
- Домашнее задание.
- Рефлексия.
1. Организационный момент .
(Учебник, тетрадь, дневник, дидактический материал). Приветствие, готовность, мотивация.
Здравствуйте, ребята. Сегодня у нас на уроке присутствуют мои коллеги, поприветствуйте их.
«Три человека тащат тяжёлые камни в город. Пот катится со всех трёх.
– Тащу эту проклятую ношу.
– Зарабатываю на хлеб себе и семье, – бодро ответил он.
Третий на тот же вопрос улыбнулся:
– Строю замечательный храм, который простоит века на радость людям и утешение им!»
Вывод: Труд имеет значимость для каждого из нас. С помощью трудовой, сознательной деятельности каждый человек создаёт для себя и для людей блага.
Я хочу вас спросить: «А зачем вы пришли ко мне на урок?»
Учитель говорит о том, что дети приходят на занятия по химии, чтобы сделать открытия, чтобы узнать что то новое.
Учитель рассказывает о том, что когда то и он, будучи учеником, открыл для себя химические формулы. Сейчас он знает их много, но ему не надо их заучивать.Для того, чтобы написать формулу вещества, достаточно знать всего лишь одно химическое понятие «Степень окисления», с которым вы познакомились на прошлом уроке.
2. Проверка домашнего задания.
Тест. (приложение 1)
1.Степень окисления — это величина
в) постоянная и переменная
2. Высшая степень окисления фосфора равна:
а) номеру группы, т.е. 5,
3 . Степень окисления хлора равна -1 в:
4 .В каком соединении степень окисления определена не верно:
5. Степени окисления марганца в соединениях MnO, MnO 2 , Mn 2 O 7 соответственно равны:
3. Практическая значимость.
— Посмотрите на формулы веществ представленных на слайде. Что у них общего? (состоят из двух элементов, т.е. являются бинарными).
Из представленных формул есть важнейшие из них.
Н 2 О-самое удивительное, распространенное и самое необходимое вещество на нашей планете .Без воды никуда.
СО 2 -углекислый газ, основа процесса фотосинтеза, т.е. нашего дыхания, используется для приготовления газированных напитков, сухой лед для хранения мороженного.
Al 2 O 3 — оксид алюминия входит в состав минералов и горных пород, является основой драгоценных камней (рубин, сапфир)
CaO — оксид кальция, применяется в строительстве для получения вяжущих материалов.
Более подробно с ними познакомимся на следующем уроке.
4. Учитель объявляет тему урока – запись темы в тетрадь.
Сегодня на уроке мы научимся составлять химические формулы бинарных соединений по степени окисления химических элементов и валентности.
Составить формулу вещества, значит определить индексы, показывающие число атомов в молекуле.
А сейчас вы получите алгоритм как составлять формулу бинарного соединения, который вклейте в тетрадь. Раздать раздаточный материал «Алгоритм составления формулы бинарного соединения»
Алгоритм составления формулы бинарного соединения.(приложение 2)
- На первом месте пишется элемент с меньшей электроотрицательностью (См. в таблицу Д.И. Менделеева).
- Элемент написанный на первом месте имеет положительный заряд, а на втором отрицательный. Указать для каждого элемента степень окисления.
- Найти наименьшее общее кратное для значений степеней окисления. (Число которое делится на исходные числа без остатка).
- Разделить наименьшее общее кратное на значение степени окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
- Проверка. Суммарное значение степеней окисления равно 0.
Задание: попробуем составить формулы содержащие Ca и Сl, AL и O.
— А как назвать эти бинарные вещества?
Правило составления названия бинарных веществ. (приложение3)
1.Названия состоят из двух слов.
2.Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом – ид стоит всегда в именительном падеже.
3.Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название в родительном падеже.
- AL 2 S 3 — сульфид алюминия
- CaCl 2 — хлорид кальция
- AL 2 O 3 – оксид алюминия
Э x H y — гидриды
Э x O y — оксиды
Э x Sy -сульфиды
Э x Cly -хлориды
Э x Br y -бромиды
Э x F y — фториды
Э x P y — фосфиды
Э x N y -нитриды
Э x C y -карбиды
Э x Si y -силициды
— Составьте формулы веществ состоящих из Fe +3 и Cl, Fe +2 и Cl.
А как же назвать эти вещества?
FeCl 3 — хлорид железа (III)
FeCl 2 — хлорид железа (II)
5.Понятие о валентности.
Валентность — это свойства атомов одного химического элемента присоединять определённое число атомов другого.
Это понятие было введено в химию в 1853 г. английским химиком-органиком Франклендом для обоснования количественных отнощений атомов элементов в химических соединениях. Развитие учения о валентности в большой степени связано с открытием Д.И. Менделеевым Периодического закона. Им была установлена связь между валентностью элемента и его положением в периодической системе, введено понятие о переменной валентности. Учение о строении атомов и молекул способствовало разработке электронной теории валентности.
Для расчётов, для составления формул веществ неоходимо знать количественные соотношения атомов различных элементов, в которых они соединяются. Валентность показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
Одновалентными считают все элементы, атомы которых в двухэлементных соединениях всегда связаны с одним атомом другого элемента. Примером одновалентного элемента является водород. Поэтому считается, что валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например: в HCl хлор-одновалентен, в H 2 O кислород-двухвалентен,в NH 3 азот-трёхвалентен.
Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается всегда двухвалентным.
Таблица постоянных валентностей.
H, Na, Li, K, Rb, Cs
O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
Используя валентности можно составить формулу соединения.
Химическая формула-это условная запись состава вещества посредством химических знаков и индексов.
Например: H 2 O-формула воды, где Н и О-химические знаки элементов, 2-индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его валентность, которая ставится в скобки. Например, Р 2 О 5 — оксид фосфора (V).
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н 2 О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Алгоритм составления формулы соединения В и О
Составление формулы оксида бора
1. Написать символы элементов
2. Определить валентности элементов
3. Найти наименьшее общее кратное численных значений валентностей
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
6 : 3 = 2, 6 : 2 = 3;
5. Записать индексы при символах элементов
6. Формула соединения (оксида)
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
- Используя знания, полученные на этом уроке, составьте формулы следующих веществ: фосфида кальция, оксида свинца (IV)
- Найдите соответствие между формулой вещества и его названием
Источник
Страница 17 из 80
Задание №1
Составьте формулы бинарных соединений металлов с двухвалентной серой − _ _ _ _ _ _ _ _ _ _ , рассчитайте их Mr и массовую долю металла:
а) лития _, Mr ( _ ) = _
ω(Li) = _ , или _%
б) бария _, Mr ( _ ) = _
ω(Ba) = _, или _%
в) алюминия _, Mr ( _ ) = _
ω(Al) = _, или _%
г) свинца (IV) _, Mr ( _ ) = _
ω(Pb) = _, или _%
Ответ:
Составьте формулы бинарных соединений металлов с двухвалентной серой − сульфидов, рассчитайте их Mr и массовую долю металла:
а) лития $Li_{2}S$, Mr ($Li_{2}S$) = 2 * 7 + 32 = 46
ω(Li) = 2 * 7 : 46 = 0,3043, или 30,43%
б) бария BaS, Mr (BaS) = 137 + 32 = 169
ω(Ba) = 137 : 169 = 0,81, или 81%
в) алюминия $Al_{2}S_{3}$, Mr ($Al_{2}S_{3}$) = 2 * 27 + 3 * 32 = 150
ω(Al) = 2 * 27 : 150 = 0,36, или 36%
г) свинца (IV) $PbS_{2}$, Mr ($PbS_{2}$) = 207 + 2 * 32 = 271
ω(Pb) = 207 : 271 = 0,76, или 76%
Задание №2
Составьте формулы бинарных соединений кислорода − _ _ _ _ _ _ _ , рассчитайте их Mr и массовую долю второго элемента:
а) меди (I) _, Mr ( _ ) = _
ω(Cu) = _, или _%
б) железа (II) _, Mr ( _ ) = _
ω(Fe) = _, или _%
в) серы (VI) _, Mr ( _ ) = _
ω(S) = _, или _%
г) азота (IV) _, Mr ( _ ) = _
ω(N) = _, или _%
Ответ:
Составьте формулы бинарных соединений кислорода − оксидов, рассчитайте их Mr и массовую долю второго элемента:
а) меди (I) $Cu_{2}O$, Mr ($Cu_{2}O$) = 2 * 64 + 16 = 144
ω(Cu) = 2 * 64 : 144 = 0,889 или 88,9%
б) железа (II) FeO, Mr (FeO) = 56 + 16 = 72
ω(Fe) = 56 : 76 = 0,778, или 77,8%
в) серы (VI) $SO_{3}$, Mr ($SO_{3}$) = 32 + 3 * 16 = 80
ω(S) = 32 : 80 = 0,4, или 40%
г) азота (IV) $NO_{2}$, Mr ($NO_{2}$) = 14 + 2 * 16 = 46
ω(N) = 14 : 46 = 0,3043, или 30,43%
Задание №3
Установите соответствие между названием бинарного соединения и валентностью образующих его элементов.
НАЗВАНИЕ БИНАРНОГО СОЕДИНЕНИЯ
1) Хлорид алюминия
2) Оксид калия
3) Сульфид алюминия
4) Фосфид кальция
↑↓
ВАЛЕНТНОСТЬ ЭЛЕМЕНТОВ
А) II и III
Б) III и I
В) III и II
Г) I и II
Ответ:
Ответ:
1) Хлорид алюминия − III и I
2) Оксид калия − I и II
3) Сульфид алюминия − III и II
4) Фосфид кальция − II и III
Ответ:
Задание №4
Составьте формулы силикатов − соединений металлов с двухвалентной группой атомов $SiO_{3}$:
а) силиката калия _
б) силиката кальция _
в) силиката железа (III) _
Ответ:
а) силиката калия $Na_{2}SiO_{3}$
б) силиката кальция $CaSiO_{3}$
в) силиката железа (III) $Fe_{2}(SiO_{3})_{3}$
Задание №5
Установите соответствие между названием бинарного соединения и его формулой.
НАЗВАНИЕ СОЕДИНЕНИЯ
1) Оксид азота (I)
2) Оксид азота (II)
3) Оксид азота (III)
4) Оксид азота (IV)
5) Оксид азота (V)
↓↑
ФОРМУЛА СОЕДИНЕНИЯ
А) $NO_{2}$
Б) $N_{2}O$
В) $N_{2}O_{3}$
Г) $N_{2}O_{5}$
Д) NO
Ответ:
| 1 | 2 | 3 | 4 | 5 |
Ответ:
1) Оксид азота (I) − $N_{2}O$
2) Оксид азота (II) − NO
3) Оксид азота (III) − $N_{2}O_{3}$
4) Оксид азота (IV) − $NO_{2}$
5) Оксид азота (V) − $N_{2}O_{5}$
Ответ:
| 1 | 2 | 3 | 4 | 5 |
| Б | Д | В | А | Г |
Авторы:
Год:2021
Тип:рабочая тетрадь
Нужно другое издание?
Страница 36
-
Название бинарных соединений:
FeCl3 – хлорид железа (III)
Al2S3 – сульфид алюминия
PbO2 – оксид свинца (IV)
Mn2O7 – оксид марганца (VII)
Fe2O3 – оксид железа (III)
Al4C3 – карбид алюминия
Для веществ молекулярного строения соблюдается закон постоянства состава веществ: независимо от способа получения вещества его состав остается постоянным.
ЧАСТЬ II
Формулы бинарных соединений металлов с двухвалентной серой – сульфидов:
Лития – 
Бария – 
Алюминия – 
Свинца – 
Формулы бинарных соединений кислорода – оксидов:
меди – 
железа – 
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.