Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 марта 2021 года; проверки требуют 4 правки.
| Фосфид натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
Фосфид натрия |
| Традиционные названия | Фосфористый натрий |
| Хим. формула | Na3P |
| Физические свойства | |
| Состояние | красные кристаллы |
| Молярная масса | 99,94 г/моль |
| Плотность | 1,74 г/см³ |
| Классификация | |
| Рег. номер CAS | 12058-85-4 |
| PubChem | 61547 |
| Рег. номер EINECS | 235-031-0 |
| SMILES |
[Na+].[Na+].[Na+].[PH6-3] |
| InChI |
InChI=1S/3Na.P/q3*+1;-3 FHHBFSHDCCEUKM-UHFFFAOYSA-N |
| ChemSpider | 55463 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фосфид натрия — бинарное неорганическое соединение металла натрия и фосфора с формулой Na3P, красные кристаллы, реагирует с водой. Из-за реакции с водой с выделением фосфина относится к ядовитым веществам, не допускать контакта фосфида натрия с водой и с влажным воздухом при хранении и транспортировке.
Получение[править | править код]
- Спекание натрия с элементарным фосфором в вакууме:
- Действуя жидким аммиаком на смесь металлического натрия с красным фосфором:
- с последующим разрушением аддукта:
Физические свойства[править | править код]
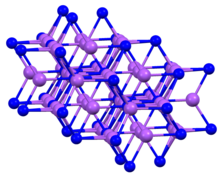
Фосфид натрия представляет собой красные кристаллы[1] гексагональной сингонии, пространственная группа P 63/mmc, параметры ячейки a = 0,4980 нм, c = 0,8797 нм, Z = 2.[2]
Химические свойства[править | править код]
- Реагирует с водой с образованием высокотоксичного газа – фосфина:
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Примечания[править | править код]
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — С. 86. — 561 с.
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — С. 477. — 1072 с.
Опубликовано 3 года назад по предмету
Химия
от ElviraYa
Напишите формулу фосфида натрия❤️
-
Ответ
Ответ дан
ZHASMIIIINФормула фосфида натрия: Na3P
-
Ответ
Ответ дан
zaka007Формула фосфида натрия: Na₃P
Самые новые вопросы
![]()
Другие предметы – 2 года назад
Сочинение-рассуждение. прочитайте текст. есть у меня внучка. однажды она говорит: — у веры в субботу день рождения. она
![]()
Другие предметы – 2 года назад
Л.н. толстой. как боролся русский богатырь как сказал иван о своей силе? найдите ответ в тексте. запишите.
![]()
История – 2 года назад
Кто такой мильтиад и какова его роль в победе над персами?
![]()
История – 2 года назад
Какие примеры н. м. карамзин использует для разъяснения пользы новой системы престолонаследия? согласны ли вы с позицией
![]()
География – 2 года назад
Дополните схему. она поможет вам лучше усвоить содержание §1.: 1 что изучает география 2 с помощью чего 3 зачем изучают
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
From Wikipedia, the free encyclopedia
|
|
| Names | |
|---|---|
| Other names
sodium phosphide, common |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.031.834 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na3P |
| Molar mass | 99.943 g/mol |
| Appearance | red crystals |
| Density | 1.74 g/cm3 |
| Melting point | 650 °C (1,202 °F; 923 K) |
|
Solubility in water |
hydrolysis |
| Solubility | insoluble in liquid CO2 |
| Structure | |
|
Crystal structure |
hexagonal a = 4.9512 Å c = 8.7874 Å |
|
Coordination geometry |
around P 5 near neighbours, trigonal bipyramid [1] |
| Related compounds | |
|
Other anions |
sodium chloride sodium nitride |
|
Other cations |
aluminium phosphide lithium phosphide potassium phosphide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium phosphide is the inorganic compound with the formula Na3P. It is a black solid. It is often described as Na+ salt of the P3− anion.[2] Na3P is a source of the highly reactive phosphide anion. It should not be confused with sodium phosphate, Na3PO4.
In addition to Na3P, five other binary compositions of sodium and phosphorus are known: NaP, Na3P7, Na3P11, NaP7, and NaP15.[3]
Structure and Properties[edit]
The compound crystallizes in a hexagonal motif, often called the sodium arsenide structure.[4] Like K3P, solid Na3P features pentacoordinate P centers.[1]
Preparation[edit]
The first preparation of Na3P was first reported in the mid-19th century. French researcher, Alexandre Baudrimont prepared sodium phosphide by treating molten sodium with phosphorus pentachloride.[5]
- 8 Na(l) + PCl5 → 5 NaCl + Na3P
Many different routes to Na3P have been described. Due to its flammability and toxicity, Na3P (and related salts) is often prepared and used in situ. White phosphorus is reduced by sodium-potassium alloy:[6]
- P4 + 12 Na → 4 Na3P
Phosphorus reacts with sodium in an autoclave at 150 °C for 5 hours to produce Na3P.[7]
Alternatively the reaction can be conducted at normal pressures but using a temperatures gradient to generate nonvolatile NaxP phases (x < 3) that then react further with sodium.[8] In some cases, an electron-transfer agent, such as naphthalene, is used. In such applications, the naphthalene forms the soluble sodium naphthalenide, which reduces the phosphorus.[9]
Uses[edit]
Sodium phosphide is a source of the highly reactive phosphide anion. The material is insoluble in all solvents but reacts as a slurry with acids and related electrophiles to give derivatives of the type PM3:[6]
- Na3P + 3 E+ → E3P (E = H, Me3Si)
The trimethylsilyl derivative is volatile (b.p. 30-35 C @ 0.001 mm Hg) and soluble. It serves as a soluble equivalent to “P3−“.
Indium phosphide, a semiconductor arises by treating in-situ generated “sodium phosphide” with indium(III) chloride in hot N,N’-dimethylformamide as solvent. In this process, the phosphide reagent is generated from sodium metal and white phosphorus, whereupon it immediately reacts with the indium salt:[10]
- Na3P + InCl3 → InP + 3NaCl
Sodium phosphide is also employed commercially as a catalyst in conjunction with zinc phosphide and aluminium phosphide for polymer production. When Na3P is removed from the ternary catalyst polymerization of propylene and 4-methyl-1-pentene is not effective.[11][citation needed]

polymerization of propene
Precautions[edit]
Sodium phosphide is highly dangerous releasing toxic phosphine upon hydrolysis, a process that is so exothermic that fires result. The USDOT has forbidden the transportation of Na3P on aircraft and trains due to the potential fire and toxic hazards.[12]
References[edit]
- ^ a b Dong, Y; Disalvo, F.J (2005). “Reinvestigation of Na3P based on single-crystal data”. Acta Crystallographica Section E. 61 (11): i223–i224. doi:10.1107/S1600536805031168.
- ^ Yunle, G; Fan, G; Yiate, Q; Huagui, Z; Ziping, Y (2002). “A solvothermal synthesis of ultra-fine iron phosphide”. Materials Research Bulletin. 37 (6): 1101–1106. doi:10.1016/S0025-5408(02)00749-3.
- ^ Inorganic Chemistry, Egon Wiberg, Arnold Frederick Holleman Elsevier 2001 ISBN 0-12-352651-5
- ^ Beister, H.J.; Syassen, K.; Klein, J.”Phase transition of Na3As under pressure” Zeitschrift für Naturforschung B: Chemical Sciences 1990, volume 45, p1388-p1392. doi:10.1515/znb-1990-1007
- ^ Baudrimont (1864). Annales de chimie et de physique. 2: 13.
- ^ a b Becker, Gerd; Schmidt, Helmut; Uhl, Gudrun (1990). Tris(trimethylsilyl)phosphine and Lithium Bis(Trimethylsilyl)Phosphide.Bis-(Tetrahydrofuran). Inorganic Syntheses. Vol. 27. pp. 243–249. doi:10.1002/9780470132586.ch48. ISBN 9780470132586.
- ^ Xie, Y; Su, H; Li, B; Qian, Y (2000). “Solvothermal preparation of tin phosphide nanorods”. Materials Research Bulletin. 35 (5): 675–680. doi:10.1016/S0025-5408(00)00263-4.
- ^ Jarvis, R. F.; Jacubinas, R. M.; Kaner, R. B. (2000). “Self-Propagating Metathesis Routes to Metastable Group 4 Phosphides”. Inorganic Chemistry. 39 (15): 3243–3246. doi:10.1021/ic000057m. PMID 11196860.
- ^ Peterson, D. J. 1967. US Patent No. 3,397,039.
- ^ Khanna, P.K; Eum, M.-S; Jun, K.-W; Baeg, J.-O; Seok, S. I (2003). “A novel synthesis of indium phosphide nanoparticles”. Materials Letters. 57 (30): 4617–4621. doi:10.1016/S0167-577X(03)00371-9.
- ^ Atarashi, Y.; Fukumoto, O. Japanese Patent No. JP 42,006,269.
- ^ Kenneth L Barbalace. “Sodium phosphide”. Chemical Database.
Фосфид натрия
Другие названия: Фосфористый натрий.
Фосфид натрия — бинарное неорганическое соединение металла натрия и фосфора с формулой Na3P. Получение:
- Спекание натрия с элементарным фосфором в вакууме:
- Действуя жидким аммиаком на смесь металлического натрия с красным фосфором:
- с последующим разрушением аддукта:
Фосфид натрия представляет собой красные кристаллы гексагональной сингонии, пространственная группа P 63/mmc, параметры ячейки a = 0,4980 нм, c = 0,8797 нм, Z = 2.
Химические свойства:
- Реагирует с водой:
Физические свойства
| Молярная масса | 99,943 г/моль |
Химические свойства и методы получения
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. – Мн.: Современная школа, 2005. – 608 с ISBN 985-6751-04-7. [c. 182]
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.




