Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 июля 2018 года; проверки требуют 35 правок.
|
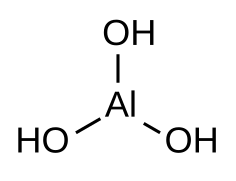
Гидроксид алюминия |
|
|---|---|
|
|
|
|
Общие |
|
| Хим. формула | AlH₃O₃ |
|
Классификация |
|
| Номер CAS | 21645-51-2 |
| PubChem | 10176082 |
| ChemSpider | 8351587 |
| Номер EINECS | 244-492-7 |
| RTECS | BD0940000 |
| ChEBI | 33130 |
| DrugBank | DB06723 |
|
SMILES |
|
|
[OH-].[OH-].[OH-].[Al+3] |
|
|
InChI |
|
|
InChI=1S/Al.3H2O/h;3*1H2/q+3;;;/p-3 |
|
|
Безопасность |
|
| ЛД50 | >5000 мг/кг (крысы, перорально) |
| NFPA 704 |
0 0 0 |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. |
Гидрокси́д алюми́ния — неорганическое соединение с химической формулой Al(OH)3. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами, слабый электролит.
Получение[править | править код]
Гидроксид алюминия получают при взаимодействии солей алюминия с аммиаком:
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
Физические свойства[править | править код]
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидраргиллит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства[править | править код]
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
- щелочами
- В растворе гидроксида натрия:
- При сплавлении твёрдых реагентов:
При нагревании разлагается:
С растворами аммиака не реагирует.
Применение[править | править код]
Гидроксид алюминия используется при очистке воды, так как обладает способностью абсорбировать различные вещества.
В медицине, в качестве антацидного средства[1], в качестве адъюванта при изготовлении вакцин[2].
В качестве абразивного компонента зубной пасты[3].
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов[4].
Примечания[править | править код]
- ↑ Гидроксид алюминия. Справочник лекарственных средств. Дата обращения: 28 февраля 2009. Архивировано из оригинала 2 сентября 2010 года.
- ↑ Ярилин А.А., Основы иммунологии: Учебник. — М.: Медицина, 1999. — С. 608. — ISBN 5-225-02755-5.
- ↑ Состав зубной пасты: изучаем информацию на тюбике. infozyb.com. Дата обращения: 27 октября 2018. Архивировано из оригинала 27 октября 2018 года.
- ↑ Касьянова Л.З., Каримов О.Х., Каримов Э.Х. Регулирование физико-химических свойств термоактивированного тригидрата алюминия // Башкирский химический журнал. 2014. Т. 21. № 3. С. 90-94..
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH)3 → 2KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Aluminic acid, Aluminic hydroxide, and aluminum (III) hydroxide are all names for aluminum hydroxide. It is the chemical term for aluminum, as are all other metal carbonates, sulfates, and hydroxides.
It may be found in nature as the mineral gibbsite and its polymorphs, such as doyleite, nordstrandite, and bayerite.
Aluminum Hydroxide formula
The chemical formula of aluminum hydroxide is Al(OH)3. Aluminic hydroxide is a white amorphous powder. It is water-insoluble but soluble in alkaline and acidic solutions. It can be used to treat stomach discomfort, acid indigestion, heartburn, and sour stomach. It can also be used to lower phosphate levels in persons who have renal difficulties. The antacid may also be useful for non-medical applications.
Structure of Aluminum Hydroxide
Aluminum hydroxide is an amphoteric chemical with the ability to behave as both an acid and a base. It occurs in acidic solutions as the aluminum ion, Al3+, and the hydroxide ion, OH–. It occurs in basic solutions such as the aluminum hydroxide ion, Al(OH)4-. The aluminum hydroxide ion has a tetrahedral structure with a bond angle of 116.5° between Al-O-Al. Aluminic hydroxide has the normal metal hydroxide structure with hydrogen bonding.
It is made up of two layers of hydroxyl groups and two layers of aluminum ions, which occupy two-thirds of the octahedral holes generated between the two layers.
Gibbsite is an amphoteric mineral that functions as a Bronsted-Lowry base to produce salt by absorbing hydrogen ions and neutralizing the acid. Here is the Reaction,
3HCl + Al(OH)3 → AlCl3 + 3H2O
In bases, it acts as a Lewis acid. It reduces the hydroxide ions of an electron pair. Another reaction is,
Al(OH)3 + OH– → Al(OH)4–
Preparation of Aluminum Hydroxide
The Bayer process is used to produce commercially used aluminum hydroxide. It is accomplished by dissolving bauxite in a sodium hydroxide solution at temperatures ranging from 0 to 270°C. After removing the trash, the sodium aluminate solution is allowed to precipitate. As a result, the precipitate formed is aluminum hydroxide.
Calcination can be used to produce alumina or aluminum oxide from aluminum hydroxide.
Bayer Process Reactions
- First: Al2O3.2H2O + 2 NaOH → 2 NaAlO2 + 3 H2O
- Second: NaAlO2 + 2 H2O → Al(OH)3 + NaOH
- Third: 2 Al(OH)3 → Al2O3 + 3 H2O
Physical Properties of Aluminum Hydroxide
The following are the physical characteristics of aluminum hydroxide,
- Aluminum hydroxide occurs in the form of a white amorphous powder.
- Aluminum hydroxide has a melting point of around 573K.
- Aluminum hydroxide is insoluble in water but soluble in alkalis and acids.
- Solid aluminum hydroxide has a density of around 2.42g/cm3.
Chemical Properties of aluminum Hydroxide
- Aluminum hydroxide is an amphoteric substance.
- It may function as both an acid and a base.
- Aluminum hydroxide behaves as a Bronsted–Lowry base in acids.
- As a result, it neutralizes the acid-forming salt and water that are the end results.
Uses of Aluminum Hydroxide
- Aluminum hydroxide offers several benefits, including large-scale manufacturing, sufficient raw resources, excellent product purity, and good acid solubility. As a result, aluminum hydroxide may be employed as a key raw material in the production of aluminum salts such as barium aluminate, aluminum sulfate, and others.
- Because of its filling, flame retardant, smoke-eliminating properties, and non-toxicity, aluminum hydroxide powder is widely recognized as a suitable flame retardant filler for plastics, unsaturated polyester, rubber, and other organic polymers. The flame retardant mechanism of aluminum hydroxide is as follows: when the temperature is above 200°C, the aluminum hydroxide begins to conduct endothermic breakdown and releases three crystal water, and its decomposition rate reaches its maximum at 250°C.
- Aluminum hydroxide may be converted into alumina, a material with good thermal chemical stability, thermal strength, creep resistance, dielectric characteristics, and a low thermal expansion coefficient. Alumina is a critical ingredient in the production of ceramics.
We can regulate the phase development of the composite during the ceramic synthesis process by activating aluminum hydroxide and managing the crystallization process. - Aluminum hydroxide occurs in water mostly in the form of Al(OH)4–, which may precipitate hazardous heavy metals in sewage using the coprecipitation technique to accomplish water purification after additional filtering. Aluminum hydroxide has a large specific surface area and may adsorb colloid, suspended particles, colors, and organic compounds from sewage.
- Aluminum hydroxide has the ability to neutralize gastric acid and is non-toxic, which is why it is constantly employed as a traditional medication for stomach therapy.
The use of aluminum hydroxide as an adjuvant can also boost the immunogenicity of the vaccine. The mechanism of action is as follows: aluminum hydroxide adsorbs antigen on its surface, allowing the antigen to be released slowly, hence extending effectiveness. - By controlling the temperature, concentration, and pH of the reactants, we can obtain a variety of target products with varying surface area, pore-volume, pore structure, and crystal structure, which can be effectively used as a catalyst carrier for the hydrogenation of unsaturated carbonyl compounds and the preparation of fullerenes and other similar compounds.
- Aluminum hydroxide has a high whiteness, ultrafine particle size, and full crystal shape, and it is very compatible with brighteners. Aluminum hydroxide, as an additional coating and resin, may significantly increase coated paper’s whiteness, opacity, smoothness, and ink absorption.
Sample Questions
Question 1: What is the function of aluminum hydroxide?
Answer:
Aluminum is a naturally occurring metal. aluminum hydroxide is the antacid. aluminum hydroxide is used to treat heartburn, stomach discomfort, aching stomach, and acid indigestion. aluminum hydroxide is also used to lower phosphate levels in persons with various renal diseases.
Question 2: Explain the importance of Aluminum Hydroxide gel?
Answer:
Aluminum Hydroxide gel is an amorphous Aluminum Hydroxide suspension. Partially carbon replacements are present in the mineral gel form. Glycerin, peppermint oil, saccharin, sucrose, and sorbitol, among other ingredients, may be present in the gel form. Different antibacterial components can also be present in appropriate concentrations in the gel. It is primarily used to treat symptoms caused by an excess of stomach acid, such as heartburn, acid indigestion, and stomach distress. It works better than pills or capsules. Precipitation of ethanolic solutions of aluminum chloride results in the formation of the gel and Primary amines, such as octylamine, propylamine, and dodecylamine, are also present.
These act as proton acceptors during hydrolysis, allowing precipitation to occur.
Question 3: Is it safe to use aluminum hydroxide in cosmetics?
Answer:
Hydroxide in aluminum is the artificial substance that functions as an opacifier. Agent and absorbent for painting are two of the most common applications. There is no evidence that aluminum hydroxide is harmful to the skin.
Question 4: Is aluminum hydroxide harmful?
Answer:
Aluminum hydroxide side effects include severe stomach pain or constipation, a loss of appetite, difficulty when peeing, muscular weakness, weariness, and excessive sleepiness.
Question 5: Is alkali hydroxide a weak base?
Answer:
As a chemical compound, aluminum hydroxide has the molecular formula Al(OH)3…. In aluminum hydroxide, for example, the hydroxide (OH) can function as a weak base when interacting with the strong acid, hydrochloric acid (HCl). A weak base is one that partially dissociates or breaks away in solution.
Question 6: What causes aluminum hydroxide to be an acid?
Answer:
Aluminum hydroxide is insoluble in water and can only be dissolved in bases and acids. Aluminum hydroxide is expected to serve as an amphoteric material in water.
Aluminum hydroxide will operate as an acid if a strong base is present.
Question 7: What causes phosphate deficit in aluminum hydroxide?
Answer:
Aluminum hydroxide may induce phosphorus deficit in people with low phosphorus diets by interacting with phosphates to generate insoluble aluminum phosphate.
Last Updated :
23 May, 2022
Like Article
Save Article
Гидроксид алюминия, характеристика, свойства и получение, химические реакции.
Гидроксид алюминия – неорганическое вещество, имеет химическую формулу Al(OH)3.
Краткая характеристика гидроксида алюминия
Модификации гидроксида алюминия
Физические свойства гидроксида алюминия
Получение гидроксида алюминия
Химические свойства гидроксида алюминия
Химические реакции гидроксида алюминия
Применение и использование гидроксида алюминия
Краткая характеристика гидроксида алюминия:
Гидроксид алюминия – неорганическое вещество белого цвета.
Химическая формула гидроксида алюминия Al(OH)3.
Плохо растворяется в воде.
Обладает способностью адсорбировать различные вещества.
Модификации гидроксида алюминия:
Известны 4 кристаллические модификации гидроксида алюминия: гиббсит, байерит, дойлеит и нордстрандит.
Гиббсит обозначается γ-формой гидроксида алюминия, а байерит – α-формой гидроксида алюминия.
Гиббсит является наиболее химически стабильной формой гидроксида алюминия.
Физические свойства гидроксида алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al(OH)3 |
| Синонимы и названия иностранном языке для гидроксида алюминия α-формы | aluminum hydroxide α-form (англ.)
байерит (рус.) |
| Синонимы и названия иностранном языке для гидроксида алюминия γ-формы | aluminium hydroxide (англ.)
aluminum hydroxide (англ.) гиббсит (рус.) |
| Синонимы и названия иностранном языке для гидроксида алюминия γ’-формы | hydrargillite (англ.)
гидраргиллит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид гидроксида алюминия α-формы | белые гексагональные кристаллы |
| Внешний вид гидроксида алюминия γ-формы | белые моноклинные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность гидроксида алюминия γ-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2420 |
| Плотность гидроксида алюминия γ-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,42 |
| Температура разложения гидроксида алюминия, °C | 150-200 °C, > 575 °C |
| Молярная масса, г/моль | 78,004 |
* Примечание:
— нет данных.
Получение гидроксида алюминия:
Гидроксид алюминия получают в результате следующих химических реакций:
- 1. в результате взаимодействия хлорида алюминия и гидроксида натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка.
- 2. в результате взаимодействия хлорида алюминия, карбоната натрия и воды:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 6NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии водорастворимых солей алюминия с карбонатами щелочных металлов.
Химические свойства гидроксида алюминия. Химические реакции гидроксида алюминия:
Гидроксид алюминия обладает амфотерными свойствами, т. е. обладает как основными, так и кислотными свойствами.
Химические свойства гидроксида алюминия аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида алюминия с гидроксидом натрия:
Al(OH)3 + NaOH → NaAlO2 + 2H2O (t ≈ 1000 °C),
Al(OH)3 + 3NaOH → Na3[Al(OH)6],
Al(OH)3 + NaOH → Na[Al(OH)4].
В результате реакции образуются в первом случае – алюминат натрия и вода, во втором – гексагидроксоалюминат натрия, в третьем – тетрагидроксоалюминат натрия. В третьем случае в качестве исходного вещества гидроксид натрия используется в виде концентрированного раствора.
2. реакция гидроксида алюминия с гидроксидом калия:
Al(OH)3 + KOH → KAlO2 + 2H2O (t ≈ 1000 °C),
Al(OH)3 + KOH → K[Al(OH)4].
В результате реакции образуются в первом случае – алюминат калия и вода, во втором – тетрагидроксоалюминат калия. Во втором случае в качестве исходного вещества гидроксид калия используется в виде концентрированного раствора.
3. реакция гидроксида алюминия с азотной кислотой:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O.
В результате реакции образуются нитрат алюминия и вода.
Аналогично проходят реакции гидроксида алюминия и с другими кислотами.
4. реакция гидроксида алюминия с фтороводородом:
Al(OH)3 + 3HF → AlF3 + 3H2O,
6HF + Al(OH)3 → H3[AlF6] + 3H2O.
В результате реакции образуются в первом случае – фторид алюминия и вода, во втором – гексафтороалюминат водорода и вода. При этом фтороводород в первом случае в качестве исходного вещества используется в виде раствора.
5. реакция гидроксида алюминия с бромоводородом:
Al(OH)3 + 3HBr → AlBr3 + 3H2O.
В результате реакции образуются бромид алюминия и вода.
6. реакция гидроксида алюминия с йодоводородом:
Al(OH)3 + 3HI → AlI3 + 3H2O.
В результате реакции образуются йодид алюминия и вода.
7. реакция термического разложения гидроксида алюминия:
Al(OH)3 → AlO(OH) + H2O (t = 150-200 °C),
2Al(OH)3 → Al2O3 + 3H2O (t > 575 °C).
В результате реакции образуются в первом случае – метагидроксид алюминия и вода, во втором – оксид алюминия и вода.
8. реакция гидроксида алюминия и карбоната натрия:
2Al(OH)3 + Na2CO3 → 2NaAlO2 + CO2 + 3H2O.
В результате реакции образуются алюминат натрия, оксид углерода (IV) и вода.
10. реакция гидроксида алюминия и гидроксида кальция:
Ca(OH)2 + 2Al(OH)3 → Ca[Al(OH)4]2.
В результате реакции образуется тетрагидроксоалюмината кальция.
Применение и использование гидроксида алюминия:
Гидроксид алюминия используется при очистке воды (как адсорбирующее вещество), в медицине, в качестве наполнителя в зубной пасте (как абразивное вещество), пластиках и пластмассах (как антипирен).
Примечание: © Фото //www.pexels.com, //pixabay.com
гидроксид алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения реакции масса взаимодействие гидроксида
Коэффициент востребованности
13 141
|
Гидроксид алюминия |
|
|---|---|
| Хим. формула | AlH₃O₃ |
| Номер CAS | 21645-51-2 |
| PubChem | 10176082 |
| ChemSpider | 8351587 |
| Номер EINECS | 244-492-7 |
| RTECS | BD0940000 |
| ChEBI | 33130 |
| DrugBank | DB06723 |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. |

Гидроксид алюминия — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Безопасность
- 4.1 ЛД50
- 5 Применение
Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3 + 3 NaOH ⟶ Al(OH)3 ↓ + 3 NaCl
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
-
- 2 AlCl3 + 3 Na2CO3 + 3 H2O → 2 Al(OH)3 ↓ + 6 NaCl + 3 CO2
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
- Al(OH)3 + 3 HCl ⟶ AlCl3 + 3 H2O
- Al(OH)3 + 3 HNO3 ⟶ Al(NO3)3 + 3 H2O
- щелочами
- В концентрированном растворе гидроксида натрия:
- Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
- При сплавлении твёрдых реагентов:
- Al(OH)3 + NaOH →1000oC NaAlO2 + 2 H2O
При нагревании разлагается:
-
- 2 Al(OH)3 →t>575oC Al2O3 + 3 H2O
С растворами аммиака не реагирует.
Безопасность
ЛД50
>5000 мг/кг (крысы, перорально).
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества.
В медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин.
В качестве абразивного компонента зубной пасты.
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов.






![{displaystyle {mathsf {Al(OH)_{3}+NaOH+2H_{2}Olongrightarrow Na[Al(OH)_{4}(H_{2}O)_{2}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afddc039b56bc740619e06541bfdb3c0c6df67c4)



