Сегодня поговорим об очень большой группе соединений, которые называются гидроксиды. Как говорит учебник химии,
гидроксид – это химическое соединение, в котором есть группа –ОН.
Собственно, именно по этому признаку и можно определить, что перед нами гидроксид: в нём всегда есть одна или несколько гидроксильных групп –ОН.
Также запомните, что есть понятие «щёлочь». К щелочам относят гидроксиды металлов щелочных (то есть стоящих в первой группе таблицы Менделеева в основной подгруппе), щёлочноземельных (то есть стоящих во второй группе таблицы Менделеева в основной подгруппе) и аммония NH4+.
В чём разница между гидроксидами и щелочами
Щёлочь – понятие более узкое, гидроксид – более широкое. То есть щёлочь – всегда гидроксид, но гидроксид – не всегда щёлочь.
Например, гидроксид натрия NaOH. Натрий находится в первой группе периодической таблицы, это щелочной металл. Поэтому NaOH – это щёлочь. Но если вы назовёте его гидроксидом, ошибкой это не будет.
Другой пример. Гидроксид меди (II) Сu(OH)2 – это гидроксид, но никак не щёлочь (посмотрите в таблицу Менделеева. Медь находится в первой группе, но не в основной, а в побочной! Медь – не щелочной металл!). То есть назвать Сu(OH)2 щёлочью будет ошибкой, это гидроксид.
Как составить формулу гидроксида
Первым делом вспоминаем про валентность, без неё в химии никуда. Далее нужно понять, что группа ОН – это цельная структурная единица. Составляя формулу, мы всегда заключаем её в скобки (если ОН группа одна, то скобки не нужны), а индекс, маленькая цифра внизу справа, относится ко всей гидроксильной группе.
Также сразу запомните, что
группа –ОН всегда имеет валентность I.
Чтобы этот факт навсегда врезался вам в память, запомните следующее. Группа –ОН образуется из воды. Формула воды Н2О, это всем известно. Выглядит молекула воды так: Н-О-Н. То есть в ней две части Н– и –ОН. Каждая из этих частей имеет валентность I, это видно и из формулы:
Нам здесь важно, что гидроксильная группа имеет валентность I. Это надо запомнить.
Теперь переходим к практике и решению химии.
Пример 1.
Составьте формулу гидроксида калия.
Это очень просто. Калий в таблице Менделеева находится в первой группе в основной подгруппе, он имеет валентность I. Группа –ОН также имеет валентность I. Следовательно, формула гидроксида калия КОН.
Пример 2.
Составьте формулу гидроксида кальция.
Кальций находится в периодической таблице во второй группе в основной подгруппе, его валентность II. Тогда:
Здесь надо припомнить, как составляется формула вещества, если известна валентность. Нужно, чтобы произведение валентности и индекса у каждого элемента совпадало. Поэтому формула гидроксида кальция выглядит так:
Напоминаю, что если гидроксильных групп больше одной, то мы из заключаем в скобки. Обратите внимание, что такое написание (ОН)2 означает, что в формуле не два атома водорода, а две группы ОН!
Итак, формула гидроксида кальция – Ca(ОН)2.
Пример 3.
Составьте формулу гидроксида железа (III).
Валентность железа задана условиями, поэтому:
Отсюда следует:
Таким образом, формула гидроксида железа (III) – Fe(OH)3.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
| Гидроксид калия | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Гидроксид калия |
| Традиционные названия |
Гидроксид калия, кали едкое[1], каустический поташ, едкий калий |
| Хим. формула | |
| Рац. формула | KOH |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 56,1056 г/моль |
| Плотность | 2,044 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 405 °C |
| • кипения | 1325 °C |
| Энтальпия | |
| • образования | −425,8 кДж/моль |
| • плавления | 7,5 кДж/моль |
| • кипения | 128,9 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст.[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | 107 г / 100 мл (15 °C) |
| • в спирте | 38,7 (28 °C) |
| Оптические свойства | |
| Показатель преломления | 1.409 |
| Классификация | |
| Рег. номер CAS | 1310-58-3 |
| PubChem | 14797 |
| Рег. номер EINECS | 215-181-3 |
| SMILES |
[K+].[OH-] |
| InChI |
InChI=1S/K.H2O/h;1H2/q+1;/p-1 KWYUFKZDYYNOTN-UHFFFAOYSA-M |
| Кодекс Алиментариус | E525 |
| RTECS | TT2100000 |
| ChEBI | 32035 |
| Номер ООН | 1813 |
| ChemSpider | 14113 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ |
| ЛД50 | 149,92 мг/кг |
| Токсичность | ирритант, высокотоксичен |
| Пиктограммы СГС |
|
| NFPA 704 |
0 3 0 ALK |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокси́д ка́лия (лат. Kalii hydroxidum) — неорганическое соединение с химической формулой KOH. Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов хлорида калия (KCl), применяют в производстве жидких мыльных средств, для получения различных соединений калия.
Тривиальные названия: едкое кали[1], каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь[3], калиевый щёлок.
Физические свойства[править | править код]
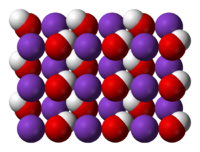
Имеет вид бесцветных кристаллов. Может находиться в двух различных модификациях: моноклинной, устойчивой до 247 °C и кубической, аналогичной таковой у хлорида натрия (a = 0,533 нм, z = 4, пространственная группа Fm3m). Температура плавления 405 °C, кипения 1325 °C, плотность 2,044 г/см3. Растворим в воде — 107 г / 100 мл (15 °C)[4][5].
Химические свойства[править | править код]
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с кислотными оксидами с образованием соли и воды:
- Взаимодействие с некоторыми непереходными металлами в растворе с образованием комплексной соли и водорода:
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что даёт продукт высокой чистоты, не содержащий примеси хлоридов:
Электролиз расплава протекает по следующему уравнению:
Именно так впервые были получены чистые натрий и калий британским химиком Г. Дэви.
Применение[править | править код]
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы, в которых он используется:
- нейтрализация кислот,
- щелочные элементы,
- катализ
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- переработка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук[3].
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами, расщепляется и омыливает при этом масла.
В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей (наряду с гидроксидом натрия). Гидроксид калия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Также применяется в ресомации — альтернативном способе «захоронения» тел.
5 % раствор гидроксида калия используется в медицине для лечения бородавок[6].
В фотографии используется, как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов[7].
Производство[править | править код]
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
- электролиз с твёрдым асбестовым катодом (диафрагменный метод производства),
- электролиз с полимерным катодом (мембранный метод производства),
- электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым лёгким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути. Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
- исключается стадия сжижения и испарения хлора,
- водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется мембранным (ООО «Сода-Хлорат») методом.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду. Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется. При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году[3].
Меры предосторожности при обращении с гидроксидом калия[править | править код]

Гидроксид калия — едкое, токсичное вещество, обладающее ярко выраженными щелочными свойствами. По степени воздействия на человеческий организм оно относится к веществам 2-го класса опасности. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасным считается попадание (больших) частиц гидроксида калия в глаза. Поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и другие материалы органического происхождения.
Предельно допустимая концентрация аэрозоля гидроксида калия в воздухе рабочих помещений составляет 0,5 мг/м3 в соответствии с ГОСТ 12.1.007-76.
Гидроксид калия не горюч, пожаро- и взрывобезопасен.
См. также[править | править код]
- Щёлочи
- Пищевые добавки
Примечания[править | править код]
- ↑ 1 2 Кали едкое — статья из Большой советской энциклопедии.
- ↑ http://www.cdc.gov/niosh/npg/npgd0523.html
- ↑ 1 2 3 ГИДРОКСИД КАЛИЯ: свойства и применение. newchemistry.ru. Дата обращения: 13 мая 2016. Архивировано 4 июня 2016 года.
- ↑ Степин, 1990.
- ↑ Зимина, 2008.
- ↑ Сравнительное исследование эффективности 5% раствора гидроксида калия и криотерапии в лечении генитальных бородавок &124; Дерматология в России. www.dermatology.ru. Дата обращения: 13 мая 2016. Архивировано 28 августа 2016 года.
- ↑ Гурлев, 1988, с. 288.
Литература[править | править код]
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Степин Б. Д. Калия гидроксид // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 287. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Ссылки[править | править код]
- КА́ЛИЯ ГИДРОКСИ́Д : [арх. 3 января 2023] / Г. В. Зимина // Исландия — Канцеляризмы. — М. : Большая российская энциклопедия, 2008. — С. 525. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 12). — ISBN 978-5-85270-343-9.
Определение и формула
Неорганическое соединение.
Альтернативное название
Едкое кали, калия гидроокись
Формула
KOHKOH
Свойства гидроксида калия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Белая гигроскопичная масса |
| Молярная масса | 56,11 г/моль |
| Плотность | при 25°С – 2,044 г/см3 |
| Температура плавления | 405°C |
| Температура кипения | 1325°C |
Химические свойства
В водном растворе диссоциирует на ионы:
KOH⟶OH−+K+KOH longrightarrow OH^- + K^+
Среда раствора сильно щелочная.
При взаимодействии с кислотами происходит нейтрализация:
2KOH+H2SO4=2H2O+K2SO42KOH + H_2SO_4 =2H_2O + K_2SO_4
Гидроксид калия вступает в реакции обмена с образованием нерастворимых гидроксидов или оксидов:
2KOH+2AgNO3=Ag2O↓+H2O+2KNO32KOH + 2AgNO_3 = Ag_2O↓ + H_2O + 2KNO_3,
2KOH+FeCl3=Fe(OH)3↓+3KCl2KOH + FeCl_3 = Fe(OH)_3↓ + 3KCl
Расплавленный KOHKOH реагирует с BeBe, AlAl, GaGa, ZnZn, SnSn, PbPb, SbSb и их оксидами и гидроксидами с образованием солей (напр., KAlO2KAlO_2, K2ZnO2K_2ZnO_2) и выделением соответственно H2H_2 или H2OH_2O:
2KOH+Sn=K2SnO2+H2↑2KOH + Sn = K_2SnO_2 + H_2↑,
2KOH+Al2O3=2KAlO2+H2O2KOH + Al_2O_3 = 2KAlO_2 + H_2O,
2KOH+Be(OH)2=K2BeO2+2H2O2KOH + Be(OH)_2 = K_2BeO_2 + 2H_2O.
В водных растворах образуются гидроксокомплексы:
2KOH+Sn+2H2O=K2[Sn(OH)4]+H2↑2KOH + Sn + 2H_2O = K2[Sn(OH)4] + H2↑,
2KOH+Al2O3+2H2O=2K[Al(OH)4]2KOH + Al_2O_3 + 2H_2O = 2K[Al(OH)_4],
2KOH+Be(OH)2=K2[Be(OH)4]2KOH + Be(OH)_2 = K_2[Be(OH)_4].
Водные растворы KOHKOH и его расплав взаимодействует с BB, SiSi, GeGe и их оксидами и кислотами с образованием соотв. KBO2KBO_2, K[B(OH)4]K[B(OH)_4], K2B4O7K_2B_4O_7, полисиликатов и полигерманатов:
2KOH+2B=2KBO2+H2↑2KOH + 2B = 2KBO_2 + H_2↑ (расплав);
2KOH+B+2H2O=K2[B(OH)4].+H2↑2KOH + B + 2H_2O= K_2[B(OH)_4]. + H_2↑ (водный р-р);
2KOH+2SiO2=K2Si2O5+H2O2KOH + 2SiO_2 = K_2Si_2O_5 + H_2O (водный р-р).
При взаимодействии с углекислым и сернистым газом образуются гидрокарбонаты и гидросульфиты:
KOH+CO2=KHCO3KOH + CO_2 =KHCO_3,
KOH+SO2=KHSO3KOH + SO_2 = KHSO_3.
При взаимодействии с диоксидом азота образуется смесь нитрита и нитрата калия:
KOH+2NO2=KNO2+KNO3+H2OKOH + 2NO_2 = KNO_2 + KNO_3 + H_2O.
При взаимодействии с угарным газом образуется формиат калия:
KOH+CO=HCOOKKOH + CO = HCOOK
Определить присутствие ионов калия можно по фиолетовому окрашиванию пламени, правда, обычно перебивает цвет всегда присутствующий рядом натрий. Тогда пламя нужно рассматривать через синий светофильтр.
Получение
Получение в лаборатории
Гидроксид калия в лаборатории получают пропусканием раствора сульфата калия через анионит или взаимодействием раствора поташа K2CO3K_2CO_3 и известковой воды Ca(OH)2Ca(OH)_2:
K2CO3+Ca(OH)2=CaCO3↓+2KOHK_2CO_3 + Ca(OH)_2 = CaCO_3↓ + 2KOH.
Получение в промышленности
Калия гидроксид получают электролизом водных растворов KClKCl или K2CO3K_2CO_3 с железным катодом:
KCl+H2O=KOH+HCl.KCl + H_2O = KOH + HCl.
Также его производят взаимодействием раствора поташа K2CO3K_2CO_3 и известковой воды Ca(OH)2Ca(OH)_2:
K2CO3+Ca(OH)2=CaCO3↓+2KOHK_2CO_3 + Ca(OH)_2 = CaCO_3↓ + 2KOH
Применение
Гидроксид калия применяют:
● для производства жидкого мыла и соединений калия;
● для очистки газов от COCO, CO2CO_2, SO2SO_2, NO2NO_2, H2SH_2S;
● для осушения NH3NH_3, PH3PH_3, N2ON_2O;
● в щелочных аккумуляторах.
Пример решения задачи
Сколько водорода выделится при растворении избытка цинка в 1 л 50% раствора гидроксида калия (ρ=1,516rho=1,516 г/см3)?
Решение
Вес раствора
mp=ρV=1,516⋅1000=1516m_p= rho V =1,516cdot1000 =1516 г.
Вес KOHKOH
mKOH=1516⋅50%/100%=758m_{KOH}=1516cdot50%/100% =758 г
758758 гtext{г} — xx лtext{л}
2KOH+Zn+2H2O=K2[Zn(OH)4]+H2↑2KOH + Zn + 2H_2O = K_2[Zn(OH)_4] + H_2↑
2 моля — 1 моль
2⋅56,112cdot56,11 гtext{г} — 22,422,4 лtext{л}
112,22112,22 гtext{г} — 22,422,4 лtext{л}
Составляем пропорцию:
112,22112,22 гtext{г} KOHKOH — 22,422,4 лtext{л} H2H_2,
758758 гtext{г} KOHKOH — xx лtext{л} H2H_2.
Отсюда
x=758∗22,4112,22=567x=frac{758ast22,4}{112,22} = 567 г.
1 моль KOHKOH – 74,55574,555 гtext{г},
xx молей KOHKOH – 567567 гtext{г}.
Отсюда
x=567∗174,555=151,3x=frac{567ast1}{74,555} = 151,3 л.
Ответ: 151,3151,3 л.text{л}.
Тест по теме «Гидроксид калия»
Физические свойства
Гидроксид калия KOH — неорганическое соединение. Белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 56,11; относительная плотность для тв. и ж. состояния d = 2, 044; tпл = 404º C; tкип = 1324º C
Способы получения
1. Гидроксид калия получают электролизом раствора хлорида калия:
2KCl + 2H2O → 2KOH + H2 + Cl2
2. При взаимодействии калия, оксида калия, гидрида калия и пероксида калия с водой также образуется гидроксид калия:
2K + 2H2O → 2KOH + H2
K2O + H2O → 2KOH
2KH + 2H2O → 2KOH + H2
K2O2 + H2O → 2KOH + H2O2
3. Карбонат калия при взаимодействии с гидроксидом кальция образует гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Качественная реакция
Качественная реакция на гидроксид калия — окрашивание фенолфталеина в малиновый цвет.
Химические свойства
1. Гидроксид калия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксид калия реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2KOH(избыток) + CO2 → K2CO3 + H2O
KOH + CO2 (избыток) → KHCO3
3. Гидроксид калия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2KOH + Al2O3 → 2KAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2KOH + Al2O3 + 3H2O → 2K[Al(OH)4]
4. С кислыми солями гидроксид калия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
KOH + KHCO3 → K2CO3 + H2O
5. Гидроксид калия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и выделяется водород:
2KOH + Si + H2O → K2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4KOH + 2F2 → 4KF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида калия:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с гидроксидом калия только при нагревании:
6KOH + 3S = 2K2S + K2SO3 + 3H2O
6. Гидроксид калия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2KOH + 2Al + 6Н2О = 2K[Al(OH)4] + 3Н2
7. Гидроксид калия вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом калия с образованием хлорида калия и осадка гидроксида меди (II):
2KOH + CuCl2 = Cu(OH)2↓+ 2KCl
Также с гидроксидом калия взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида калия образуются хлорид калия, аммиак и вода:
NH4Cl + KOH = NH3 + H2O + KCl
8. Гидроксид калия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
KOH ↔ K+ + OH—
9. Гидроксид калия в расплаве подвергается электролизу. При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4KOH → 4K + O2 + 2H2O
Potassium (K) is a chemical element. and its atomic number is 19. Potassium is a silvery-white metal that is soft enough to be cut with a knife with little force. Potassium metal reacts rapidly with atmospheric oxygen to form flaky white potassium peroxide in only seconds of exposure.
Hydroxide is a diatomic anion with substance recipe OH⁻. It comprises an oxygen and hydrogen molecule kept intact by a solitary covalent bond and conveys a negative electric charge. It is a significant yet typically minor constituent of water. Its capacities as a base, a ligand, a nucleophile, and a catalyst.
Potassium hydroxide
Potassium hydroxide is an inorganic compound with the equation KOH and is normally called acidic potash. Alongside sodium hydroxide (NaOH), KOH is a strong solid base. It has numerous modern and specialty applications, a large portion of which exploit its burning nature and its reactivity toward acids.
The formula of Potassium Hydroxide
The chemical equation for the component potassium hydroxide is KOH. In addition, the Molar Mass of the Potassium Hydroxide is 56.11 g/mol. KOH contains an ionic bond that is between the potassium metal cation and the hydroxyl anion.
Moreover, The strong KOH is available in a rhombohedral translucent design. This design is much like that of sodium chloride.
K + OH ⇢ KOH
Structure of Potassium Hydroxide
The structure of Potassium Hydroxide is,
At hot temperatures, the strong KOH takes shape as NaCl crystalline structure. OH, the group is either arbitrarily or quickly disarranged. This happens so the OH-bunch is actually a round shape anion that has a radius of 1.53 An and it is among Cl and F in size.
At room temperature, it arranges the OH–group and the climate about K+ focuses are contorted. With the K+OH–distances having a scope of 2.69 to 3.15 A, it relies upon the direction of the OH group. KOH produces a progression of translucent hydrates. In particular the monohydrate KOH. H2O, the dry-out KOH. 2H2O and tetra-hydrate KOH. 4H2O.
Properties of Potassium Hydroxide
Potassium hydroxide is accessible as the clear pellets. These become cheap in the air in light of the fact that the KOH is hygroscopic. Thus, KOH ordinarily comprises shifting measures of water for example H2O. Moreover, its disintegration in the water (H2O) is incredibly exothermic. Alongside this, the concentrated watery arrangements are ordinarily known as potassium lye. Indeed, even at the overabundance of temperatures. The strong KOH doesn’t promptly dry out.
Preparation and Purification of Potassium Hydroxide
The preparation of potassium hydroxide consists of the electrolysis of the potassium chloride solutions. This process is done by the chloralkali process. This happens with chlorine gas as a by-product:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2.
Uses of Potassium Hydroxide
- Preparation of salts: It is unequivocally antacid. The potassium hydroxide responds with numerous acids. Moreover, this corrosive base response comes being used for delivering the potassium salts. These salts, thus, have various different applications.
- Neutralization of Acids: It is used as a soluble base, we use potassium hydroxide for killing causticity and changing the pH of Solutions. Moreover, in the compound examination, it is a significant and important specialist for the titration of the acids for deciding their fixation.
- Creation of Soaps: The response cycle of the potassium hydroxide with the oils and fats under warming circumstances is an interaction we call saponification. Likewise, this response is valuable for delivering potassium cleansers.
- Used For manufacturing of liquid fertilizers.
Sample Questions
Question 1: How is potassium hydroxide made?
Answer:
Potassium hydroxide is made by the electrolysis of an aqueous solution of potassium chloride (KCl). In this process, an electric current decomposes potassium chloride into potassium and chlorine. The chlorine escapes as a gaseous by-product and the potassium reacts with water to form potassium hydroxide.
Question 2: What is lye powder?
Answer:
Lye” refers to sodium hydroxide ( ), but historically has been used for potassium hydroxide ( ). Nowadays, lye is commercially manufactured using a membrane cell chloralkali process. It is supplied in various forms such as flakes, pellets, microbeads, coarse powder or a solution.
Question 3: What is potassium hydroxide used for?
Answer:
Potassium hydroxide, or caustic potash, is used in many of industries. Potassium carbonate, potassium phosphates, liquid fertilizers, and potassium soaps and detergents are the main uses.
Question 4: What is the common name of potassium hydroxide?
Answer:
Potassium hydroxide is commonly known as caustic potash. Potassium hydroxide solution (KOH aqueous) is a colorless inorganic liquid that acts as a strong base (alkali). KOH solution is also known as caustic potash or potash lye and has many different applications.
Question 5: What are the dangers of using Potassium hydroxide?
Answer:
Exposure to Potassium hydroxide can cause heavy eye burn, redness, or even swelling. Exposure for a long time can have severe effects, even causing blindness. It is suggested to not be in repeated contact with the compound.
Last Updated :
07 Jul, 2022
Like Article
Save Article





![{displaystyle {ce {2Al + 2KOH + 6H2O -> 2K [Al(OH)4] + 3H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88f5f47b5448e9e9bfcdb6edafcf5dbe32a4d0b9)



