Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 октября 2021 года; проверки требуют 7 правок.
| Гидроксид лития | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Гидроксид лития | |
| Хим. формула | LiOH | |
| Рац. формула | LiOH | |
| Физические свойства | ||
| Состояние | твёрдое | |
| Молярная масса | 23,94637 г/моль | |
| Плотность | 1,46 (25 °C) | |
| Термические свойства | ||
| Температура | ||
| • плавления | 462[1] | |
| • кипения | 925[1] °C | |
| • разложения | 930[1] | |
| Энтальпия | ||
| • образования | -487,2[1] кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 12,24 г/100 мл (25 °C)[1] | |
| Классификация | ||
| Рег. номер CAS | 1310-65-2 | |
| PubChem | 3939 | |
| Рег. номер EINECS | 215-183-4 | |
| SMILES |
[Li+].[OH-] |
|
| InChI |
InChI=1S/Li.H2O/h;1H2/q+1;/p-1 WMFOQBRAJBCJND-UHFFFAOYSA-M |
|
| RTECS | OJ6307070 | |
| ChEBI | 33979 | |
| Номер ООН | 2680 | |
| ChemSpider | 3802 и 21170131 | |
| Безопасность | ||
| NFPA 704 |
0 3 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
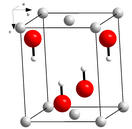
Гидроксид лития — неорганическое основание щелочного металла лития, имеющее формулу LiOH. Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Физические свойства[править | править код]
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы с тетрагональной решёткой.[1] При работе с ним необходимо проявлять осторожность, избегать попадания на кожу и слизистые оболочки.
Растворяется в воде, 12,24 г/100 мл при 25 °C, растворимость с температурой практически не повышается.
В этаноле, в отличие от гидроксида натрия, почти не растворяется.[2]
Получение[править | править код]
- Взаимодействие металлического лития с водой:
- Взаимодействие оксида лития с водой:
- Взаимодействие карбоната лития с гидроксидом кальция:
- Обменными реакциями:
Химические свойства[править | править код]
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с кислотными оксидами с образованием соли и воды:
- При нагревании в инертной атмосфере (Ar) разлагается(дисоциация) :
- Находясь в растворе, взаимодействует с хлором. Образуемый продукт зависит от температуры раствора[3]:
Применение[править | править код]
Гидроксид лития используют для получения солей лития; как компонент электролитов в щелочных аккумуляторах и поглотитель углекислого газа в противогазах, подводных лодках и космических кораблях. Он также используется как катализатор полимеризации. Применяется в стекольной и керамической промышленности. При производстве водоупорных смазочных материалов, обладающих механической стабильностью в широком диапазоне температур.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 Рабинович В. А., Хавин З. Я. Краткий химический справочник / под общей редакцией канд. хим. наук В. А. Рабиновича. — Изд. 2-е, испр. и доп. — Л : Химия, 1978. — С. 76. — 392 с. — УДК 54(031)(G).
- ↑ Гороновский И. Т., Назаренко Ю. П., Некряч Е. В. Краткий справочник по химии. Киев, Наукова думка, 1987 год.
- ↑ Лидин, 2000, с. 14.
Литература[править | править код]
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Физические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития:
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
Li2O2 + H2O → 2LiOH + H2O2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Li2CO3 + Ca(OH)2 → CaCO3↓ + 2LiOH
Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет.
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3LiOH + H3PO4 → Li3PO4 + H2O
2LiOH + H3PO4 → Li2HPO4 + 2H2O
LiOH + H3PO4 → LiH2PO4 + H2O
2. Гидроксид лития реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2LiOH(избыток) + CO2 → Li2CO3 + H2O
LiOH + CO2 (избыток) → LiHCO3
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2LiOH + Al2O3 → 2LiAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2LiOH + Al2O3 + 3H2O → 2Li[Al(OH)4]
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
LiOH + LiHCO3 → Li2CO3 + H2O
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
2LiOH + Si + H2O → Li2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4LiOH + 2F2 → 4LiF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
3LiOH + P4 + 3H2O = 3LiH2PO2 + PH3↑
2LiOH(холодный) + Cl2 = LiClO + LiCl + H2O
6LiOH(горячий) + 3Cl2 = LiClO3 + 5LiCl + 3H2O
Сера взаимодействует с гидроксидом лития только при нагревании:
6LiOH + 3S = 2Li2S + Li2SO3 + 3H2O
6. Гидроксид лития взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2LiOH + Zn → Li2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
Также с гидроксидом лития взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li+ + OH—
10. Гидроксид лития в расплаве подвергается электролизу. При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
Lithium gets its name from “lithos”. It is the Greek word used for stone. Lithium (Li), alkali metal machine of the periodic table (Group1) of a chemical element. Lithium is a type of metal that is mainly used in grains and vegetables for diet purposes. Its various forms are used in supplements. Lithium is the lightest metal of the solid element. The boiling point and oxidation state of lithium are 1,342°C and +1. It is an s-block element. Lithium is used in rechargeable batteries for mobile phones, laptops, digital cameras, and electric vehicles.
Hydroxide is a chemical compound that contains one or more groups. It consists of hydrogen and an oxygen atom which are together by a covalent bond. Hydrogen carries a negative electric charge. It is used in food preservatives.
Lithium Hydroxide
It is an inorganic compound having the formula LiOH.It is an alkali metal hydroxide. Lithium hydroxide, the solution appears like a clear white liquid. It is very harmful when not used with safety precautions. It may cause irritation to the eyes, and skin of our body. It is used to make other chemicals. It is a strong base and the weakest known alkali metal hydroxide.
The formula of Lithium Hydroxide
The chemical and molecular formula of Lithium Hydroxide is LiOH and the molar mass of Lithium Hydroxide is 23.91 g/mol. LiOH exists in two forms anhydrate form and a monohydrate form. It is only one alkali hydroxide that does not present Polymorphism.
Structure of Lithium Hydroxide
The structure of lithium hydroxide contains a lithium-ion, an oxygen atom, and a hydrogen atom. It is highly reactive in nature, it can react with other compounds to form other compounds.
Preparation of Lithium Hydroxide
When we react lithium with water then it gives lithium Hydroxide and the following reaction is here
H2O + Li2+→ LiOH
The maximum amount of the lithium hydroxide is produced when the reaction between calcium hydroxide and lithium carbonate happened which produces lithium hydroxide and calcium carbonate:
Ca(OH) + Li2CO3 → CaCo3 + 2LiOH
Physical Properties of LiOH
- Lithium hydroxide is Odourless in nature.
- It enhances the quality of the dye.
- Its appearance is hygroscopic white solid.
- The density of Lithium Hydroxide is 1.46 g/cm³.
- The melting and boiling points of LiOH are 462 °C and 924°C.
- It is well soluble in water but poorly soluble in alcohol.
Chemical Properties of LiOH
- When lithium Hydroxide (LiOH) is react with sulphuric acid (H2SO4) then it gives lithium Sulfate and water.
2LiOH + H2SO4 → LiSO4 + 2H2
- When Lithium hydroxide (LiOH) reacts with carbon dioxide (CO2) then it gives lithium carbonate and water. And this reaction is also called an exothermic reaction.
2LiOH + CO2 → Li2CO3 + H2O
- When lithium hydroxide is react with chlorine then it gives lithium hypochlorite and hydrochloric acid.
LiOH + Cl2→ LiOCl + HCl
- When lithium hydroxide is react with hydrochloric acid then it gives lithium chloride and water. This reaction is also called a neutral reaction.
LiOH + HCl →LiCl + H2O
Uses of LiOH
- Lithium hydroxide is most commonly used as an electrolyte in batteries. Like Nickel hydrogen batteries etc.
- Lithium hydroxide and lithium carbonate are used as a dye. They both increase the reaction and enhance the quality of the dye.
- Lithium hydroxide is used for corrosion control.
- LiOH is used as a carbon dioxide scrubber in submarines.
- It is used in the ceramic and paint industry.
Sample Questions
Question 1: Is LiOH base in water?
Answer:
It is base because when it dissolves in an aqueous solution it gives two Li+ ions and OH– and any molecule which gives OH– after dissolving in water is defined as a base in nature.
Question 2: Is lithium hydroxide used in batteries?
Answer:
Lithium Hydroxide Monohydrate is used in the production of cathode material for lithium-ion electric vehicle batteries it is more suitable because it provides the best energy balance. LiOH is used as an electrolyte in batteries like Nickel hydrogen and nickel-cadmium batteries. They are produced from lithium hydroxide. These batteries are used in watches, digital cameras, smartphones,s, etc.
Question 3: What type of element is LiOH?
Answer:
Lithium hydroxide is an inorganic compound having the formula LiOH. It has two forms anhydrous or hydrated, and both forms are white hygroscopic solids. It is odorless in nature. It is a strong base having a pH value of approx 10 and used for various purposes like the making of salt, corrosion control, dye purposes, etc.
Question 4: Is LiOH a strong acid or base?
Answer:
It is a strong base having a pH value of 10. When lithium hydroxide reacts with some acid like HCL then it gives salt and water and this reaction is known as the neutralization reaction. This reaction is written as
LiOH + HCl →LiCl + H2O
Question 5: How is LiOH produced?
Answer:
Lithium hydroxide is formed when lithium reacts with water then it produces lithium hydroxide and hydrogen gas. The appearance of lithium hydroxide is hygroscopic white solid. And the product which comes after a reaction between water and lithium is well soluble in water but poorly soluble in alcohol.
H2O + Li2+→ LiOH + H2
Question 6: Does lithium hydroxide react with oxygen?
Answer:
Lithium Hydroxide is insoluble in hydrocarbons. Lithium takes part in a number of reactions, with organic reactants and with inorganic reactants. It reacts with oxygen to form monoxide and peroxide.
Last Updated :
15 Jun, 2022
Like Article
Save Article
Гидроксид лития, характеристика, свойства и получение, химические реакции.
Гидроксид лития – неорганическое вещество, имеет химическую формулу LiOH.
Краткая характеристика гидроксида лития
Физические свойства гидроксида лития
Получение гидроксида лития
Химические свойства гидроксида лития
Химические реакции гидроксида лития
Применение и использование гидроксида лития
Краткая характеристика гидроксида лития:
Гидроксид лития – неорганическое вещество белого цвета.
Химическая формула гидроксида лития LiOH.
Хорошо растворяется в воде, при этом выделяя тепловую энергию. Его растворимость в воде составляет 12,7 г/100 см3 при 25 °C. Растворимость с повышением температуры увеличивается и он полностью диссоциирует на оксид лития и воду при температуре 1000 °С.
Не растворяется в этаноле.
На воздухе гидрооксид лития поглощает углекислый газ и образует карбонат лития, токсичность которого определяется наличием лития.
Гидроксид лития – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам первого класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Гидрооксид лития пожаро- и взрывобезопасен.
Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Физические свойства гидроксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | LiOН |
| Синонимы и названия иностранном языке | lithium hydroxide (англ.)
литиевый щелок (рус.) гидрат окиси лития (рус.) едкий литий (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тетрагональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 25 °C), кг/м3 | 1460 |
| Плотность (состояние вещества – твердое вещество, при 25 °C), г/см3 | 1,46 |
| Температура кипения, °C | 925 |
| Температура плавления, °C | 462 |
| Температура разложения, °C | 930 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 23,94637 |
* Примечание:
— нет данных.
Получение гидроксида лития:
Гидроксид лития получается в результате следующих химических реакций:
– путем взаимодействия металлического лития с водой:
2Li + 2H2O → 2LiOH + H2.
– путем взаимодействия оксида лития с водой:
Li2O + H2O → 2LiOH.
– путем взаимодействия карбоната лития с гидроксидом кальция:
Li2CO3 + Ca(OH)2 → 2LiOH + CaCO3 (t < 600°C).
Реакция протекает при нагревании до температуры не более 600°C.
– обменными реакциями солей лития с гидроксидами других металлов:
Li2SO4 + Ba(OH)2 → 2LiOH + BaSO4.
Химические свойства гидроксида лития. Химические реакции гидроксида лития:
Гидроксид лития – химически активное вещество, сильное химическое основание.
Водные растворы LiOH имеют сильную щелочную реакцию.
Химические свойства гидроксида лития аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида лития с хлором:
2LiOH + Cl2 → LiClO + LiCl + H2O.
В результате реакции образуются хлорид лития, гипохлорит лития и вода. При этом гидроксид лития в качестве исходного вещества используется в виде холодного концентрированного раствора.
2. реакция гидроксида лития с серой:
2LiOH + 3S → Li2S + H2S + SO2 (t = 445 °C).
В результате реакции образуются сульфид лития, сероводород и оксид серы.
3. реакция гидроксида лития с йодом:
6LiOH + 3I2 → 5KI + KIO3 + H2O (t = 80 °C).
В результате реакции образуются йодид лития, иодат лития и вода.
4. реакция гидроксида лития с цинком и водой:
Zn + 2LiOH + 2H2O → Li2[Zn(OH)4] + H2.
В результате реакции образуются тетрагидроксоцинкат натрия и водород. В ходе реакции используется концентрированный раствор гидроксида лития.
5. реакция гидроксида лития с ортофосфорной кислотой:
H3PO4 + 3LiOH → Li3PO4 + 3H2O.
В результате реакции образуются ортофосфат лития и вода.
6. реакция гидроксида лития с азотной кислотой:
LiOH + HNO3 → LiNO3 + H2O.
В результате реакции образуются нитрат лития и вода.
Аналогично проходят реакции гидроксида лития и с другими кислотами.
7. реакция гидроксида лития с сероводородом:
H2S + 2LiOH → Li2S + 2H2O.
В результате реакции образуются сульфид лития и вода.
8. реакция гидроксида лития с фтороводородом:
HF + LiOH → LiF + H2O.
В результате реакции образуются фторид лития и вода.
9. реакция гидроксида лития с бромоводородом:
HBr + LiOH → LiBr + H2O.
В результате реакции образуются бромид лития и вода.
10. реакция гидроксида лития с йодоводородом:
HI + LiOH → LiI + H2O.
В результате реакции образуются йодид лития и вода.
11. реакция гидроксида лития с оксидом алюминия:
Al2O3 + 2LiOH → 2LiAlO2 + H2O.
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат лития и вода.
12. реакция гидроксида лития с оксидом углерода (углекислым газом):
2LiOH + CO2 → Li2CO3 + H2O.
Оксид углерода является кислотным оксидом. В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития. Реакция протекает при комнатной температуре.
Также данная реакция протекает на воздухе. Гидрооксид лития поглощает углекислый газ и образуется карбонат лития.
13. реакция гидроксида лития с оксидом серы (IV):
2LiOH + SO2 → Li2SO3 + H2O.
Оксид серы (IV) является кислотным оксидом. В результате реакции образуются сульфит лития и вода. В ходе реакции используется насыщенный раствор гидроксида лития.
14. реакция гидроксида лития с оксидом серы (VI):
2LiOH + SO3 → Li2SO4 + H2O.
Оксид серы (VI) является кислотным оксидом. В результате реакции образуются сульфат лития и вода.
15. реакция гидроксида лития с оксидом кремния:
4LiOH + SiO2 ⇄ Li4SiO4 + 2H2O.
В результате реакции образуются ортосиликат лития и вода. В ходе реакции используется разбавленный раствор гидроксида лития. Реакция протекает при комнатной температуре.
16. реакция гидроксида лития с гидроксидом цинка:
Zn(OH)2 + 2LiOH → Li2[Zn(OH)4].
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат лития.
17. реакция гидроксида лития с сульфатом железа:
FeSO4 + 2LiOH → Fe(OH)2 + Li2SO4.
В результате реакции образуются гидроксид железа и сульфат лития.
18. реакция гидроксида лития с хлоридом железа:
FeCl3 + 3LiOH → Fe(OH)3 + 3LiCl.
В результате реакции образуются гидроксид железа и хлорид лития.
19. реакция гидроксида лития с нитратом цинка:
Zn(NO3)2 + 2LiOH → Zn(OH)2 + 2LiNO3.
В результате реакции образуются гидроксид цинка и нитрат лития.
20. реакция гидроксида лития с хлоридом меди:
CuCl2 + 2LiOH → Cu(OH)2 + 2LiCl.
В результате реакции образуются гидроксид меди и хлорид лития.
Аналогично проходят реакции гидроксида лития и с другими солями.
21. реакция термического разложения гидроксида лития:
2LiOH → Li2O + H2O (t = 800-1000°C).
В результате реакции образуются оксид лития и вода. Реакция протекает в атмосфере водорода.
Применение и использование гидроксида лития:
Гидроксид лития используется во множестве отраслей промышленности и для бытовых нужд:
– в химической промышленности для получения солей лития;
– как компонент электролитов в щелочных аккумуляторах,
– как поглотитель углекислого газа в противогазах, подводных лодках и космических кораблях,
– в химической промышленности как катализатор полимеризации,
– в стекольной и керамической промышленности;
– при производстве водоупорных смазочных материалов, обладающих механической стабильностью в широком диапазоне температур.
Примечание: © Фото //www.pexels.com, //pixabay.com
гидроксид лития реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида лития
реакции
Коэффициент востребованности
6 792
| Гидроксид лития | |
|---|---|
 |
|
| Систематическое наименование |
Гидроксид лития |
| Хим. формула | LiOH |
| Рац. формула | LiOH |
| Состояние | твёрдое |
| Молярная масса | 23,94637 г/моль |
| Плотность | 1,46 (25 °C) |
| Т. плав. | 462 |
| Т. кип. | 925 °C |
| Т. разл. | 930 |
| Энтальпия образования | -487,2 кДж/моль |
| Растворимость в воде | 12,7 (0 °C) |
| ГОСТ | ГОСТ 8595-83 |
| Рег. номер CAS | 1310-65-2 |
| PubChem | 3939 |
| Рег. номер EINECS | 215-183-4 |
| SMILES |
[Li+].[OH-] |
| InChI |
1S/Li.H2O/h;1H2/q+1;/p-1 WMFOQBRAJBCJND-UHFFFAOYSA-M |
| RTECS | OJ6307070 |
| ChEBI | 33979 |
| Номер ООН | 2680 |
| ChemSpider | 3802 и 21170131 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Гидроксид лития — неорганическое основание щелочного металла лития, имеющее формулу LiOH. Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Физические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы с тетрагональной решёткой. При работе с ним необходимо проявлять осторожность, избегать попадания на кожу и слизистые оболочки.
Растворяется в воде, 12,24 г/100 см3 при 25 °C, растворимость с температурой практически не повышается. В этаноле, в отличие от гидроксида натрия, почти не растворяется.
Получение
- Взаимодействие металлического лития с водой:
-
- 2Li + 2H2O ⟶ 2LiOH + H2↑
- Взаимодействие оксида лития с водой:
-
- Li2O + H2O ⟶ 2LiOH
- Взаимодействие карбоната лития с гидроксидом кальция:
-
- Li2CO3 + Ca(OH)2 ⟶ 2LiOH + CaCO3↓
- Обменными реакциями:
-
- Li2SO4 + Ba(OH)2 ⟶ 2LiOH + BaSO4↓
Химические свойства
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
-
- LiOH + HCl ⟶ LiCl + H2O
- 2LiOH + H2SO4 ⟶ Li2SO4 + 2H2O
- Взаимодействие с кислотными оксидами с образованием соли и воды:
-
- 2LiOH + CO2 ⟶ Li2CO3 + H2O
- 2LiOH + SO3 ⟶ Li2SO4 + H2O
- При нагревании в инертной атмосфере (Ar) разлагается:
-
- 2LiOH →800oC,A r Li2O + H2O
Применение
Гидроксид лития используют для получения солей лития; как компонент электролитов в щелочных аккумуляторах и поглотитель углекислого газа в противогазах, подводных лодках и космических кораблях. Он также используется как катализатор полимеризации. Применяется в стекольной и керамической промышленности. При производстве водоупорных смазочных материалов, обладающих механической стабильностью в широком диапазоне температур.