Содержание:
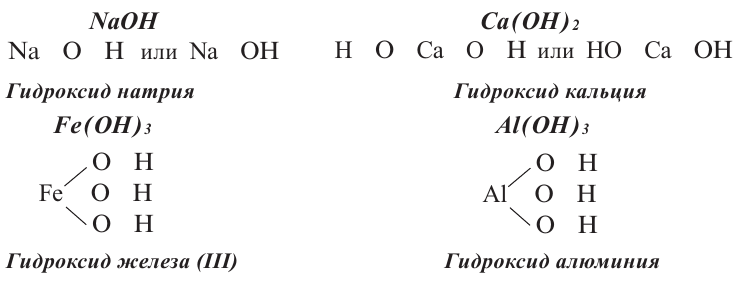
Основания, как и оксиды, кислоты и соли, относятся к сложным неорганическим веществам. Выясним, из каких частей состоит формула любого основания, воспользовавшись таким рядом формул:
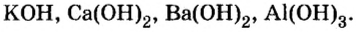
Разделим формулы черточкой на две части, отделив символ металлического элемента от остальных символов, и напишем над металлом его валентность:
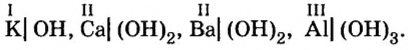
Общим для всех формул является наличие группы атомов  которая имеет название гидроксильная группа. В первой формуле она записана без скобок, а в остальных формулах заключена в скобки, после которых стоит соответствующий индекс.
которая имеет название гидроксильная группа. В первой формуле она записана без скобок, а в остальных формулах заключена в скобки, после которых стоит соответствующий индекс.
Как вы уже знаете, понятие валентности распространяется на группы атомов, в частности на кислотные остатки. Имеет свою валентность и гидроксильная группа  Она одновалентна. Обратите внимание на валентность металла в приведенных формулах, и станет понятно, что наличие индексов связано с валентностью металла. Действительно, одновалентный калий соединен с одной гидроксильной группой, двухвалентные кальций и барий — с двумя, а трехвалентный алюминий — с тремя. Поэтому, чтобы соблюдать правило относительно одинаковой суммы единиц валентностей обеих частей формулы сложного вещества, и ставят соответствующие индексы.
Она одновалентна. Обратите внимание на валентность металла в приведенных формулах, и станет понятно, что наличие индексов связано с валентностью металла. Действительно, одновалентный калий соединен с одной гидроксильной группой, двухвалентные кальций и барий — с двумя, а трехвалентный алюминий — с тремя. Поэтому, чтобы соблюдать правило относительно одинаковой суммы единиц валентностей обеих частей формулы сложного вещества, и ставят соответствующие индексы.
Теперь можем сформулировать определение оснований:
Основания — это сложные вещества, образованные металлическим элементом и гидроксильными группами.
Запишем формулу оснований в общем виде:

Следует отметить, что основания, как и соли,— вещества не молекулярного, а ионного строения, поэтому их формулы отображают соотношения ионов металла 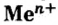 и ионов гидроксильной группы
и ионов гидроксильной группы 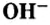 в веществе.
в веществе.
Номенклатура оснований
По современной номенклатуре название оснований состоит из двух слов: слова гидроксид и названия металлического элемента, например: 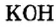 — гидроксид калия. Если металл проявляет переменную валентность, ее указывают в круглых скобках после названия металла без интервала:
— гидроксид калия. Если металл проявляет переменную валентность, ее указывают в круглых скобках после названия металла без интервала: 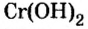 — гидроксид хрома
— гидроксид хрома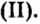
У некоторых оснований сохранились также исторические названия: 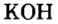 — едкое кали,
— едкое кали, 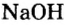 — едкий натр.
— едкий натр.
Составление формул оснований и определение валентности металла в формуле основания. Рассмотрим на примерах, как составлять формулы оснований и определять валентность металла по формуле основания.
Пример:
Составить формулу гидроксида магния.
Решение
Исходя из определения оснований, первым записываем символ металла, а после него — гидроксильную группу 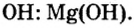 Магний проявляет постоянную валентность 2. Поэтому и гидроксильных групп в формуле этого основания будет две.
Магний проявляет постоянную валентность 2. Поэтому и гидроксильных групп в формуле этого основания будет две.
Ответ: формула основания —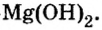
Пример 2. Определить валентность меди в формулах оснований 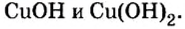
Решение
Известно, что в формуле основания валентность металла совпадает с количеством гидроксильных групп. Первая формула содержит одну гидроксильную группу, вторая — две. Поэтому в первой формуле медь одновалентна, а во второй — двухвалентна.
Ответ: 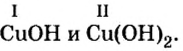
Физические свойства и классификация оснований
Основания — твердые вещества, преимущественно белого цвета, хотя встречаются и других цветов. Например, гидроксид меди — голубой, гидроксид железа
— голубой, гидроксид железа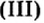 — коричневый.
— коричневый.
По способности растворяться в воде основания, как и соли, бывают растворимые, малорастворимые и нерастворимые. Преобладают нерастворимые. Среди хорошо растворимых — гидроксид натрия, гидроксид калия. Их растворы мылкие на ощупь.
Растворимые в воде основания получили название щелочи. По таблице растворимости солей, оснований и кислот можно узнать, к какой группе по способности растворяться в воде принадлежит то или иное основание.
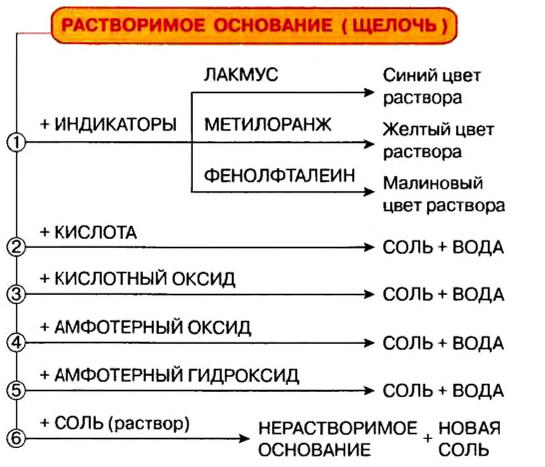
Итак, по физической характеристике — способности растворяться в воде — основания разделяют на растворимые, или щелочи, и нерастворимые.
Существует еще одна классификация оснований — по химическим свойствам. Согласно ей их разделяют на типичные основания и амфотерные гидроксиды. Но об этом речь пойдет позже.
Основания, хорошо растворимые в воде,— тугоплавкие вещества. Основания, нерастворимые в воде, при нагревании разлагаются с выделением воды и образованием оксида.
Итоги:
- Основания — сложные вещества немолекулярного строения, химическая формула которых состоит из одного атома металла и одной или нескольких гидроксильных групп.
- Число одновалентных гидроксильных групп в формуле основания равно валентности металла, поэтому в общем виде формула оснований имеет вид
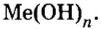
- Современное название основания состоит из слова гидроксид с добавлением к нему названия металла. Если металл проявляет переменную валентность, то ее указывают после названия металла в скобках.
- При обычных условиях основания находятся в твердом состоянии, часть из них хорошо растворяется в воде. Растворенные в воде основания называются щелочами.
Что такое основания
Известь — соединение, известное человеку давно. Смесь извести с водой нередко используют и в настоящее время в строительстве. Такой смесью белят стволы и ветки деревьев, защищая их от вредителей, а зимой — от солнечных ожогов. Известь (точнее — гашеная известь) 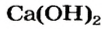 принадлежит к классу оснований.
принадлежит к классу оснований.
Каждое основание образовано тремя элементами. Из них два элемента «обязательные» — Оксиген и Гидроген, а третьим является металлический элемент.
Основание — соединение, которое состоит из катионов металлического элемента  и гидроксид-анионов
и гидроксид-анионов 
Название иона  происходит от названий элементов Гидрогена и Оксигена. Объяснить, почему его заряд равен — 1, можно так. Представим себе, что ион
происходит от названий элементов Гидрогена и Оксигена. Объяснить, почему его заряд равен — 1, можно так. Представим себе, что ион  образуется в результате соединения ионов
образуется в результате соединения ионов 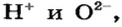 и сложим заряды этих частиц:
и сложим заряды этих частиц: 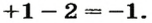
Формулы оснований
Выведем общую химическую формулу соединений этого класса. Вы знаете, что любое вещество электронейтрально. Поэтому в основании на каждый ион металлического элемента с зарядом +n должно приходиться n ионов  . Следовательно, общая формула оснований —
. Следовательно, общая формула оснований — 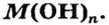
Примеры химических формул оснований: 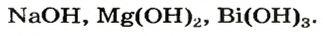
Основания — ионные соединения. Поэтому для них не составляют графические формулы.
Названия оснований
Химические названия оснований состоят из двух слов. Первым словом является название элемента, а вторым — «гидроксид». Например, соединение с формулой 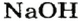 называют «натрий гидроксид», а основание
называют «натрий гидроксид», а основание 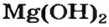 — «магний гидроксид» . Склоняется лишь второе слово названия: натрий гидроксида, магний гидроксидом.
— «магний гидроксид» . Склоняется лишь второе слово названия: натрий гидроксида, магний гидроксидом.
Если элемент имеет переменную валентность, то в названии основания указывают ее значение после названия элемента (римской цифрой в скобках): 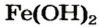 — феррум(II) гидроксид.
— феррум(II) гидроксид.
Это интересно. Оснований 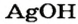 и
и 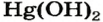 не существует.
не существует.
Среди соединений с общей формулой  есть и такие, которые не принадлежат к основаниям, так как отличаются от них по химическим свойствам. Их называют амфотерными гидроксидами (§ 13).
есть и такие, которые не принадлежат к основаниям, так как отличаются от них по химическим свойствам. Их называют амфотерными гидроксидами (§ 13).
Основание 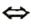 основный оксид. Каждому основанию соответствует определенный оксид:
основный оксид. Каждому основанию соответствует определенный оксид:

Заряд иона металлического элемента в основании и оксиде один и тот же.
Оксиды, которые отвечают основаниям, называют основными.
В отличие от оксидов, оснований в природе нет.
Выводы:
Основания — соединения, которые содержат катионы металлических элементов 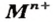 и гидроксид-анионы
и гидроксид-анионы  Общая формула оснований —
Общая формула оснований — 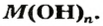
Химическое название основания состоит из названия металлического элемента и слова “гидроксид”.
Каждому основанию соответствует оксид; его называют основным оксидом. Заряд иона металлического элемента в этих соединениях один и тот же.
Свойства и применение оснований
Физические свойства оснований:
Вам известно, что каждое основание состоит из положительно заряженных ионов металлического элемента и отрицательно заряженных гидроксид-ионов 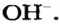 . Основания, как и ионные оксиды, в обычных условиях являются твердыми веществами. Они должны иметь высокие температуры плавления. Но при умеренном нагревании почти все основания разлагаются (на соответствующий оксид и воду). Расплавить удается только гидроксиды Натрия и Калия (температуры плавления соединений составляют соответственно 322 и 405 °С).
. Основания, как и ионные оксиды, в обычных условиях являются твердыми веществами. Они должны иметь высокие температуры плавления. Но при умеренном нагревании почти все основания разлагаются (на соответствующий оксид и воду). Расплавить удается только гидроксиды Натрия и Калия (температуры плавления соединений составляют соответственно 322 и 405 °С).
Большинство оснований не растворяются в воде (рис. 20). Малорастворимыми являются гидроксиды 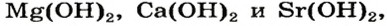 а хорошо растворимыми — основания, образованные щелочными элементами
а хорошо растворимыми — основания, образованные щелочными элементами 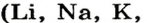
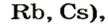 и соединение
и соединение 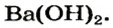
> > >

Водорастворимые основания называют щелочами*.
* – К щелочам часто относят соединения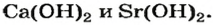
Сведения о растворимости оснований в воде можно найти в таблице, размещенной на форзаце 2 учебника. Ее называют таблицей растворимости. Приводим соответствующий фрагмент этой таблицы:
Растворимость некоторых оснований в воде при температуре 20—25 °С
Буквой «р» обозначены растворимые основания (щелочи), «м» —малорастворимые, «н>> — нерастворимые. Прочерк «— » означает, что такого основания не существует.
Щелочи и их растворы мылки на ощупь, разъедают многие материалы, вызывают серьезные ожоги кожи, слизистых оболочек, сильно поражают глаза (рис. 21). Поэтому натрий гидроксид в прошлом получил название «едкий натр», а калий гидроксид — «едкое кали ».

Работая со щелочами и их растворами, будьте особенно осторожны. Если раствор щелочи попал на руку, немедленно смойте его большим количеством проточной воды и обратитесь за помощью к учителю или лаборанту. Вы получите у них разбавленный раствор определенного вещества (например, уксусной кислоты), которым нужно обработать кожу для удаления остатков щелочи. После этого руку тщательно промойте водой.
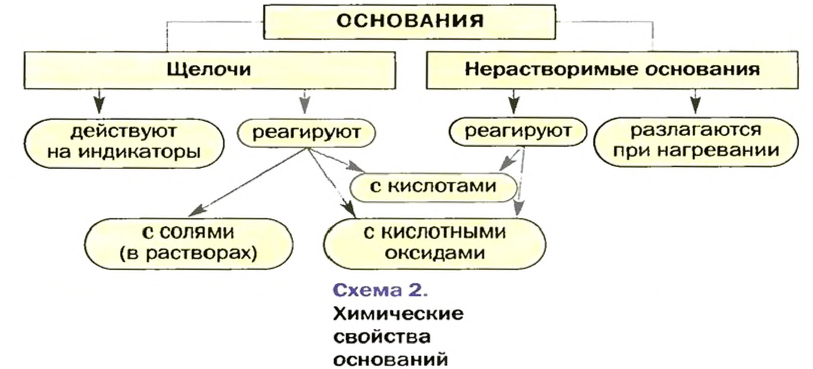
Химические свойства оснований:
Возможность протекания многих реакций с участием оснований зависит от растворимости этих соединений в воде. Щелочи в химических превращениях значительно более активны, чем нерастворимые основания, которые, например, с солями и некоторыми кислотами не реагируют.
Действие на индикаторы:
Растворы щелочей способны изменять окраску особых веществ — индикаторов*. Эти вещества были обнаружены в некоторых плодах и цветах. В настоящее время используют индикаторы, которые производят на химических заводах. Они более эффективны, чем природные, и лучше сохраняются.
К важнейшим индикаторам относятся лакмус, фенолфталеин, метиловый оранжевый (сокращенное название — метилоранж), а также универсальный индикатор. Последний является смесью нескольких веществ. Эта смесь, в отличие от отдельных веществ-индикаторов, изменяет цвет не только в присутствии щелочи, но и в зависимости от ее количества в растворе.
В химических лабораториях применяют водные растворы метилоранжа и лакмуса, водно-спиртовый раствор фенолфталеина. Очень удобна в использовании так называемая индикаторная бумага. Это — специальная бумага, пропитанная раствором индикатора, а затем высушенная и нарезанная маленькими полосками (рис. 22). Существует также индикаторная бумага, пропитанная раствором лакмуса или фенолфталеина.

Изменение окраски индикатора (рис. 23) является следствием его реакции со щелочью.

* — Термин происходит от латинского слова indico — указываю, определяю.
Уравнения таких реакций не приводим, поскольку формулы индикаторов и продуктов их химических превращений довольно сложные.
Нерастворимые основания на индикаторы не действуют.
Реакции с кислотными оксидами
Растворимые и нерастворимые основания взаимодействуют с соединениями противоположного характера, т. е. имеющими кислотные свойства. Среди этих соединений — кислотные оксиды. Соответствующие реакции были рассмотрены в предыдущем параграфе. Приводим дополнительные примеры:
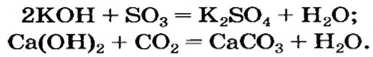
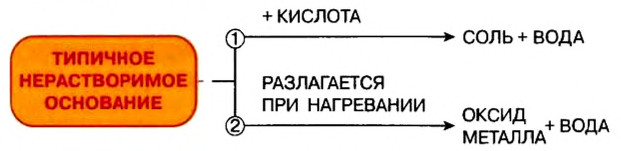
Реакции с кислотами
При взаимодействии основания с кислотой вещества обмениваются своими составными частями:
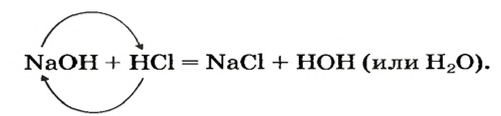
Это — реакция обмена.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
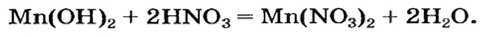
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Мп(ОН)2 + 2HN03 = Mn(N03)2 + 2Н20.
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Реакции щелочей с солями
Это — реакции обмена. Они происходят в растворе, причем исходная соль должна быть растворимой, а новое основание или новая соль — нерастворимыми.
Выясним возможность реакции между натрий гидроксидом и манган(II) нитратом:
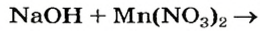
Воспользуемся таблицей растворимости (приводим ее фрагмент):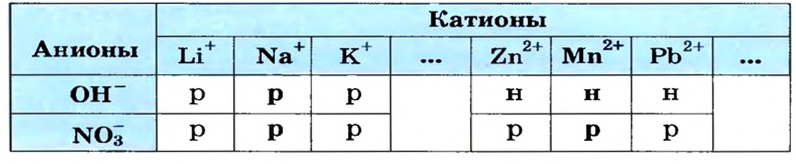
Как видим, соль 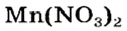 растворяется в воде. Чтобы реакция произошла, исходные вещества — щелочь
растворяется в воде. Чтобы реакция произошла, исходные вещества — щелочь 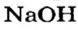 и соль
и соль 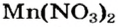 — должны обменяться своими ионами с образованием нерастворимого соединения. По таблице определяем, что этим соединением является новое основание
— должны обменяться своими ионами с образованием нерастворимого соединения. По таблице определяем, что этим соединением является новое основание 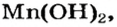 а новая соль
а новая соль 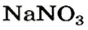 растворяется в воде. Значит, реакция между натрий гидроксидом и манган(II) нитратом возможна:
растворяется в воде. Значит, реакция между натрий гидроксидом и манган(II) нитратом возможна:
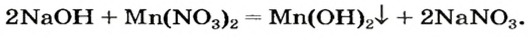
Термическое разложение
Почти все основания (кроме гидроксидов Натрия и Калия) при нагревании разлагаются на соответствующий оксид и воду (водяной пар):
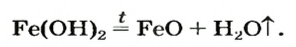
Взрослым известна жидкость под названием «нашатырный спирт». Это — водный раствор газа аммиака 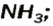 его используют как лечебное средство. В нашатырном спирте содержится необычное по своему составу основание. Его формула —
его используют как лечебное средство. В нашатырном спирте содержится необычное по своему составу основание. Его формула — 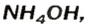 а химическое название — аммоний гидроксид. Соединение образуется в результате реакции
а химическое название — аммоний гидроксид. Соединение образуется в результате реакции
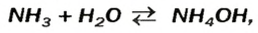
в которую вступает небольшая часть растворенного аммиака, и одновременно разлагается на исходные вещества. На это указывает знак  в химическом уравнении.
в химическом уравнении.
Аммоний гидроксид подобно щелочам (NaOH, КОН и др.) изменяет окраску индикаторов, взаимодействует с кислотными оксидами, кислотами, солями:
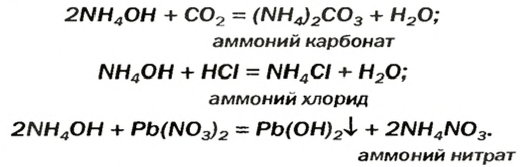
Изложенный материал обобщен в схеме 2.
Применение оснований
Широкое применение среди оснований получили щелочи, прежде всего гидроксиды Кальция и Натрия.
Вам известно, что вещество, называемое гашеной известью, является кальций гидроксидом 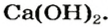 Гашеную известь используют как связующий материал в строительстве. Ее смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят ею стены. В результате реакций основания с углекислым газом и силиций(IV) оксидом смесь затвердевает. Кальций гидроксид также применяют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих важных веществ.
Гашеную известь используют как связующий материал в строительстве. Ее смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят ею стены. В результате реакций основания с углекислым газом и силиций(IV) оксидом смесь затвердевает. Кальций гидроксид также применяют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих важных веществ.
Натрий гидроксид используют при производстве мыла (осуществляют реакции щелочи с жирами), лекарств, в кожевенной промышленности, для очистки нефти и т. д.
Выводы:
Основания — твердые вещества ионного строения. Большинство оснований не растворяется в воде. Водорастворимые основания называют щелочами. Щелочи изменяют окраску особых веществ — индикаторов.
Основания взаимодействуют с кислотными оксидами и кислотами с образованием солей и воды. Щелочи реагируют и с солями; продукты каждой реакции — другие основание и соль. Нерастворимые основания разлагаются при нагревании на соответствующие оксиды и воду.
Реакцию между основанием и кислотой называют реакцией нейтрализации. На практике используют преимущественно гидроксиды Кальция и Натрия.
Способы получения оснований и амфотерных гидроксидов
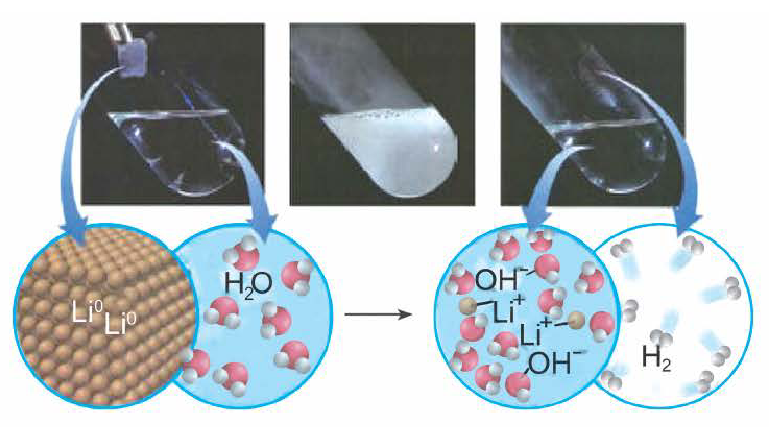
Получение щелочей: один из способов получения щелочей основан на реакции металла с водой (рис. 40). Кроме щелочи, образуется водород:
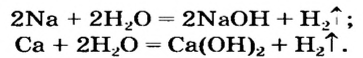
Второй способ получения щелочей — взаимодействие основного оксида с водой:
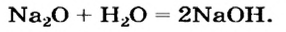
Таким способом получают гашеную известь на заводах и непосредственно перед использованием этого вещества для строительных работ, побелки стволов деревьев:
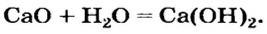

Щелочь можно получить и с помощью реакции обмена между растворимой солью и другой щелочью (в растворе). Исходные соединения подбирают так, чтобы образовалась нерастворимая соль:
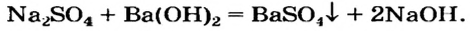
Гидроксиды Натрия и Калия производят в промышленности действием постоянного электрического тока на водные растворы хлоридов:
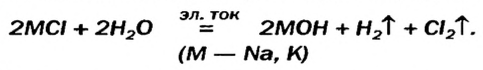
Этот процесс называют электролизом.
Получение нерастворимых оснований
Нерастворимое основание можно получить только с помощью реакции обмена между солью и щелочью в растворе. Поскольку основание будет выпадать в осадок, то образующаяся соль должна быть растворимой в воде (два нерастворимых соединения разделить невозможно):
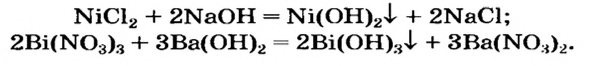
Малорастворимый магний гидроксид может быть не только продуктом реакции обмена. Это соединение, как и щелочи, образуется при взаимодействии металла или оксида с водой. Правда, эти реакции происходят медленно, а первая — только при нагревании:
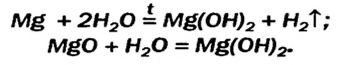
Изложенное обобщает схема 7.
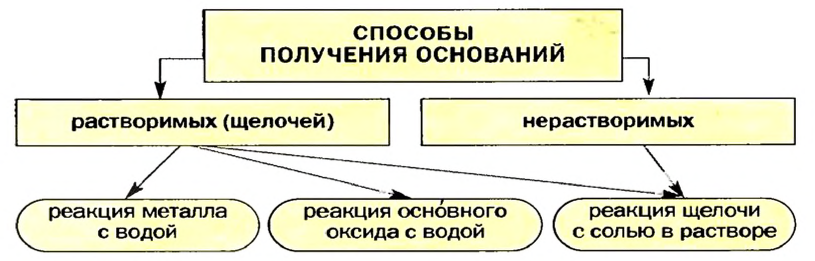
Схема 7. Получение оснований
Получение амфотерных гидроксидов
Ввиду того что амфотерный гидроксид проявляет свойства основания и кислоты, его можно получить с помощью реакций обмена и как основание
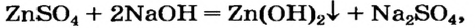
и как кислоту
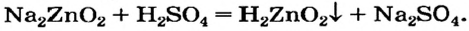
Эти превращения происходят потому, что все амфотерные гидроксиды нерастворимы в воде.
Щелочь или кислоту нельзя брать в избытке, поскольку амфотерный гидроксид реагирует с обоими соединениями. Например, при взаимодействии натрий цинка с избытком сульфатной кислоты вместо цинк гидроксида образуется цинк сульфат:
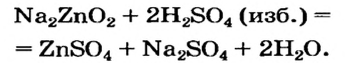
Некоторые амфотерные гидроксиды можно получить реакцией обмена между двумя солями в растворе, если одна из солей — продуктов реакции — разлагается водой (такие сведения имеются в таблице растворимости):
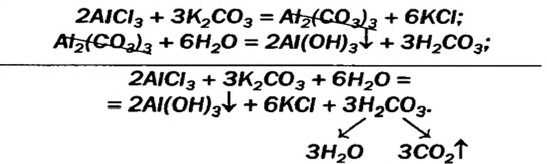
Выводы:
Щелочи получают взаимодействием соответствующих металлов или оксидов с водой.
Общий метод получения растворимых и нерастворимых оснований, а также амфотерных гидроксидов основан на реакции обмена между щелочью и солью в растворе. Амфотерные гидроксиды, кроме того, получают взаимодействием соответствующих солей с кислотами.
Химические свойства оснований
О действии растворов оснований на индикаторы, взаимодействие оснований с кислотными оксидами и кислотами вы узнали ранее. Вспомним соответствующие реакции.
Действие оснований на индикаторы
(Это свойство имеют лишь основания, растворимые в воде, то есть щелочи.) В растворе щелочей лакмус приобретает синий цвет, метиловый оранжевый — желтый, а фенолфталеин — малиновый. Универсальный индикатор в разбавленном растворе щелочи имеет зеленую окраску, в концентрированном — синюю и сине-фиолетовую.
Взаимодействие с кислотными оксидами
Щелочи взаимодействуют с кислотными оксидами, образовывая соль кислоты, которой отвечает взятый для реакции оксид, и воду:
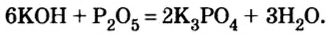
Взаимодействие с кислотами (реакция нейтрализации)
Щелочи (уравнение а) и нерастворимые основания (уравнение б) взаимодействуют с кислотами, образуя соль и воду:
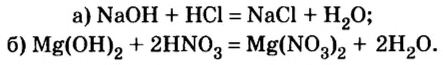
Следующие два свойства оснований вам еще неизвестны, поэтому для их изучения проведем химический эксперимент.
Взаимодействие щелочей с растворами солей
(Реакция происходит в том случае, если по крайней мере один из продуктов реакции выпадает в осадок или выделяется в виде газа.)
Опыт 1. Нальем в сосуд раствор сульфата железа и прибавим к нему раствор гидроксида натрия. Сразу же происходит взаимодействие веществ, о чем свидетельствует образование коричнево-красного осадка:
и прибавим к нему раствор гидроксида натрия. Сразу же происходит взаимодействие веществ, о чем свидетельствует образование коричнево-красного осадка:
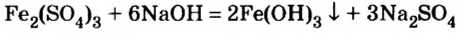
Отношение оснований к нагреванию
Щелочи устойчивы к нагреванию. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Опыт 2. Сухую пробирку на 1/4 наполним гидроксидом меди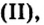 закрепим ее в держателе и нагреем. Наблюдаем, как голубой цвет (цвет гидроксида меди
закрепим ее в держателе и нагреем. Наблюдаем, как голубой цвет (цвет гидроксида меди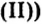 изменится на черный (цвет оксида меди
изменится на черный (цвет оксида меди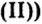 а вблизи отверстия пробирки появятся капельки воды:
а вблизи отверстия пробирки появятся капельки воды: 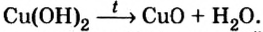
В том, что одним из продуктов этой реакции будет вода, можно удостовериться, подержав холодный предмет (например, стеклянную пластину) около отверстия пробирки.
Чтобы закрепить знания о химических свойствах оснований, выполните лабораторные опыты 3, 4, 5, 6. Прежде чем приступить к их выполнению, ознакомьтесь с мерами предосторожности во время работы со щелочами и неуклонно выполняйте их.
Меры предосторожности во время работы со щелочами:
Твердые щелочи и их растворы разъедают ткань, бумагу, вызывают ожоги кожи, глаз, что очень опасно. Поэтому обращаться с ними нужно осторожно: гранулу щелочи (вспомните, что это твердые вещества) ни в коем случае не брать руками; не разливать растворы; следить, чтобы раствор не попадал на открытые участки кожи, в глаза, на одежду, парту, книги, тетради. Вам понадобятся защитная одежда (халат, передник) и защитные очки. Посуду с раствором щелочи следует держать закрытой, чтобы она не реагировала с углекислым газом воздуха.
Если вы разлили щелочь, сразу нейтрализуйте ее уксусом. Участок кожи, на который попала щелочь, быстро промойте большим количеством воды. Если щелочь попала в глаза, немедленно промойте их медицинским раствором борной кислоты.
Итоги:
- Щелочи в химическом отношении более активны, чем нерастворимые основания, и имеют такие типичные свойства:
- Типичными химическими свойствами нерастворимых оснований является взаимодействие с кислотами и разложение при нагревании:
- Реакция нейтрализации свойственна и щелочам, и нерастворимым основаниям.
- Взаимодействие щелочи с раствором соли происходит, если среди продуктов реакции есть нерастворимые вещества.
“Для того, чтобы спаять две железные части какого-либо предмета, необходимо поверхность металла тщательным образом очистить от ржавчины, в состав которой входит гидроксид железа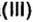 (этот процесс имеет еще название «травление»). Чаще всего для этого используют соляную кислоту:
(этот процесс имеет еще название «травление»). Чаще всего для этого используют соляную кислоту: 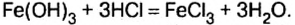
Чтобы во время травления с кислотой взаимодействовала только ржавчина, а не железо, из которого изготовлен предмет, в травильный раствор добавляют ингибиторы — вещества, которые действуют противоположно катализаторам. Они замедляют реакции, а то и совсем их прекращают. Ингибитором реакции между железом и соляной кислотой является органическое вещество уротропин.
Если вы хотя бы раз пользовались горючим под названием «сухой спирт», то имели дело со смесью уротропина с небольшим количеством парафина. Это горючее удобно тем, что быстро зажигается, легко гаснет и почти не оставляет пепла.
Понятие об амфотерных гидроксидах
Щелочи и большинство нерастворимых оснований взаимодействуют с кислотами и не взаимодействуют с представителями своего класса. Кислоты взаимодействуют с основаниями и не взаимодействуют с другими кислотами. Проверив экспериментально, с какими веществами данное вещество взаимодействует, а с какими — нет, можно сказать: к классу оснований или к классу кислот оно относится. Это общее правило. Однако оно имеет исключение, понять которое нам помогут опыты с гидроксидом цинка.
По способности растворяться в воде это вещество принадлежит к нерастворимым основаниям. Единственным способом получения нерастворимых оснований является взаимодействие растворимой соли соответствующего металла с раствором щелочи. Одним из продуктов этого взаимодействия будет нерастворимое основание.
Опыт 1. Нальем в колбу раствор сульфата цинка и добавим к нему небольшими порциями раствор гидроксида натрия, пока в колбе не образуется белый осадок (рис. 13):
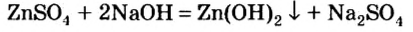
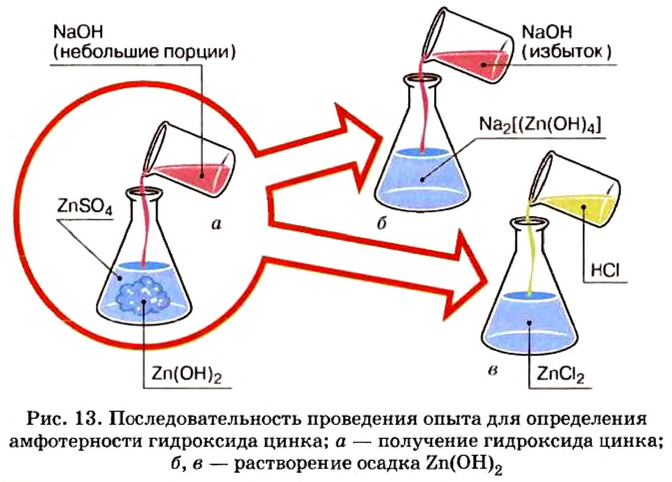
Образовавшийся осадок разделим, поместим в 2 колбы и проведем следующие опыты.
Опыт 2. В первую колбу с гидроксидом цинка добавим соляной кислоты. Осадок сразу исчезает, что является признаком химического явления: 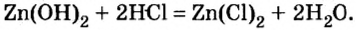
Обратимся к таблице растворимости и увидим, что образовавшаяся соль хлорид цинка — растворимое в воде соединение.
Произошла реакция нейтрализации, в которой гидроксид цинка проявил свойства основания.
Опыт 3. Во вторую колбу с гидроксидом цинка добавим раствор гидроксида натрия. Наблюдение показывает, что, как и в опыте с соляной кислотой, осадок исчез. Следовательно, осадок прореагировал с избытком щелочи (в опыте 1 мы прекратили доливать раствор щелочи, как только образовался осадок. При избыточном добавлении щелочи мы успели бы лишь визуально зафиксировать появление и исчезновение осадка).
Запишем уравнение проведенной реакции:
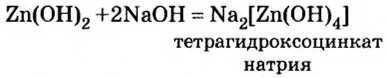
Образовалась соль натрия, в которой вместо привычного кислотного остатка есть остаток, содержащий один атом цинка и четыре (тетра — четыре) гидроксильные группы. Остаток такого вида записывают в квадратных скобках.
В этой реакции гидроксид цинка сыграл роль кислоты, потому что металлический элемент цинк после реакции вошел в состав кислотного остатка.
Гидроксиды, которые образуют соль при взаимодействии как с кислотой, так и со щелочью, называют амфотерными гидроксидами.
Повторите материал об амфотерных оксидах (§ 13) и составьте формулы амфотерных гидроксидов, которые им отвечают.
Амфотерные гидроксиды реагируют со щелочами не только в растворе, но и в расплаве:
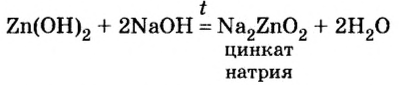
Образовавшаяся соль имеет двухвалентный кислотный остаток 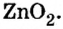 Наличие в нем цинка доказывает, что при сплавлении со щелочью гидроксид цинка проявил свойства кислоты.
Наличие в нем цинка доказывает, что при сплавлении со щелочью гидроксид цинка проявил свойства кислоты.
Проведенные опыты свидетельствуют, что разделение сложных неорганических веществ на оксиды, кислоты, основания и
соли не лишено исключений. Бывают вещества со смешанными свойствами, например амфотерные гидроксиды.
Применение оснований:
Представители этого класса неорганических веществ в природе отсутствуют. Но потребность в них существует, поэтому их получают специально. Наибольшее практическое значение имеют щелочи гидроксид натрия и гидроксид калия. Применение этих и некоторых других оснований показано на рисунке 14.
Итоги:
Получение оснований
Растворимые основания (щелочи) получают взаимодействием металла или его оксида с водой.
1. Взаимодействие активных металлов с водой приводит к образованию щелочей и выделению водорода:
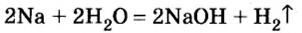
(К какому типу относятся эти реакции?)
2. Взаимодействие оксидов активных металлов с водой завершается образованием растворимого в воде гидроксида — щелочи:
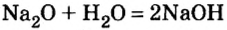
(Какой это тип реакции?)
3. В промышленности щелочи получают электролизом водных растворов бескислородных кислот. Этот способ вы будете изучать в следующем классе.
4. Нерастворимые основания получают действием раствора щелочи на растворимую соль соответствующего металла:
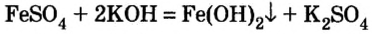
Классификация, номенклатура и получение оснований
Поместите в керамический тигель немного карбоната кальция (известняка) и в течение 10 минут раскалите на огне спиртовки.
После того как тигель остынет, влейте поверх него немного дистиллированной воды, Затем помешивайте стеклянной палочкой и проверьте красной лакмусовой бумагой. Что вы наблюдаете? Обсудите свои соображения с товарищами. Запишите уравнения реакций.
Сложные вещества, в составе которых содержатся одна или несколько гидроксильных групп (ОН), соединенных с атомами металлов, называются основаниями. Основания обозначаются общей формулой Me(OH)n
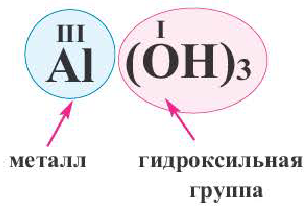
Гидроксильная группа ОН всегда одновалентна. Число гидроксильных групп соответствует валентности металла.
Классификация:
Основания классифицируются по своей растворимости в воде и кислотности.
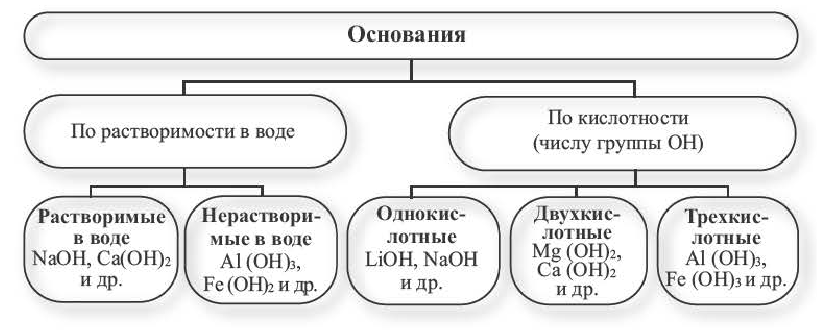
Растворимые в воде основания называют щелочами. Кроме Li, Na, К, Rb, Cs, Ca, Sr, Ba, гидроксиды других металлов не растворяются или очень мало растворяются в воде. Часть нерастворимых в воде оснований обладает амфотерными (двойственными) свойствами.
Основания, вступающие в реакцию как с кислотами, так и с щелочами, образуя соль и воду, называются амфотерными основаниями: Zn (ОН)2, Be (OH)2, Al (OH)3, Fe (OH)3.
Число гидроксильных групп в составе оснований определяет их кислотность.
Номенклатура:
При наименовании оснований по международной номенклатуре, если металл, образующий основание, имеет постоянную валентность, то вначале указывается слово «гидроксид», а затем название металла. Если же металл обладает переменной валентностью, то после слова «гидроксид» и названия металла валентность отмечают римскими цифрами в скобках.
| Основания металлов с постоянной валентностью | Основания металлов с постоянной валентностью | ||
| Гидроксид металла | Международное название | Гидроксид металла | Международное название |
| Mg(OH)2 | Гидроксид магния | Pb(OH)2 | Гидроксид свинца (II) |
| NaOH | Гидроксид натрия | Cr(OH)3 | Гидроксид хрома (III) |
| Al(OH)3 | Гидроксид алюминия | CuOH | Гидроксид меди (I) |
Графические формулы оснований:
Получение растворимых в воде оснований
Получение в лабораторных условиях.
При взаимодействии активных металлов (щелочных металлов Li, Na, К, Rh, Cs и щелочноземельных металлов Ca, Sr, Ba) с водой. Эти реакции протекают в обычных условиях.
металл + вода → щелочь + H2 ↑
2Li + 2HОH → 2LiOH + H2 ↑
При взаимодействии в обычных условиях гидридов щелочных (NaH3 КН) и щелочноземельных металлов(CaH2, BaH2) с водой.
гидрид металла + вода → щелочь + H2↑
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH) 2 + 2H2
При взаимодействии оксидов щелочных и щелочноземельных металлов с водой.
оксид металла + вода → щелочь
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Получение нерастворимых в воде оснований
При добавлении в раствор растворимой соли среднеактивных и пассивных металлов щелочи. Получение растворимых в воде оснований этим методом возможно в том случае, если в результате реакции получится нерастворимая соль.
FeCh + ЗКОН → Fe(OH)3↓ + 3 KCl
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Получение в промышленности
Путем воздействия постоянного электрического тока на водные растворы хлоридов щелочных и щелочноземельных металлов.
2NaCl + 2H2O H2↑ +Cl2 ↑ +2NaOH
H2↑ +Cl2 ↑ +2NaOH
Физические и химические свойства оснований

Определите основания по цвету раствора и осадка в пробирке. Какие физические и химические свойства имеют основания?
Физические свойства: В обычных условиях щелочи это растворимые в воде твердые вещества белого цвета. Некоторые нерастворимые в воде основания имеют другие цвета. Cu(OH)2 голубого, CuOH желтого, Fe(OH)3 бурого, Fe(ОН)2 зеленовато-бурого, Сг(ОН)3 серовато-зеленого цвета.
Все щелочи бывают скользкие как мыло. При растворении в воде они образуют бесцветный раствор.
На рисунке показывается, как меняется цвет индикаторов под действием щелочей. Нерастворимые в воде основания не меняют окраску индикаторов.
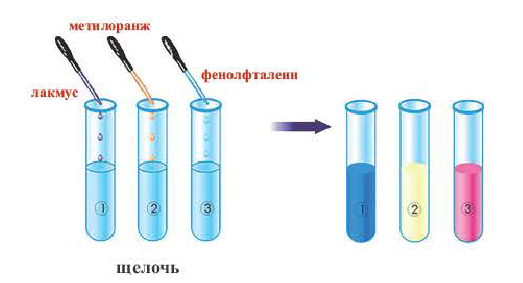
Слово «индико» в переводе с латинского означает «показываю», «определяю». Индикаторы это сложные органические соединения. Для определения щелочей (а также кислот) используют такие индикаторы, как лакмус, фенолфталеин и метилоранж.
Химические свойства: Взаимодействие оснований с кислотами (реакция нейтрализации). Для всех оснований характерным химическим свойством является их взаимодействие с кислотами. При взаимодействии кислот с основаниями образуются соль и вода.
Cu(OH)2 + 2HNO3 → Cu(NO3)2 +2H2O
 |
Нальем в химический стакан (или колбу) на 1/4 раствора гидроксида натрия и добавим к нему 1 2 капли лакмуса. Затем к полученному раствору будем прикатывать раствор соляной кислоты. Понаблюдайте, как меняется цвет. Запишите уравнение реакции. |
Взаимодействие щелочей с амфотерными металлами. Из металлов щелочи взаимодействуют только с амфотерными металлами (Be, Zn, Al), при этом образуется соль и выделяется водород.
Zn+ 2NaOH  Na2ZnO2 + H2 ↑
Na2ZnO2 + H2 ↑
2Al + 2NaOH + 2H2O 2NaAlO2+3H2 ↑
2NaAlO2+3H2 ↑
Взаимодействие щелочей с неметаллами. Щелочи взаимодействуют с целым рядом неметаллов (CL, Br2), образуя соль и воду. Лишь при взаимодействии с кремнием выделяется водород.
Si+ 2NaOH +H2O Na2SiO3+ 2H2 ↑
Na2SiO3+ 2H2 ↑
Щелочам и нерастворимым в воде основаниям присущи и отличающие их друг от друга химические свойства.
Взаимодействие щелочей с кислотными оксидами. Щелочи вступают в реакцию с кислотными оксидами, а нерастворимые в воде основания не вступают в такую реакцию. 1 моль таких кислотных оксидов, как CO2, S02, SO2, вступает в реакцию соединения с 1 молем однокислотной щелочи.
CO2+NaOH → NaHCO3
Хранить щелочи в открытой посуде нельзя. Потому что при вступлении в реакцию с углекислым газам воздуха образуются соответствующие карбонаты.
В этих реакциях даже в том случае, если кислотного оксида берется в избытке, реакция соединения всё равно происходит. При избытке щелочи, например, в соотношении молей 1:2, получится нормальная соль и вода.
CO2 + 2NaOH → Na2CO3 +H2O
Такие кислотные оксиды, как CO2, SO2, SO2, в зависимости от мольного соотношения, вступают в различные реакции с двухкислотными щелочами, при этом получаются различные продукты.
CO2 + Ca(OH)2 → СаСО3↓ + H2O 2CO2 + Ca(OH)2 → Ca(HCO3)2
Из кислотных оксидов NO2 при взаимодействии с щелочами образует две различные соли.
2NO2 + 2NaOH → NaNO3 + NaNO2 +H2O
Взаимодействие щелочей с амфотерными оксидами и гидроксидами. Щелочи также взаимодействуют с амфотерными оксидами и гидроксидами, образуя соль и воду.
Разложение оснований. В то время как щелочи не разлагаются, нерастворимые в воде основания при нагревании разлагаются. Самыми неустойчивыми основаниями являются гидроксиды серебра и ртути. Они подвергаются разложению при комнатной температуре.
Hg(OH)2 → HgO+ H2O
Задача:
При размешивании растворов, как показано на рисунке, то в I сосуде красный цвет лакмуса превратится в голубой, а во II сосуде голубой цвет превратится в красный. На основе этих данных определите, какое из веществ X, Y, Z является кислотой, а какие основанием?
| Кислота | Основание |
| A) X, Y | Z |
| В) Y, Z | X |
| С) Y | X, Z |
| D) Z | X, Y |
| Е) X | Y, Z |

Решение: Если в I сосуде красный цвет лакмуса превращается в голубой, то Х→кислота, a Y→ щелочь.
А во II сосуде голубой цвет лакмуса превращается в красный, значит, Z→ щелочь, a X→ кислота.
Ответ: E
Задача:
Какие выражения верные, если в результате реакции получается нерастворимая в воде соль?
1) Формула полученной соли: YxAb
2) Получится х+b моль Н2О
3) x b
b
4) Продукты реакции проводят электрический ток
5) Полученный в реакции v (H2O)=x=b
| Вступившие в реакцию вещества | v (моль) |
| HxA кислота | a |
| Y(OH)b основание | a |
Решение: HxA + Y(OH)b→ YxAb+ xH2O (или b H2O).
Ответ: 1:5. Согласно условиям, поскольку соль YxAb нерастворимая в воде соль, то она не проводит электрический ток.
Задача:
Что можно определить на основе таблицы?
1) Массу оксида
2) Ar (X)
3) Степень окисления X в оксиде.
| Вещества, полностью вступившие в реакцию | Продукт реакции | |
| X | O2 | XO |
| 4 г | 1,6 г |
Решение:
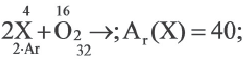
m(ХО) = 4+1,6 = 5,6г; 
Ответ: 1,2,3
Задача:
| Вещества, вступившие в реакцию, и их мольное количество | Масса полученной соли (в г) | N (атом) в молекуле полученной соли (в целом) | |
| Fe(OH)3 | HNO3 | ||
| 1 | xl | yl | z1 |
| x2 | y2 | z2 | |
| x3 | y3 | z3 |
| 1 | 2 | |
A) х1 х2 х2 х3 х3 |
z1 z2 z2 z3 z3 |
|
В) х3 х2 х2 х1 х1 |
z1 z2 z2 z3 z3 |
|
С) х1 х2 х2 х3 х3 |
z3 z2 z2 z1 z1 |
|
D) x2 x1 x1 x3 x3 |
z2 z1 z1 z3 z3 |
|
Е) х3 х2 х2 х1 х1 |
z3 z2 z2 z1 z1 |
Если y3 y2
y2 y1, то определите отношения между x1
y1, то определите отношения между x1 x2
x2 χ3 и z1
χ3 и z1 z2
z2 z3.
z3.
Решение:
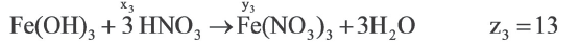
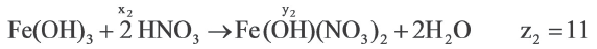
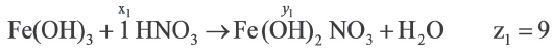
Ответ: E x3 x2
x2 x1 z3
x1 z3 z2
z2 z1
z1
- Кислоты в химии
- Соли в химии
- Хлор в химии
- Сера в химии
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Оксиды в химии
Методическая
разработка:
«Алгоритм
составления названий и формул оснований (гидроксидов)»
При изучении химии в 8 классе учащиеся
сталкиваются с затруднениями в названии химических веществ и составления формул
химических соединений. Для лучшего усвоения данного материала им помогут
«Алгоритмы» – краткая запись последовательности действий.
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ ОСНОВАНИЙ.
Основания – сложные химические вещества ,
состоящие из ионов металла связанных с гидроксогруппой (-ОН)
При названии оснований необходимо соблюдать
данную последовательность действий:
1. Дается
название последней части вещества – гидроксид.
2. Называется
металл, который связан с гидроксогруппой (-ОН), в родительном падеже (записан
перед гидроксогруппой).
3. Если
заряд металла переменный, в скобках указывается валентность металла.
Запомните: количество
гидроксогрупп равно заряду и валентности металла.
ПРИМЕР:
Fe( OH)2
гидроксид железа (ii)
Al(OH)3
гидроксид алюминия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ ОСНОВАНИЙ.
1.
Записываются символы металла и гидроксогруппы
(-ОН).
2.
Указывается заряд металла.
3.
Записывается индекс для гидроксогруппы. Если
заряд металла больше 1, гидроксогруппу заключают в скобки. Индекс указывается
за скобками.
ПРИМЕР:
Гидроксид
алюминия гидроксид меди (II)
1. Al OH
1.
Cu
OH
2. 3+
2.
2+
Al OH
Cu OH
3. Al
(OH)3
3. Cu
(OH)2
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:
 ,
,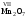
Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:
 ,
, ,
, ,
,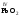 ,
,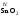 и др. Оксиды металлов свалентностью
и др. Оксиды металлов свалентностью
V,
VI,
VII
.являются
кислотными:
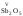 ,
, ,
, и
и
др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.

Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #