Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 июня 2020 года; проверки требуют 10 правок.
| Сульфат калия | ||
|---|---|---|
 |
||
|
||
| Общие | ||
| Систематическое наименование |
сульфат калия | |
| Традиционные названия | сернокислый калий | |
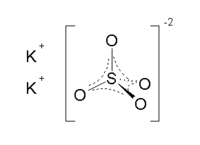
| Хим. формула | K2SO4 | |
| Физические свойства | ||
| Состояние | белое кристаллическое вещество | |
| Молярная масса | 174.252 г/моль | |
| Плотность | 2.66 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 1069 °C | |
| • кипения | 1689 °C | |
| • вспышки | негорюч °C | |
| Мол. теплоёмк. | 131,4 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −1437,7 кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде |
(20 °C) 11.1 г/100мл (25 °C) 12 г/100мл (100 °C) 24 г/100 мл |
|
| • в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 | |
| Структура | ||
| Кристаллическая структура | ромбическая | |
| Классификация | ||
| Рег. номер CAS | 7778-80-5 | |
| PubChem | 24507 | |
| Рег. номер EINECS | 231-915-5 | |
| SMILES |
[O-]S(=O)(=O)[O-].[K+].[K+] |
|
| InChI |
InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 OTYBMLCTZGSZBG-UHFFFAOYSA-L |
|
| Кодекс Алиментариус | E515(i) и E515 | |
| RTECS | TT5900000 | |
| ChEBI | 32036 | |
| ChemSpider | 22915 | |
| Безопасность | ||
| ЛД50 | 6600 мг/кг | |
| NFPA 704 |
0 1 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
История[править | править код]
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
Нахождение в природе[править | править код]
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Физические свойства[править | править код]
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam).
При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу.
Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Вкус горько-солёный[1].
Получение[править | править код]
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
- Каинит — MgSO4·KCl·H2O
- Глазерит — 2K2SO4·Na2SO4
- Шёнит — K2SO4·MgSO4·6H2O
- Леонит — K2SO4·MgSO4·4H2O
- Лангбейнит — K2SO4·2MgSO4
- Полигалит — K2SO4·MgSO4·2CaSO4·2H2O
- Сингенит — K2SO4·CaSO4·H2O
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
Наиболее чистый продукт получают, обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
Прокаливанием с углём минерала лангбейнита:
В лабораторной практике применяют следующие методы:
- из оксида калия:
- вытеснением из слабых или неустойчивых кислот:
- из щёлочи и разбавленной кислоты:
- из гидросульфата калия:
- окислением сульфида калия:
- из надперекиси калия:
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
Окисление серы бихроматом калия:
Взаимодействием сульфата аммония и гидроксид калия:
Химические свойства[править | править код]
Как соль двухосновной кислоты образует кислые соли:
Как все сульфаты взаимодействует с растворимыми соединениями бария:
Восстанавливается до сульфида:
С оксидом серы образует пиросульфат:
Применение[править | править код]
Основной потребитель сульфата калия — сельское хозяйство.
Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На чернозёмных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.[2]
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии.[3] В Европейском союзе допущен к использованию как пищевая добавка E515.
Сведения о безопасности[править | править код]
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.
Примечания[править | править код]
- ↑ E515 — Сульфаты калия (Е515). Дата обращения: 26 апреля 2020. Архивировано 25 сентября 2020 года.
- ↑ Информационный источник №1. Дата обращения: 28 марта 2010. Архивировано 16 октября 2011 года.
- ↑ Информационный источник №2. Дата обращения: 28 марта 2010. Архивировано 21 апреля 2012 года.
Физические свойства
Сульфат калия K2SO4 — соль щелочного металла калия и серной кислоты. Белый, термически устойчивый. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 174,26; относительная плотность для тв. и ж. состояния d = 2,662; tпл = 1074º C; tкип > 2000º C
Способ получения
1. В результате взаимодействия при надпероксида калия и серы образуется сульфат калия:
2KO2 + S = K2SO4
2. Оксид калия реагирует с оксидом серы. В результате реакции образуется сульфат калия:
K2O + SO3 = K2SO4
3. В результате реакции между гидроксидом калия и серной кислотой происходит образование сульфата калия и воды:
2KOH + H2SO4 = K2SO4 + 2H2O
4. Гидросульфат калия при 240 ºС разлагается с образованием сульфата калия и серной кислоты:
2KHSO4 = K2SO4 + H2SO4
5. При взаимодействии концентрированного гидроксида калия и гидросульфата калия образуется сульфат калия и вода:
KHSO4 + KOH = K2SO4 + H2O
6. Сульфат калия взаимодействует с хлоридом калия при 450–700º C с образованием сульфата калия и соляной кислоты:
KHSO4 + KCl = K2SO4 + HCl
7. Твердый хлорид калия реагирует с концентрированной серной кислотой в состоянии кипения. В результате реакции образуется сульфат калия и газ хлороводород:
2KCl + H2SO4 = K2SO4 + 2HCl↑
8. При температуре выше 500º С твердый сульфид калия взаимодействует с кислородом, образуя сульфат калия:
K2S + 2O2 = K2SO4
Качественная реакция
Качественная реакция на сульфат калия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат калия образует сульфат бария и хлорид калия:
K2SO4 + BaCl2 = BaSO4↓ + 2KCl
Химические свойства
1. Сульфат калия может реагировать с простыми веществами:
1.1. Сульфат калия реагирует с углеродом при температуре 900º C. При этом образуются сульфид калия и угарный газ:
K2SO4 + 4C = K2S + 4CO
1.2. С водородом сульфат калия реагирует при температуре 600º C, в присутствии катализатора Fe2O3 с образованием сульфида калия и воды:
K2SO4 + 4H2 = K2S + 4H2O
2. Сульфат калия вступает в реакцию со многими сложными веществами:
2.1. Сульфат калия взаимодействует с гидроксидами:
2.1.1. Сульфат калия реагирует с гидроксидом бария с образованием гидроксида калия и сульфата бария:
K2SO4 + Ba(OH)2 = BaSO4↓ + 2KOH
2.2. Сульфат калия может реагировать с кислотами:
2.2.1. При взаимодействии с концентрированной серной кислотой твердый сульфат калия образует гидросульфат калия:
K2SO4 + H2SO4 = 2KHSO4
2.3. Сульфат калия может взаимодействовать с оксидами:
2.3.1. Сульфат калия реагирует с оксидом серы (VI). Взаимодействие сульфата калия с оксидом серы (VI) приводит к образованию пиросульфата калия:
K2SO4 + SO3 = K2S2O7
2.4. Сульфат калия реагирует с солями:
2.4.1. Сульфат калия взаимодействует с хлоридом бария. При этом образуются хлорид калия и осадок сульфат бария:
K2SO4 + BaCl2 = BaSO4↓ + 2KCl
| Сульфат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
сульфат калия |
| Традиционные названия | сернокислый калий |
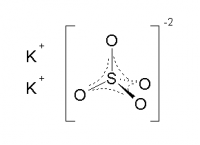
| Хим. формула | K2SO4 |
| Состояние | белое кристаллическое вещество |
| Молярная масса | 174.259 г/моль |
| Плотность | 2.66 г/см³ |
| Т. плав. | 1069 °C |
| Т. кип. | 1689 °C |
| Т. всп. | негорюч °C |
| Мол. теплоёмк. | 131,4 Дж/(моль·К) |
| Энтальпия образования | −1437,7 кДж/моль |
| Растворимость в воде |
(20 °C) 11.1 г/100 мл (25 °C) 12 г/100 мл (100 °C) 24 г/100 мл |
| Растворимость в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 |
| Кристаллическая структура | ромбическая |
| ГОСТ | ГОСТ 4568-95 ГОСТ 4145-74 |
| Рег. номер CAS | 7778-80-5 |
| PubChem | 24507 |
| Рег. номер EINECS | 231-915-5 |
| SMILES |
[O-]S(=O)(=O)[O-].[K+].[K+] |
| InChI |
1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 OTYBMLCTZGSZBG-UHFFFAOYSA-L |
| Кодекс Алиментариус | E515(i) |
| RTECS | TT5900000 |
| ChEBI | 32036 |
| ChemSpider | 22915 |
| ЛД50 | 6600 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
Содержание
- 1 История
- 2 Нахождение в природе
- 3 Физические свойства
- 4 Получение
- 5 Химические свойства
- 6 Применение
- 7 Сведения о безопасности
История
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
Нахождение в природе
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Физические свойства
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam). При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Вкус горько-солёный.
Получение
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
- Каинит — MgSO4·KCl·H2O
- Глазерит — 2K2SO4·Na2SO4
- Шёнит — K2SO4·MgSO4·6H2O
- Леонит — K2SO4·MgSO4·4H2O
- Лангбейнит — K2SO4·2MgSO4
- Полигалит — K2SO4·MgSO4·2CaSO4·2H2O
- Сингенит — K2SO4·CaSO4·H2O
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
- 2KCl + 2MgSO4 ⇄ K2SO4 ⋅ MgSO4 + MgCl2
- K2SO4 ⋅ MgSO4 + 2KCl ⇄ 2K2SO4 + MgCl2
- 2KCl + Na2SO4 ⇄ K2SO4+ 2NaCl
- 2KCl+ CaSO4 ⋅ 2H2O ⇄ K2SO4 + CaCl2 + 2H2O
- 2KCl + FeSO4 ⇄ K2SO4 + FeCl2
Наиболее чистый продукт получают, обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
- 2KCl + H2SO4 →>100oC K2SO4 + 2HCl↑
Прокаливанием с углём минерала лангбейнита:
- K2SO4 ⋅ 2MgSO4 + 2C →>T K2SO4 + 2Mg↓ + 2CO2↑ + 2SO2↑
В лабораторной практике применяют следующие методы:
- из оксида калия:
- K2O + H2SO4 → K2SO4 + H2O
- вытеснением из слабых или неустойчивых кислот:
- K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
- из щёлочи и разбавленной кислоты:
- 2KOH + H2SO4 → K2SO4 + 2H2O
- из гидросульфата калия:
- 2KHSO4 →240oC K2SO4 + H2SO4
- KHSO4 + KOH → K2SO4 + H2O
- 2KHSO4 + KCl →500oC K2SO4 + HCl↑
- окислением сульфида калия:
- K2S + 2O2 →>500oC K2SO4
- из надперекиси калия:
- 2KO2 + S →140oC K2SO4
- 2KO2 + SO2 →100oC K2SO4 + O2
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
- 4K2SO3 →600oC K2S + 3K2SO4
Окисление серы бихроматом калия:
- K2Cr2O7 + S →800−1000oC Cr2O3 + K2SO4
Взаимодействием сульфата аммония и гидроксид калия:
- (NH4)2SO4 + 2KOH → K2SO4 + 2NH3↑ + 2H2O
Химические свойства
Как соль двухосновной кислоты образует кислые соли:
- K2SO4 + H2SO4 ⇄ 2KHSO4
Как все сульфаты взаимодействует с растворимыми соединениями бария:
- K2SO4 + BaCl2 → 2KCl + BaSO4↓
Восстанавливается до сульфида:
- K2SO4 + 4H2 →600oC,Fe2O3 K2S + 4H2O
- K2SO4 + 4C →900oC K2S + 4CO
С оксидом серы образует пиросульфат:
- K2SO4+ SO3 → K2S2O7
Применение
Основной потребитель сульфата калия — сельское хозяйство. Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На черноземных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии. В Европейском союзе допущен в качестве использования как пищевая добавка E515.
Сведения о безопасности
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат калия
Брутто-формула:
K2O4S
CAS# 7778-80-5
Категории:
Неорганические соли
PubChem CID: 24507
| ChemSpider ID: 22915
| CHEBI:32036
| CHEMBL2021424
| CB9854321
Названия
Русский:
- Сернокислый калий
- Сульфат калия(IUPAC) [Wiki]
- калия сульфат
English:
- Dipotassium sulfate
- E 515
- Potassium sulfate [Wiki]
- Sulfuric acid dipotassium salt
- dipotassium;sulfate(IUPAC)
Варианты формулы:
K2SO4
K(+)2S(+6)O(-2)4
K^+O`^-/S<_qq4O><_pp4O>/O^-K^+
Вещества, имеющие отношение…
Анион:
Сульфаты
Химический состав
Реакции, в которых участвует Сульфат калия
-
5SO2 + 2KMnO4 + 2H2O -> 2H2SO4 + 2MnSO4 + K2SO4
-
8SO3^2- + 2KMnO4 -> 5SO4^2- + 2MnSO4 + K2SO4
-
2Cu(OH)2 + K2S2O6(O2) + 2KOH -> Cu2O3 + 2K2SO4 + 3H2O
-
2K2S2O6(O2) + 2H2O “80°C”–> 2K2SO4 + 2H2SO4 + O2″|^”
-
2AgNO3 + {M}2SO4 -> Ag2SO4 + 2{M}NO3
, где M =
Na K
И ещё 134 реакции…
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.































