Как научиться писать формулу карбоната
При выполнении заданий по химии, которые включают в себя тестирование, решение расчетных задач, практическую работу или лабораторный опыт могут понадобиться умения и навыки при написании формул солей. Таблица растворимости, в которой указаны значения зарядов ионов металлов и кислотных остатков, а также знание принципа ее использования поможет верно написать формулы и других веществ.

Вам понадобится
- – таблица растворимости солей, кислот, оснований
Инструкция
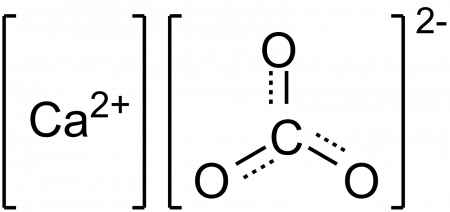
Карбонаты – это соли, состоящие из атомов металла и кислотного остатка, который имеет один атом углерода и три атома кислорода – СO3. Соли могут быть как средними – карбонаты, так и кислыми – гидрокарбонаты. Чтобы правильно написать формулу, необходимо воспользоваться таблицей растворимости кислот, солей и оснований, являющейся справочным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Карбонат-ион имеет заряд 2-. Чтобы формула соли была написана правильно, найдите, какой заряд имеет металл, который входит в состав карбоната. В любом случае, суммарное число положительных зарядов ионов должно равняться суммарному числу отрицательных. При этом необходимо обязательно учитывать индексы, стоящие внизу справа от химического символа. Значение заряда иона и индекса, стоящего у этого же иона, перемножаются.
Пример № 1. Напишите формулу карбоната калия.
В таблице растворимости посмотрите на кислотный остаток и на металл, входящий в состав соли. Кислотный остаток – СO3 имеет заряд 2-, а ион калия имеет заряд + (считается +1, но единица не пишется).
Напишите формулу, учитывая, что металл всегда стоит на первом месте: КСO3.
Если сравнить количество зарядов, то отрицательных получилось два (2-), а положительных только один (+). Значит, в формуле должно быть 2 атома калия, которые дадут два положительных заряда (2+), так как значение заряда и индекса перемножается. Следовательно, и молекула будет электронейтральна: К2СO3. Полученная соль называется карбонат калия.
Пример № 2. Напишите формулу карбоната кальция.
Кислотный остаток тот же, то есть – СO3 с зарядом (2-). В таблице растворимости найдите металл кальций и его заряд, который равен 2+ . Напишите формулу, имеющую вид: СаСO3. В итоге получилось одинаковое количество отрицательных (2-) и положительных 2(+) зарядов. Следовательно, формула написана правильно, так как в целом она электронейтральна. Полученная соль называется карбонат кальция, она знакома как мел или известняк.
Пример № 3. Напишите формулу гидрокарбоната калия.
Гидрокарбонат-иона в таблице растворимости нет, а потому следует запомнить, что он имеет вид – НСO3 и у него заряд, равный (-). Ион калия имеет противоположный заряд (+), поэтому формула будет выглядеть таким образом:
КНСO3.
Полученное соединение называется гидрокарбонат калия, которое представляет собой кислую соль.
Видео по теме
Источники:
- карбонат кальция формула
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 ноября 2021 года; проверки требуют 16 правок.
| Карбонат кальция | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
карбонат кальция | |
| Традиционные названия | карбонат кальция, углекислый кальций, арагонит, кальцит, известняк, мел, мрамор, фатерит | |
| Хим. формула | CaCO3 | |
| Рац. формула | CaCO3 | |
| Физические свойства | ||
| Состояние | твёрдые белые кристаллы | |
| Молярная масса | 100.0869 г/моль | |
| Плотность |
(кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
|
| Термические свойства | ||
| Температура | ||
| • плавления |
(кальцит) 825 °C, (арагонит) 1339 °C |
|
| • разложения | 900−1000 °C | |
| Энтальпия | ||
| • образования | -1206,9 кДж/моль | |
| Давление пара | 0 ± 1 мм рт.ст.[1] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
9.0 | |
| Растворимость | ||
| • в воде | (25 °C) 0,0014 г/100мл | |
| Оптические свойства | ||
| Показатель преломления | 1,60 | |
| Структура | ||
| Кристаллическая структура | тригональная, пространств. гр. 2/m | |
| Классификация | ||
| Рег. номер CAS | 471-34-1 | |
| PubChem | 10112 | |
| Рег. номер EINECS | 207-439-9 | |
| SMILES |
C(=O)([O-])[O-].[Ca+2] |
|
| InChI |
InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 VTYYLEPIZMXCLO-UHFFFAOYSA-L |
|
| Кодекс Алиментариус | E170 | |
| RTECS | FF9335000 | |
| ChEBI | 3311 | |
| ChemSpider | 9708 | |
| Безопасность | ||
| Предельная концентрация | 6 мг/дм3 | |
| ЛД50 | 6400 мг/кг | |
| Токсичность | Класс опасности 4 | |
| NFPA 704 |
0 0 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Карбона́т ка́льция (углеки́слый кальций, кальцит, арагонит, известняк, мел, мрамор) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула 
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц и пресмыкающихся, а также в состав раковин моллюсков и некоторых других беспозвоночных.
Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Применение[править | править код]
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование[править | править код]
Таблетки из карбоната кальция
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слёживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей[источник не указан 1657 дней].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и пигмента, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок[источник не указан 1657 дней].
В строительстве[править | править код]
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе[править | править код]
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
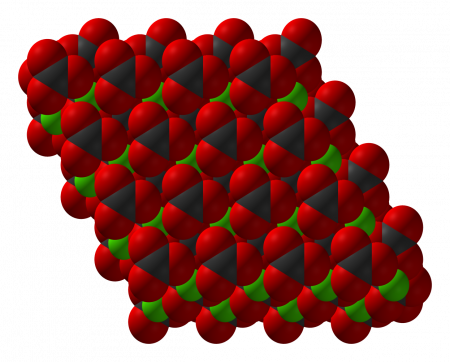
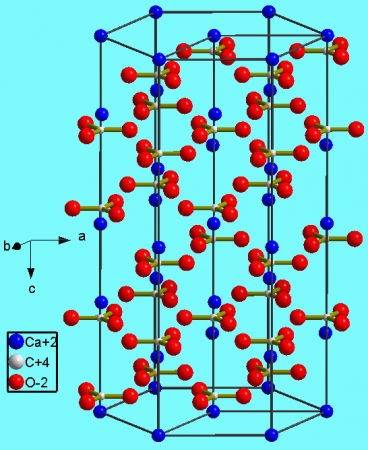
Тригональная кристаллическая структура кальцита является наиболее распространённой.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
- Доломит
-
Кальцит
-
Арагонит
-
Мрамор
-
Травертин
Геология[править | править код]
Залежи карбоната кальция в виде известняковых и меловых пластов — распространённое явление в земной коре. Они имеют органическое, реже хемогенное происхождение.
Органическое происхождение связано отложениями останков древних морских организмов: зоопланктона, моллюсков, кораллов и др., в основном, в меловой период.
Такие горные породы как известняк, мел, мрамор, травертин и другие известковые туфы практически полностью состоят из карбоната кальция с различными примесями.
В природе встречаются три кристаллические модификации карбоната кальция (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Кальцит является наиболее устойчивой и распространённой кристаллической модификацией карбоната кальция. Около 10 % всех осадочных пород составляют известняки, сложенные кальцитовыми останками раковин простейших морских организмов.
Арагонит является второй по устойчивости и распространённости кристаллической модификацией CaCO3. В основном формируется в раковинах моллюсков и скелетах кораллов. Также арагонит может образовываться при неорганических процессах (хемогенное происхождение), например, в карстовых пещерах или гидротермальных источниках в результате химического осаждения из водных растворов или при испарении воды.
Фатерит является наименее стабильной разновидностью карбоната кальция и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение[править | править код]
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашёной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
Химические свойства[править | править код]
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
.
Реагирует с сильными кислотами с вытеснением угольной кислоты, которая тут же разлагается на воду и углекислый газ:
Данная реакция используется для лабораторного получения углекислого газа в аппарате Киппа.
Безопасность[править | править код]
Карбонат кальция считается нетоксичным веществом. ПДК 180 мг/дм³ (в воде, с обязательным контролем по ионам кальция).
ЛД50 на крысах около 6400 мг/кг.
Одобрен Объединённым экспертным комитетом ФАО/ВОЗ по пищевым добавкам (JECFA) в качестве пищевой добавки в 1965 году[3]. Имеет номер E170[4] и номер INS 170. Используется в качестве регулятора кислотности, антислеживателя, стабилизатора или пищевого красителя и одобрен для использования в Европейском союзе[5], США[6], Австралии и Новой Зеландии[7]. Он «по закону добавляется ко всей муке грубого помола в Великобритании, кроме цельнозерновой»[8][9]. Он используется в некоторых продуктах из соевого молока и миндального молока в качестве источника диетического кальция; по крайней мере, одно исследование предполагает, что карбонат кальция может быть таким же биодоступным, как кальций в коровьем молоке[10]. Карбонат кальция также используется в качестве укрепляющего агента во многих консервированных и бутилированных овощных продуктах.
Примечания[править | править код]
- ↑ http://www.cdc.gov/niosh/npg/npgd0090.html
- ↑ Solvay Precipitated Calcium Carbonate: Production. Solvay S. A. (9 марта 2007). Архивировано 9 февраля 2012 года.
- ↑ World Health Organization. CALCIUM CARBONATE // Joint FAO/WHO Expert Committee on Food Additives. Архивировано 26 июня 2022 года.
- ↑ E-numbers: E170 Calcium carbonate. Food-Info.net. Дата обращения: 14 октября 2022. Архивировано 14 октября 2022 года. 080419 food-info.net
- ↑ Current EU approved additives and their E Numbers. UK Food Standards Agency. Дата обращения: 27 октября 2011. Архивировано 7 октября 2010 года.
- ↑ Listing of Food Additives Status Part I. US Food and Drug Administration. Дата обращения: 27 октября 2011. Архивировано 14 марта 2013 года.
- ↑ Standard 1.2.4 – Labelling of ingredients. Australia New Zealand Food Standards Code. Дата обращения: 27 октября 2011. Архивировано 2 сентября 2013 года.
- ↑ Why go organic?, Real Bread Campaign. Архивировано 14 октября 2022 года. Дата обращения: 14 октября 2022.
- ↑ Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply, Department for Environment, Food and Rural Affairs (August 2013). Архивировано 19 сентября 2021 года. Дата обращения: 14 октября 2022.
- ↑ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). “Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow’s milk in young women”. The Journal of Nutrition. 135 (10): 2379—2382. DOI:10.1093/jn/135.10.2379. PMID 16177199.
Литература[править | править код]
- Calcium Carbonate : [англ.] : [арх. 17 октября 2007] / National Institutes of Health // Medline Plus. — 2005. — 1 October. — Revised: Sep 15, 2015.
- А.И. Врублевский Основы химии
Ссылки[править | править код]
- Краситель е170 – Карбонат кальция : [арх. 26 октября 2010] // Факты о здоровой пище. — 2009.
Определение и формула
Неорганическое соединение, соль угольной кислоты и кальция
Альтернативное название
Кальций углекислый
Формула
СаСО3
Свойства карбоната кальция
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Белые кристаллы |
| Молярная масса | 100,087г/моль |
| Плотность | 2,711 г/см3 (кальцит) 2,947 г/см3 (арагонит) 2,645 г/см3 (фатерит) |
| Температура плавления | 1339°С (арагонит, под давл. в атм. СО2) |
| Температура разложения | 875°С |
| Показатель преломления | 1,60 |
| Растворимость | 18°С, 0,0014 г/100 г воды (безв.) |
Получение
Естественные способы получения
Карбонат кальция – основная составная часть осадочных пород, природные запасы его огромны.
Встречается в виде трех модификаций:
- кальцит (известняк, мел, мрамор);
- арагонит;
- фатерит или ватерит.
Эти три модификации различаются строением и формой кристаллов.
Фатерит образовался из раковин древних моллюсков, по мере старения он превращается в арагонит, а тот в свою очередь через 10-100 млн лет превращается в кальцит.
Жемчуг состоит из арагонита. Сталактиты и сталагмиты в пещерах сложены из травертина – мелкозернистой горной породы, состоящей из арагонита с примесью кальцита.
Прозрачная крупнокристаллическая разновидность известна под название исландского шпата. Он обладает двойным лучепреломлением. Крупные кристаллы либо бесцветны, либо имеют бледный голубой, розовый или желтый оттенок в зависимости от примесей магния, марганца или железа, реже – бария, стронция или свинца.
Получение в промышленности
Ввиду неисчерпаемости запасов кальцита в природе нужда в промышленном получении карбоната кальция почти отсутствует. Тем не менее для производства зубных паст и косметических средств, а также пищевых добавок и нужд фармацевтической промышленности, получают так называемый осажденный карбонат кальция, обладающий высокой дисперсностью. Получают его из хлорида кальция и кальцинированной соды:
CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl.
Этим же способом можно получить карбонат кальция и в лаборатории. Кроме того, его можно получить при пропускании углекислого газа через известковую воду:
Са(ОН)2 + СО2 = СаСО3 ↓ + Н2О.
Химические свойства
При взаимодействии с сильными кислотами выделяется диоксид углерода:
СаСО3 + 2HCl = CaCl2 + H2O + CO2↑.
При нагревании выше 875°С разлагается на оксид кальция (негашеную известь) и углекислый газ:
СаСО3 = СаО + СО2↑.
Применение
- Карбонат кальция в виде известняка или мрамора применяется как строительный материал. Входит он и в состав всевозможных строительных смесей и шпатлевок, черепицы, линолеума.
- В сельском хозяйстве применяют мел или известняк для снижения кислотности почвы.
- Около половины очищенного от примесей карбоната кальция используется в производстве пластмасс, где он применяется в качестве наполнителя. Много его потребляет стекольная промышленность. Карбонат кальция в качестве наполнителя используется в производстве красок.
- В пищевой промышленности он известен как пищевая добавка Е170 применяемая как пищевой краситель, раскислитель и средство для предотвращения слеживаемости.
- В медицине его применяют для снижения кислотности желудочного сока, а также при недостатке кальция у беременных, при остеопорозе, рахите и кариесе. При умеренном употреблении (не более 1,5 г в сутки) карбонат кальция безвреден.
- Противопоказан при тромбофлебите и атеросклерозе.
Пример решения задачи
Сколько л углекислого газа выделится при взаимодействии 400 г карбоната кальция с соляной кислотой?
Решение
100 г – х л
СаСО3 + 2HCl = CaCl2 + H2O + CO2↑.
1 моль – 1 моль
40 + 12 + 3·16 г – 22,4 л
100 г – 22,4 л
Составляем пропорцию:
100 г СаСО3 – 22,4 л CO2,
400 г СаСО3 – х л CO2.
Отсюда:
х= (400*22,4)/100 = 89,6 л.
Ответ: 89,6 л.
Тест по теме «Карбонат кальция»
|
||

|
||
| Names | ||
|---|---|---|
| IUPAC name
Calcium carbonate |
||
| Other names
Aragonite; calcite; chalk; lime; limestone; marble; oyster; pearl |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.006.765 |
|
| EC Number |
|
|
| E number | E170 (colours) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
CaCO3 | |
| Molar mass | 100.0869 g/mol | |
| Appearance | Fine white powder; chalky taste | |
| Odor | odorless | |
| Density | 2.711 g/cm3 (calcite) 2.83 g/cm3 (aragonite) |
|
| Melting point | 1,339 °C (2,442 °F; 1,612 K) (calcite) 825 °C (1,517 °F; 1,098 K) (aragonite)[4][5] |
|
| Boiling point | decomposes | |
|
Solubility in water |
0.013 g/L (25 °C)[1][2] | |
|
Solubility product (Ksp) |
3.3×10−9[3] | |
| Solubility in dilute acids | soluble | |
| Acidity (pKa) | 9.0 | |
|
Magnetic susceptibility (χ) |
−3.82×10−5 cm3/mol | |
|
Refractive index (nD) |
1.59 | |
| Structure | ||
|
Crystal structure |
Trigonal | |
|
Space group |
32/m | |
| Thermochemistry | ||
|
Std molar |
93 J·mol−1·K−1[6] | |
|
Std enthalpy of |
−1207 kJ·mol−1[6] | |
| Pharmacology | ||
|
ATC code |
A02AC01 (WHO) A12AA04 (WHO) | |
| Hazards | ||
| NFPA 704 (fire diamond) |
0 0 0 |
|
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
6450 mg/kg (oral, rat) | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[7] | |
| Safety data sheet (SDS) | ICSC 1193 | |
| Related compounds | ||
|
Other anions |
Calcium bicarbonate | |
|
Other cations |
Beryllium carbonate Magnesium carbonate Strontium carbonate Barium carbonate Radium carbonate |
|
|
Related compounds |
Calcium sulfate | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Crystal structure of calcite
Calcium carbonate is a chemical compound with the chemical formula CaCO3. It is a common substance found in rocks as the minerals calcite and aragonite, most notably in chalk and limestone, eggshells, gastropod shells, shellfish skeletons and pearls. Materials containing much calcium carbonate or resembling it are described as calcareous. Calcium carbonate is the active ingredient in agricultural lime and is created when calcium ions in hard water react with carbonate ions to create limescale. It has medical use as a calcium supplement or as an antacid, but excessive consumption can be hazardous and cause hypercalcemia and digestive issues.[8]
Chemistry[edit]
Calcium carbonate shares the typical properties of other carbonates. Notably it
- reacts with acids, releasing carbon dioxide (technically speaking, carbonic acid, but that disintegrates quickly to CO2 and H2O):
- releases carbon dioxide upon heating, called a thermal decomposition reaction, or calcination (to above 840 °C in the case of CaCO3), to form calcium oxide, CaO, commonly called quicklime, with reaction enthalpy 178 kJ/mol:
Calcium carbonate reacts with water that is saturated with carbon dioxide to form the soluble calcium bicarbonate.
This reaction is important in the erosion of carbonate rock, forming caverns, and leads to hard water in many regions.
An unusual form of calcium carbonate is the hexahydrate ikaite, CaCO3·6H2O. Ikaite is stable only below 8 °C.
Preparation[edit]
The vast majority of calcium carbonate used in industry is extracted by mining or quarrying. Pure calcium carbonate (such as for food or pharmaceutical use), can be produced from a pure quarried source (usually marble).
Alternatively, calcium carbonate is prepared from calcium oxide. Water is added to give calcium hydroxide then carbon dioxide is passed through this solution to precipitate the desired calcium carbonate, referred to in the industry as precipitated calcium carbonate (PCC) This process is called carbonatation:[9]
In a laboratory, calcium carbonate can easily be crystallized from calcium chloride (CaCl2), by placing an aqueous solution of CaCl2 in a desiccator alongside ammonium carbonate (NH4)2CO3.[10] In the desiccator, ammonium carbonate is exposed to air and decomposes into ammonia, carbon dioxide, and water. The carbon dioxide then diffuses into the aqueous solution of calcium chloride, reacts with the calcium ions and the water, and forms calcium carbonate.
Structure[edit]
The thermodynamically stable form of CaCO3 under normal conditions is hexagonal β-CaCO3 (the mineral calcite).[11] Other forms can be prepared, the denser (2.83 g/cm3) orthorhombic λ-CaCO3 (the mineral aragonite) and hexagonal μ-CaCO3, occurring as the mineral vaterite.[11] The aragonite form can be prepared by precipitation at temperatures above 85 °C; the vaterite form can be prepared by precipitation at 60 °C.[11] Calcite contains calcium atoms coordinated by six oxygen atoms; in aragonite they are coordinated by nine oxygen atoms.[11] The vaterite structure is not fully understood.[12] Magnesium carbonate (MgCO3) has the calcite structure, whereas strontium carbonate (SrCO3) and barium carbonate (BaCO3) adopt the aragonite structure, reflecting their larger ionic radii.[11]
Polymorphs[edit]
Calcium carbonate crystallizes in three anhydrous polymorphs,[13][14] of which calcite is the thermodynamically most stable at room temperature, aragonite is only slightly less so, and vaterite is the least stable.[15]
Crystal Structure[edit]
The calcite crystal structure is trigonal, with space group 




Crystallization[edit]
Crystal Structure of Calcite and Aragonite
All three polymorphs crystallize simultaneously from aqueous solutions under ambient conditions.[15] In additive-free aqueous solutions, calcite forms easily as the major product, while aragonite appears only as a minor product.
At high saturation, vaterite is typically the first phase precipitated, which is followed by a transformation of the vaterite to calcite.[20] This behavior seems to follow Ostwald’s rule, in which the least stable polymorph crystallizes first, followed by the crystallization of different polymorphs via a sequence of increasingly stable phases.[21] However, aragonite, whose stability lies between those of vaterite and calcite, seems to be the exception to this rule, as aragonite does not form as a precursor to calcite under ambient conditions.[15]
Microscopic Calcite and Vaterite
Aragonite occurs in majority when the reaction conditions inhibit the formation of calcite and/or promote the nucleation of aragonite. For example, the formation of aragonite is promoted by the presence of magnesium ions,[22] or by using proteins and peptides derived from biological calcium carbonate.[23] Some polyamines such as cadaverine and Poly(ethylene imine) have been shown to facilitate the formation of aragonite over calcite.[15]
Selection by organisms[edit]
Organisms, such as molluscs and arthropods, have shown the ability to grow all three crystal polymorphs of calcium carbonate, mainly as protection (shells) and muscle attachments.[24] Moreover, they exhibit a remarkable capability of phase selection over calcite and aragonite, and some organisms can switch between the two polymorphs. The ability of phase selection is usually attributed to the use of specific macromolecules or combinations of macromolecules by such organisms.[25][26][27]
Occurrence[edit]
Geological sources[edit]
Calcite, aragonite and vaterite are pure calcium carbonate minerals. Industrially important source rocks which are predominantly calcium carbonate include limestone, chalk, marble and travertine.
Biological sources[edit]
Eggshells, snail shells and most seashells are predominantly calcium carbonate and can be used as industrial sources of that chemical.[29] Oyster shells have enjoyed recent recognition as a source of dietary calcium, but are also a practical industrial source.[30][31] Dark green vegetables such as broccoli and kale contain dietarily significant amounts of calcium carbonate, but they are not practical as an industrial source.[32]
[edit]
Beyond Earth, strong evidence suggests the presence of calcium carbonate on Mars. Signs of calcium carbonate have been detected at more than one location (notably at Gusev and Huygens craters). This provides some evidence for the past presence of liquid water.[33][34]
Geology[edit]
Surface precipitation of
CaCO3 as tufa in Rubaksa, Ethiopia
Carbonate is found frequently in geologic settings and constitutes an enormous carbon reservoir. Calcium carbonate occurs as aragonite, calcite and dolomite as significant constituents of the calcium cycle. The carbonate minerals form the rock types: limestone, chalk, marble, travertine, tufa, and others.
In warm, clear tropical waters corals are more abundant than towards the poles where the waters are cold. Calcium carbonate contributors, including plankton (such as coccoliths and planktic foraminifera), coralline algae, sponges, brachiopods, echinoderms, bryozoa and mollusks, are typically found in shallow water environments where sunlight and filterable food are more abundant. Cold-water carbonates do exist at higher latitudes but have a very slow growth rate. The calcification processes are changed by ocean acidification.
Where the oceanic crust is subducted under a continental plate sediments will be carried down to warmer zones in the asthenosphere and lithosphere. Under these conditions calcium carbonate decomposes to produce carbon dioxide which, along with other gases, give rise to explosive volcanic eruptions.
Carbonate compensation depth[edit]
The carbonate compensation depth (CCD) is the point in the ocean where the rate of precipitation of calcium carbonate is balanced by the rate of dissolution due to the conditions present. Deep in the ocean, the temperature drops and pressure increases. Calcium carbonate is unusual in that its solubility increases with decreasing temperature.[35] Increasing pressure also increases the solubility of calcium carbonate. The carbonate compensation depth can range from 4,000 to 6,000 meters below sea level.
Role in taphonomy[edit]
Calcium carbonate can preserve fossils through permineralization. Most of the vertebrate fossils of the Two Medicine Formation—a geologic formation known for its duck-billed dinosaur eggs—are preserved by CaCO3 permineralization.[36] This type of preservation conserves high levels of detail, even down to the microscopic level. However, it also leaves specimens vulnerable to weathering when exposed to the surface.[36]
Trilobite populations were once thought to have composed the majority of aquatic life during the Cambrian, due to the fact that their calcium carbonate-rich shells were more easily preserved than those of other species,[37] which had purely chitinous shells.
Uses[edit]
Construction[edit]
The main use of calcium carbonate is in the construction industry, either as a building material, or limestone aggregate for road building, as an ingredient of cement, or as the starting material for the preparation of builders’ lime by burning in a kiln. However, because of weathering mainly caused by acid rain,[38] calcium carbonate (in limestone form) is no longer used for building purposes on its own, but only as a raw primary substance for building materials.
Calcium carbonate is also used in the purification of iron from iron ore in a blast furnace. The carbonate is calcined in situ to give calcium oxide, which forms a slag with various impurities present, and separates from the purified iron.[39]
In the oil industry, calcium carbonate is added to drilling fluids as a formation-bridging and filtercake-sealing agent; it is also a weighting material which increases the density of drilling fluids to control the downhole pressure. Calcium carbonate is added to swimming pools, as a pH corrector for maintaining alkalinity and offsetting the acidic properties of the disinfectant agent.[40]
It is also used as a raw material in the refining of sugar from sugar beet; it is calcined in a kiln with anthracite to produce calcium oxide and carbon dioxide. This burnt lime is then slaked in fresh water to produce a calcium hydroxide suspension for the precipitation of impurities in raw juice during carbonatation.[41]
Calcium carbonate in the form of chalk has traditionally been a major component of blackboard chalk. However, modern manufactured chalk is mostly gypsum, hydrated calcium sulfate CaSO4·2H2O. Calcium carbonate is a main source for growing biorock. Precipitated calcium carbonate (PCC), pre-dispersed in slurry form, is a common filler material for latex gloves with the aim of achieving maximum saving in material and production costs.[42]
Fine ground calcium carbonate (GCC) is an essential ingredient in the microporous film used in diapers and some building films, as the pores are nucleated around the calcium carbonate particles during the manufacture of the film by biaxial stretching. GCC and PCC are used as a filler in paper because they are cheaper than wood fiber. Printing and writing paper can contain 10–20% calcium carbonate. In North America, calcium carbonate has begun to replace kaolin in the production of glossy paper. Europe has been practicing this as alkaline papermaking or acid-free papermaking for some decades. PCC used for paper filling and paper coatings is precipitated and prepared in a variety of shapes and sizes having characteristic narrow particle size distributions and equivalent spherical diameters of 0.4 to 3 micrometers.[citation needed]
Calcium carbonate is widely used as an extender in paints,[43] in particular matte emulsion paint where typically 30% by weight of the paint is either chalk or marble. It is also a popular filler in plastics.[43] Some typical examples include around 15 to 20% loading of chalk in unplasticized polyvinyl chloride (uPVC) drainpipes, 5% to 15% loading of stearate-coated chalk or marble in uPVC window profile. PVC cables can use calcium carbonate at loadings of up to 70 phr (parts per hundred parts of resin) to improve mechanical properties (tensile strength and elongation) and electrical properties (volume resistivity).[citation needed] Polypropylene compounds are often filled with calcium carbonate to increase rigidity, a requirement that becomes important at high usage temperatures.[44] Here the percentage is often 20–40%. It also routinely used as a filler in thermosetting resins (sheet and bulk molding compounds)[44] and has also been mixed with ABS, and other ingredients, to form some types of compression molded “clay” poker chips.[45] Precipitated calcium carbonate, made by dropping calcium oxide into water, is used by itself or with additives as a white paint, known as whitewashing.[46][47]
Calcium carbonate is added to a wide range of trade and do it yourself adhesives, sealants, and decorating fillers.[43] Ceramic tile adhesives typically contain 70% to 80% limestone. Decorating crack fillers contain similar levels of marble or dolomite. It is also mixed with putty in setting stained glass windows, and as a resist to prevent glass from sticking to kiln shelves when firing glazes and paints at high temperature.[48][49][50][51]
In ceramic glaze applications, calcium carbonate is known as whiting,[43] and is a common ingredient for many glazes in its white powdered form. When a glaze containing this material is fired in a kiln, the whiting acts as a flux material in the glaze. Ground calcium carbonate is an abrasive (both as scouring powder and as an ingredient of household scouring creams), in particular in its calcite form, which has the relatively low hardness level of 3 on the Mohs scale, and will therefore not scratch glass and most other ceramics, enamel, bronze, iron, and steel, and have a moderate effect on softer metals like aluminium and copper. A paste made from calcium carbonate and deionized water can be used to clean tarnish on silver.[52]
Health and diet[edit]
500-milligram calcium supplements made from calcium carbonate
Calcium carbonate is widely used medicinally as an inexpensive dietary calcium supplement for gastric antacid[53] (such as Tums and Eno). It may be used as a phosphate binder for the treatment of hyperphosphatemia (primarily in patients with chronic kidney failure). It is used in the pharmaceutical industry as an inert filler for tablets and other pharmaceuticals.[54]
Calcium carbonate is used in the production of calcium oxide as well as toothpaste and has seen a resurgence as a food preservative and color retainer, when used in or with products such as organic apples.[55]
Calcium carbonate is used therapeutically as phosphate binder in patients on maintenance haemodialysis. It is the most common form of phosphate binder prescribed, particularly in non-dialysis chronic kidney disease. Calcium carbonate is the most commonly used phosphate binder, but clinicians are increasingly prescribing the more expensive, non-calcium-based phosphate binders, particularly sevelamer.
Excess calcium from supplements, fortified food, and high-calcium diets can cause milk-alkali syndrome, which has serious toxicity and can be fatal. In 1915, Bertram Sippy introduced the “Sippy regimen” of hourly ingestion of milk and cream, and the gradual addition of eggs and cooked cereal, for 10 days, combined with alkaline powders, which provided symptomatic relief for peptic ulcer disease. Over the next several decades, the Sippy regimen resulted in kidney failure, alkalosis, and hypercalcaemia, mostly in men with peptic ulcer disease. These adverse effects were reversed when the regimen stopped, but it was fatal in some patients with protracted vomiting. Milk-alkali syndrome declined in men after effective treatments for peptic ulcer disease arose. Since the 1990s it has been most frequently reported in women taking calcium supplements above the recommended range of 1.2 to 1.5 grams daily, for prevention and treatment of osteoporosis,[56][57] and is exacerbated by dehydration. Calcium has been added to over-the-counter products, which contributes to inadvertent excessive intake. Excessive calcium intake can lead to hypercalcemia, complications of which include vomiting, abdominal pain and altered mental status.[58]
As a food additive it is designated E170,[59] and it has an INS number of 170. Used as an acidity regulator, anticaking agent, stabilizer or color it is approved for usage in the EU,[60] US[61] and Australia and New Zealand.[62] It is “added by law to all UK milled bread flour except wholemeal”.[63][64] It is used in some soy milk and almond milk products as a source of dietary calcium; at least one study suggests that calcium carbonate might be as bioavailable as the calcium in cow’s milk.[65] Calcium carbonate is also used as a firming agent in many canned and bottled vegetable products.
Several calcium supplement formulations have been documented to contain the chemical element lead,[66] posing a public health concern.[67] Lead is commonly found in natural sources of calcium.[66]
Agriculture and aquaculture[edit]
Agricultural lime, powdered chalk or limestone, is used as a cheap method for neutralising acidic soil, making it suitable for planting, also used in aquaculture industry for pH regulation of pond soil before initiating culture.[68]
Household cleaning[edit]
Calcium carbonate is a key ingredient in many household cleaning powders like Comet and is used as a scrubbing agent.
Pollution mitigation[edit]
In 1989, a researcher, Ken Simmons, introduced CaCO3 into the Whetstone Brook in Massachusetts.[69] His hope was that the calcium carbonate would counter the acid in the stream from acid rain and save the trout that had ceased to spawn. Although his experiment was a success, it did increase the amount of aluminium ions in the area of the brook that was not treated with the limestone. This shows that CaCO3 can be added to neutralize the effects of acid rain in river ecosystems. Currently calcium carbonate is used to neutralize acidic conditions in both soil and water.[70][71][72] Since the 1970s, such liming has been practiced on a large scale in Sweden to mitigate acidification and several thousand lakes and streams are limed repeatedly.[73]
Calcium carbonate is also used in flue gas desulfurisation applications eliminating harmful SO2 and NO2 emissions from coal and other fossil fuels burnt in large fossil fuel power stations.[70]
Calcination equilibrium[edit]
Calcination of limestone using charcoal fires to produce quicklime has been practiced since antiquity by cultures all over the world. The temperature at which limestone yields calcium oxide is usually given as 825 °C, but stating an absolute threshold is misleading. Calcium carbonate exists in equilibrium with calcium oxide and carbon dioxide at any temperature. At each temperature there is a partial pressure of carbon dioxide that is in equilibrium with calcium carbonate. At room temperature the equilibrium overwhelmingly favors calcium carbonate, because the equilibrium CO2 pressure is only a tiny fraction of the partial CO2 pressure in air, which is about 0.035 kPa.
At temperatures above 550 °C the equilibrium CO2 pressure begins to exceed the CO2 pressure in air. So above 550 °C, calcium carbonate begins to outgas CO2 into air. However, in a charcoal fired kiln, the concentration of CO2 will be much higher than it is in air. Indeed, if all the oxygen in the kiln is consumed in the fire, then the partial pressure of CO2 in the kiln can be as high as 20 kPa.[74]
The table shows that this partial pressure is not achieved until the temperature is nearly 800 °C. For the outgassing of CO2 from calcium carbonate to happen at an economically useful rate, the equilibrium pressure must significantly exceed the ambient pressure of CO2. And for it to happen rapidly, the equilibrium pressure must exceed total atmospheric pressure of 101 kPa, which happens at 898 °C.
-
Equilibrium pressure of CO2 over CaCO3 (P) versus temperature (T).[75]
P (kPa) 0.055 0.13 0.31 1.80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 T (°C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Solubility[edit]
With varying CO2 pressure[edit]
Calcium carbonate is poorly soluble in pure water (47 mg/L at normal atmospheric CO2 partial pressure as shown below).
The equilibrium of its solution is given by the equation (with dissolved calcium carbonate on the right):
-
CaCO3 ⇌ Ca2+ + CO2−3 Ksp = 3.7×10−9 to 8.7×10−9 at 25 °C
where the solubility product for [Ca2+][CO2−3] is given as anywhere from Ksp = 3.7×10−9 to Ksp = 8.7×10−9 at 25 °C, depending upon the data source.[75][76] What the equation means is that the product of molar concentration of calcium ions (moles of dissolved Ca2+ per liter of solution) with the molar concentration of dissolved CO2−3 cannot exceed the value of Ksp. This seemingly simple solubility equation, however, must be taken along with the more complicated equilibrium of carbon dioxide with water (see carbonic acid). Some of the CO2−3 combines with H+ in the solution according to
-
HCO−3 ⇌ H+ + CO2−3 Ka2 = 5.61×10−11 at 25 °C
HCO−3 is known as the bicarbonate ion. Calcium bicarbonate is many times more soluble in water than calcium carbonate—indeed it exists only in solution.
Some of the HCO−3 combines with H+ in solution according to
-
H2CO3 ⇌ H+ + HCO−3 Ka1 = 2.5×10−4 at 25 °C
Some of the H2CO3 breaks up into water and dissolved carbon dioxide according to
-
H2O + CO2(aq) ⇌ H2CO3 Kh = 1.70×10−3 at 25 °C
And dissolved carbon dioxide is in equilibrium with atmospheric carbon dioxide according to
-
PCO2/[CO2] = kH where kH = 29.76 atm/(mol/L) at 25 °C (Henry constant), PCO2 being the CO2 partial pressure.
For ambient air, PCO2 is around 3.5×10−4 atmospheres (or equivalently 35 Pa). The last equation above fixes the concentration of dissolved CO2 as a function of PCO2, independent of the concentration of dissolved CaCO3. At atmospheric partial pressure of CO2, dissolved CO2 concentration is 1.2×10−5 moles per liter. The equation before that fixes the concentration of H2CO3 as a function of CO2 concentration. For [CO2] = 1.2×10−5, it results in [H2CO3] = 2.0×10−8 moles per liter. When [H2CO3] is known, the remaining three equations together with
| PCO2 (atm) | pH | [Ca2+] (mol/L) |
|---|---|---|
| 10−12 | 12.0 | 5.19×10−3 |
| 10−10 | 11.3 | 1.12×10−3 |
| 10−8 | 10.7 | 2.55×10−4 |
| 10−6 | 9.83 | 1.20×10−4 |
| 10−4 | 8.62 | 3.16×10−4 |
| 3.5×10−4 | 8.27 | 4.70×10−4 |
| 10−3 | 7.96 | 6.62×10−4 |
| 10−2 | 7.30 | 1.42×10−3 |
| 10−1 | 6.63 | 3.05×10−3 |
| 1 | 5.96 | 6.58×10−3 |
| 10 | 5.30 | 1.42×10−2 |
-
H2O ⇌ H+ + OH− K = 10−14 at 25 °C
(which is true for all aqueous solutions), and the fact that the solution must be electrically neutral, i.e., the overall charge of dissolved positive ions [Ca2+] + 2 [H+] must be cancelled out by the overall charge of dissolved negative ions [HCO−3] + [CO2−3] + [OH−], make it possible to solve simultaneously for the remaining five unknown concentrations (note that the previously mentioned form of the neutrality is valid only if calcium carbonate has been put in contact with pure water or with a neutral pH solution; in the case where the initial water solvent pH is not neutral, the balance is not neutral).
The adjacent table shows the result for [Ca2+] and [H+] (in the form of pH) as a function of ambient partial pressure of CO2 (Ksp = 4.47×10−9 has been taken for the calculation).
- At atmospheric levels of ambient CO2 the table indicates that the solution will be slightly alkaline with a maximum CaCO3 solubility of 47 mg/L.
- As ambient CO2 partial pressure is reduced below atmospheric levels, the solution becomes more and more alkaline. At extremely low PCO2, dissolved CO2, bicarbonate ion, and carbonate ion largely evaporate from the solution, leaving a highly alkaline solution of calcium hydroxide, which is more soluble than CaCO3. Note that for PCO2 = 10−12 atm, the [Ca2+][OH−]2 product is still below the solubility product of Ca(OH)2 (8×10−6). For still lower CO2 pressure, Ca(OH)2 precipitation will occur before CaCO3 precipitation.
- As ambient CO2 partial pressure increases to levels above atmospheric, pH drops, and much of the carbonate ion is converted to bicarbonate ion, which results in higher solubility of Ca2+.
The effect of the latter is especially evident in day-to-day life of people who have hard water. Water in aquifers underground can be exposed to levels of CO2 much higher than atmospheric. As such water percolates through calcium carbonate rock, the CaCO3 dissolves according to the second trend. When that same water then emerges from the tap, in time it comes into equilibrium with CO2 levels in the air by outgassing its excess CO2. The calcium carbonate becomes less soluble as a result, and the excess precipitates as lime scale. This same process is responsible for the formation of stalactites and stalagmites in limestone caves.
Two hydrated phases of calcium carbonate, monohydrocalcite CaCO3·H2O and ikaite CaCO3·6H2O, may precipitate from water at ambient conditions and persist as metastable phases.
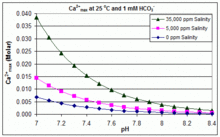
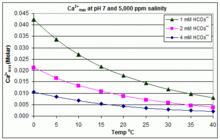
With varying pH, temperature and salinity: CaCO3 scaling in swimming pools[edit]
In contrast to the open equilibrium scenario above, many swimming pools are managed by addition of sodium bicarbonate (NaHCO3) to about 2 mM as a buffer, then control of pH through use of HCl, NaHSO4, Na2CO3, NaOH or chlorine formulations that are acidic or basic. In this situation, dissolved inorganic carbon (total inorganic carbon) is far from equilibrium with atmospheric CO2. Progress towards equilibrium through outgassing of CO2 is slowed by
- the slow reaction
- H2CO3 ⇌ CO2(aq) + H2O;[77]
- limited aeration in a deep water column; and
- periodic replenishment of bicarbonate to maintain buffer capacity (often estimated through measurement of total alkalinity).
In this situation, the dissociation constants for the much faster reactions
- H2CO3 ⇌ H+ + HCO−3 ⇌ 2 H+ + CO2−3
allow the prediction of concentrations of each dissolved inorganic carbon species in solution, from the added concentration of HCO−3 (which constitutes more than 90% of Bjerrum plot species from pH 7 to pH 8 at 25 °C in fresh water).[78] Addition of HCO−3 will increase CO2−3 concentration at any pH. Rearranging the equations given above, we can see that [Ca2+] = Ksp/[CO2−3], and [CO2−3] = Ka2 [HCO−3]/[H+]. Therefore, when HCO−3 concentration is known, the maximum concentration of Ca2+ ions before scaling through CaCO3 precipitation can be predicted from the formula:
- [Ca2+]max = Ksp/Ka2 × [H+]/[HCO−3]
The solubility product for CaCO3 (Ksp) and the dissociation constants for the dissolved inorganic carbon species (including Ka2) are all substantially affected by temperature and salinity,[78] with the overall effect that [Ca2+]max increases from freshwater to saltwater, and decreases with rising temperature, pH, or added bicarbonate level, as illustrated in the accompanying graphs.
The trends are illustrative for pool management, but whether scaling occurs also depends on other factors including interactions with Mg2+, [B(OH)4]− and other ions in the pool, as well as supersaturation effects.[79][80] Scaling is commonly observed in electrolytic chlorine generators, where there is a high pH near the cathode surface and scale deposition further increases temperature. This is one reason that some pool operators prefer borate over bicarbonate as the primary pH buffer, and avoid the use of pool chemicals containing calcium.[81]
Solubility in a strong or weak acid solution[edit]
Solutions of strong (HCl), moderately strong (sulfamic) or weak (acetic, citric, sorbic, lactic, phosphoric) acids are commercially available. They are commonly used as descaling agents to remove limescale deposits. The maximum amount of CaCO3 that can be “dissolved” by one liter of an acid solution can be calculated using the above equilibrium equations.
- In the case of a strong monoacid with decreasing acid concentration [A] = [A−], we obtain (with CaCO3 molar mass = 100 g/mol):
-
-
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)50.0 5.00 0.514 0.0849 0.0504 0.0474 0.0471 0.0470 0.0470
-
- where the initial state is the acid solution with no Ca2+ (not taking into account possible CO2 dissolution) and the final state is the solution with saturated Ca2+. For strong acid concentrations, all species have a negligible concentration in the final state with respect to Ca2+ and A− so that the neutrality equation reduces approximately to 2[Ca2+] = [A−] yielding [Ca2+] ≈ 0.5 [A−]. When the concentration decreases, [HCO−3] becomes non-negligible so that the preceding expression is no longer valid. For vanishing acid concentrations, one can recover the final pH and the solubility of CaCO3 in pure water.
- In the case of a weak monoacid (here we take acetic acid with pKa = 4.76) with decreasing total acid concentration [A] = [A−] + [AH], we obtain:
-
-
[A] (mol/L) [Ca2+] ≈ 0.5 [A−] 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)49.5 4.99 0.513 0.0848 0.0504 0.0474 0.0471 0.0470 0.0470
-
- For the same total acid concentration, the initial pH of the weak acid is less acid than the one of the strong acid; however, the maximum amount of CaCO3 which can be dissolved is approximately the same. This is because in the final state, the pH is larger than the pKa, so that the weak acid is almost completely dissociated, yielding in the end as many H+ ions as the strong acid to “dissolve” the calcium carbonate.
- The calculation in the case of phosphoric acid (which is the most widely used for domestic applications) is more complicated since the concentrations of the four dissociation states corresponding to this acid must be calculated together with [HCO−3], [CO2−3], [Ca2+], [H+] and [OH−]. The system may be reduced to a seventh degree equation for [H+] the numerical solution of which gives
-
-
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 1.08 1.62 2.25 3.05 4.01 5.00 5.97 6.74 7.00 Final pH 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)62.0 7.39 0.874 0.123 0.0536 0.0477 0.0471 0.0471 0.0470
-
- where [A] = [H3PO4] + [H2PO−4] + [HPO2−4] + [PO3−4] is the total acid concentration. Thus phosphoric acid is more efficient than a monoacid since at the final almost neutral pH, the second dissociated state concentration [HPO2−4] is not negligible (see phosphoric acid).
See also[edit]
Electron micrograph of needle-like calcium carbonate crystals formed as limescale in a kettle
Around 2 g of calcium-48 carbonate
- Cuttlebone
- Cuttlefish
- Gesso
- Limescale
- Marble
- Ocean acidification
- Whiting event
- List of climate engineering topics
- Lysocline
References[edit]
- ^ Aylward, Gordon; Findlay, Tristan (2008). SI Chemical Data Book (4th ed.). John Wiley & Sons Australia. ISBN 978-0-470-81638-7.
- ^ Rohleder, J.; Kroker, E. (2001). Calcium Carbonate: From the Cretaceous Period Into the 21st Century. Springer Science & Business Media. ISBN 978-3-7643-6425-0.
- ^ Benjamin, Mark M. (2002). Water Chemistry. McGraw-Hill. ISBN 978-0-07-238390-4.
- ^ “Occupational safety and health guideline for calcium carbonate” (PDF). US Dept. of Health and Human Services. Retrieved 31 March 2011.
- ^ “Archived copy” (PDF). Archived from the original (PDF) on 29 October 2018. Retrieved 29 October 2018.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ NIOSH Pocket Guide to Chemical Hazards. “#0090”. National Institute for Occupational Safety and Health (NIOSH).
- ^ Strumińska-Parulska, DI (2015). “Determination of 210Po in calcium supplements and the possible related dose assessment to the consumers”. Journal of Environmental Radioactivity. 150: 121–125. doi:10.1016/j.jenvrad.2015.08.006. PMID 26318774.
- ^ “Precipitated Calcium Carbonate”. Archived from the original on 11 January 2014. Retrieved 11 January 2014.
- ^ Kim, Yi-Yeoun; Schenk, Anna S.; Ihli, Johannes; Kulak, Alex N.; Hetherington, Nicola B. J.; Tang, Chiu C.; Schmahl, Wolfgang W.; Griesshaber, Erika; Hyett, Geoffrey; Meldrum, Fiona C. (September 2014). “A critical analysis of calcium carbonate mesocrystals”. Nature Communications. 5 (1): 4341. Bibcode:2014NatCo…5.4341K. doi:10.1038/ncomms5341. ISSN 2041-1723. PMC 4104461. PMID 25014563.
- ^ a b c d e Ropp, R. C. (6 March 2013). Encyclopedia of the Alkaline Earth Compounds. Elsevier. pp. 359–370. ISBN 9780444595508.
- ^ Demichelis, Raffaella; Raiteri, Paolo; Gale, Julian D.; Dovesi, Roberto (2013). “The Multiple Structures of Vaterite”. Crystal Growth & Design. 13 (6): 2247–2251. doi:10.1021/cg4002972. ISSN 1528-7483.
- ^ Morse, John W.; Arvidson, Rolf S.; Lüttge, Andreas (1 February 2007). “Calcium Carbonate Formation and Dissolution”. Chemical Reviews. 107 (2): 342–381. doi:10.1021/cr050358j. ISSN 0009-2665. PMID 17261071.
- ^ Géologue., Lippmann, Friedrich (1973). Sedimentary carbonate minerals. Springer. ISBN 3-540-06011-1. OCLC 715109304.
- ^ a b c d Nahi, Ouassef; Kulak, Alexander N.; Zhang, Shuheng; He, Xuefeng; Aslam, Zabeada; Ilett, Martha A.; Ford, Ian J.; Darkins, Robert; Meldrum, Fiona C. (20 November 2022). “Polyamines Promote Aragonite Nucleation and Generate Biomimetic Structures”. Advanced Science. 10 (1): 2203759. doi:10.1002/advs.202203759. ISSN 2198-3844. PMC 9811428. PMID 36403251. S2CID 253707446.
- ^ Welberry, T. R, ed. (2006). International tables for crystallography. Chester, England: International Union of Crystallography. doi:10.1107/97809553602060000001. ISBN 978-0-7923-6590-7. OCLC 166325528. S2CID 146060934.
- ^ Chessin, H.; Hamilton, W. C.; Post, B. (1 April 1965). “Position and thermal parameters of oxygen atoms in calcite”. Acta Crystallographica. 18 (4): 689–693. doi:10.1107/S0365110X65001585. ISSN 0365-110X.
- ^ Negro, AD (1971). “Refinement of the crystal structure of aragonite” (PDF). American Mineralogist: Journal of Earth and Planetary Materials. 56: 768–772 – via GeoScienceWorld.
- ^ Kabalah-Amitai, Lee; Mayzel, Boaz; Kauffmann, Yaron; Fitch, Andrew N.; Bloch, Leonid; Gilbert, Pupa U. P. A.; Pokroy, Boaz (26 April 2013). “Vaterite Crystals Contain Two Interspersed Crystal Structures”. Science. 340 (6131): 454–457. Bibcode:2013Sci…340..454K. doi:10.1126/science.1232139. ISSN 0036-8075. PMID 23620047. S2CID 206546317.
- ^ Bots, Pieter; Benning, Liane G.; Rodriguez-Blanco, Juan-Diego; Roncal-Herrero, Teresa; Shaw, Samuel (3 July 2012). “Mechanistic Insights into the Crystallization of Amorphous Calcium Carbonate (ACC)”. Crystal Growth & Design. 12 (7): 3806–3814. doi:10.1021/cg300676b. ISSN 1528-7483.
- ^ Cardew, Peter T.; Davey, Roger J. (2 October 2019). “The Ostwald Ratio, Kinetic Phase Diagrams, and Polymorph Maps”. Crystal Growth & Design. 19 (10): 5798–5810. doi:10.1021/acs.cgd.9b00815. ISSN 1528-7483. S2CID 202885778.
- ^ Zhang, Shuheng; Nahi, Ouassef; Chen, Li; Aslam, Zabeada; Kapur, Nikil; Kim, Yi‐Yeoun; Meldrum, Fiona C. (June 2022). “Magnesium Ions Direct the Solid‐State Transformation of Amorphous Calcium Carbonate Thin Films to Aragonite, Magnesium‐Calcite, or Dolomite”. Advanced Functional Materials. 32 (25): 2201394. doi:10.1002/adfm.202201394. ISSN 1616-301X. S2CID 247587883.
- ^ Metzler, Rebecca A.; Evans, John Spencer; Killian, Christopher E.; Zhou, Dong; Churchill, Tyler H.; Appathurai, Narayana P.; Coppersmith, Susan N.; Gilbert, P. U. P. A. (12 May 2010). “Nacre Protein Fragment Templates Lamellar Aragonite Growth”. Journal of the American Chemical Society. 132 (18): 6329–6334. doi:10.1021/ja909735y. ISSN 0002-7863. PMID 20397648.
- ^ Lowenstam, H.A.; Weiner, S. (1989). On Biomineralization. Oxford University Press. ISBN 9780195049770.
- ^ Belcher, A. M.; Wu, X. H.; Christensen, R. J.; Hansma, P. K.; Stucky, G. D.; Morse, D. E. (May 1996). “Control of crystal phase switching and orientation by soluble mollusc-shell proteins”. Nature. 381 (6577): 56–58. Bibcode:1996Natur.381…56B. doi:10.1038/381056a0. ISSN 1476-4687. S2CID 4285912.
- ^ Falini, Giuseppe; Albeck, Shira; Weiner, Steve; Addadi, Lia (5 January 1996). “Control of Aragonite or Calcite Polymorphism by Mollusk Shell Macromolecules”. Science. 271 (5245): 67–69. Bibcode:1996Sci…271…67F. doi:10.1126/science.271.5245.67. ISSN 0036-8075. S2CID 95357556.
- ^ Marin, Frédéric (October 2020). “Mollusc shellomes: Past, present and future”. Journal of Structural Biology. 212 (1): 107583. doi:10.1016/j.jsb.2020.107583. PMID 32721585. S2CID 220850117.
- ^ Russell, Daniel E . 17 February 2008. Retrieved December 31, 2010. “Helgustadir Iceland Spar Mine” mindat.org
- ^ Horne, Francis (23 October 2006). “How are seashells created?”. Scientific American. Retrieved 25 April 2012.
- ^ “Oyster shell calcium”. WebMD. Retrieved 25 April 2012.
- ^ “Oyster Shell Calcium Carbonate”. Caltron Clays & Chemicals. Archived from the original on 10 September 2013. Retrieved 25 April 2012.
- ^ Mangels, Ann Reed (4 June 2014). “Bone nutrients for vegetarians”. The American Journal of Clinical Nutrition. 100 (1): 469S–475S. doi:10.3945/ajcn.113.071423. PMID 24898231.
- ^ Boynton, W. V.; Ming, D. W.; Kounaves, S. P.; et al. (2009). “Evidence for Calcium Carbonate at the Mars Phoenix Landing Site” (PDF). Science. 325 (5936): 61–64. Bibcode:2009Sci…325…61B. doi:10.1126/science.1172768. PMID 19574384. S2CID 26740165.
- ^
Clark, B. C., III; Arvidson, R. E.; Gellert, R.; Morris, R. V.; Ming, D. W.; Richter, L.; Ruff, S. W.; Michalski, J. R.; Farrand, W. H.; Yen, A.; Herkenhoff, K. E.; Li, R.; Squyres, S. W.; Schröder, C.; Klingelhöfer, G.; Bell, J. F. (2007). “Evidence for montmorillonite or its compositional equivalent in Columbia Hills, Mars” (PDF). Journal of Geophysical Research. 112 (E6): E06S01. Bibcode:2007JGRE..112.6S01C. doi:10.1029/2006JE002756. hdl:1893/17119. - ^ Weyl, P.K. (1959). “The change in solubility of calcium carbonate with temperature and carbon dioxide content”. Geochimica et Cosmochimica Acta. 17 (3–4): 214–225. Bibcode:1959GeCoA..17..214W. doi:10.1016/0016-7037(59)90096-1.
- ^ a b Trexler, D. (2001). “Two Medicine Formation, Montana: geology and fauna”. In Tanke, D. H.; Carpenter, K. (eds.). Mesozoic Vertebrate Life. Indiana University Press. pp. 298–309. ISBN 978-0-253-33907-2.
- ^ Ward, Peter (2006). Out of Thin Air: Dinosaurs, Birds, and Earth’s Ancient Atmosphere. doi:10.17226/11630. ISBN 9780309666121.
- ^ “Effects of Acid Rain”. US Environmental Protection Agency. Retrieved 14 March 2015.
- ^ “Blast Furnace”. Science Aid. Archived from the original on 17 December 2007. Retrieved 30 December 2007.
- ^ Sfetcu, Nicolae (2 May 2014). Health & Drugs: Disease, Prescription & Medication. Nicolae Sfetcu.
- ^ McGinnis, R. A. Beet-Sugar Technology (2nd ed.). Beet Sugar Development Foundation. p. 178.
- ^ “Precipitated Calcium Carbonate uses”. Archived from the original on 25 July 2014.
- ^ a b c d “Calcium Carbonate Powder”. Reade Advanced Materials. 4 February 2006. Archived from the original on 22 February 2008. Retrieved 30 December 2007.
- ^ a b “Calcium carbonate in plastic applications”. Imerys Performance Minerals. Archived from the original on 4 August 2008. Retrieved 1 August 2008.
- ^ “Why do calcium carbonate play an important part in Industrial”. www.xintuchemical.com. Retrieved 7 October 2018.
- ^ “precipitated calcium carbonate commodity price”. www.dgci.be. Archived from the original on 7 October 2018. Retrieved 7 October 2018.
- ^ Jimoh, O.A.; et al. (2017). “Understanding the Precipitated Calcium Carbonate (PCC) Production Mechanism and Its Characteristics in the Liquid–Gas System Using Milk of Lime (MOL) Suspension” (PDF). South African Journal of Chemistry. 70: 1–7. doi:10.17159/0379-4350/2017/v70a1.
- ^ “Topic: Re: Can our calcium carbonate “waste” be utilized in other industries so we can divert it from landfills?”. www.chemicalprocessing.com. 4 March 2010. Archived from the original on 23 March 2017. Retrieved 3 February 2021.
- ^ “Why do calcium carbonate play an important part in Industry?”. www.xintuchemical.com. Retrieved 3 February 2021.
- ^ “Calcium Carbonates / Calcite/ Limestone. CaCO3 | Rajasthan Minerals & Chemicals”. www.rmcl.co.in. Archived from the original on 15 April 2021. Retrieved 3 February 2021.
- ^ “Calcium Carbonate”. kamceramics.com. Retrieved 3 February 2021.
- ^ “Ohio Historical Society Blog: Make It Shine”. Ohio Historical Society. Archived from the original on 23 March 2012. Retrieved 2 June 2011.
- ^ “Calcium Carbonate”. Medline Plus. National Institutes of Health. 1 October 2005. Archived from the original on 17 October 2007. Retrieved 30 December 2007.
- ^ Lieberman, Herbert A.; Lachman, Leon; Schwartz, Joseph B. (1990). Pharmaceutical Dosage Forms: Tablets. New York: Dekker. p. 153. ISBN 978-0-8247-8044-9.
- ^ “Food Additives – Names Starting with C”. Chemistry.about.com. 10 April 2012. Archived from the original on 16 October 2006. Retrieved 24 May 2012.
- ^ Caruso JB, Patel RM, Julka K, Parish DC (July 2007). “Health-behavior induced disease: return of the milk-alkali syndrome”. J Gen Intern Med. 22 (7): 1053–5. doi:10.1007/s11606-007-0226-0. PMC 2219730. PMID 17483976.
- ^ Beall DP, Henslee HB, Webb HR, Scofield RH (May 2006). “Milk-alkali syndrome: a historical review and description of the modern version of the syndrome”. Am. J. Med. Sci. 331 (5): 233–42. doi:10.1097/00000441-200605000-00001. PMID 16702792. S2CID 45802184.
- ^ Gabriely, Ilan; Leu, James P.; Barzel, Uriel S. (2008). “Clinical problem-solving, back to basics”. New England Journal of Medicine. 358 (18): 1952–6. doi:10.1056/NEJMcps0706188. PMID 18450607.
- ^ “E-numbers: E170 Calcium carbonate”. Food-Info.net. 080419 food-info.net
- ^ “Current EU approved additives and their E Numbers”. UK Food Standards Agency. Retrieved 27 October 2011.
- ^ “Listing of Food Additives Status Part I”. US Food and Drug Administration. Archived from the original on 14 March 2013. Retrieved 27 October 2011.
- ^ “Standard 1.2.4 – Labelling of ingredients”. Australia New Zealand Food Standards Code. Retrieved 27 October 2011.
- ^ Holdstock, Lee. “Why go organic?”. Real Bread Campaign. Soil Association Certification Limited. Retrieved 3 April 2021.
- ^ “Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply” (PDF). Department for Environment, Food and Rural Affairs. August 2013.
- ^ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). “Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow’s milk in young women”. The Journal of Nutrition. 135 (10): 2379–2382. doi:10.1093/jn/135.10.2379. PMID 16177199.
- ^ a b Kauffman, John F.; Westenberger, Benjamin J.; Robertson, J. David; Guthrie, James; Jacobs, Abigail; Cummins, Susan K. (1 July 2007). “Lead in pharmaceutical products and dietary supplements”. Regulatory Toxicology and Pharmacology. 48 (2): 128–134. doi:10.1016/j.yrtph.2007.03.001. ISSN 0273-2300. PMID 17467129.
- ^ Ross, Edward A.; Szabo, N. J.; Tebbett, I. R. (2000). “Lead Content of Calcium Supplements”. JAMA. 284 (11): 1425–1429. doi:10.1001/jama.284.11.1425. PMID 10989406.
- ^ Oates, J. A. H. (11 July 2008). Lime and Limestone: Chemistry and Technology, Production and Uses. John Wiley & Sons. pp. 111–113. ISBN 978-3-527-61201-7.
- ^ “Limestone Dispenser Fights Acid Rain in Stream”. The New York Times. Associated Press. 13 June 1989.
- ^ a b “Environmental Uses for Calcium Carbonate”. Congcal. 6 September 2012. Retrieved 5 August 2013.
- ^ Schreiber, R. K. (1988). “Cooperative federal-state liming research on surface waters impacted by acidic deposition”. Water, Air, & Soil Pollution. 41 (1): 53–73. Bibcode:1988WASP…41…53S. doi:10.1007/BF00160344. S2CID 98404326.
- ^ Kircheis, Dan; Dill, Richard (2006). “Effects of low pH and high aluminum on Atlantic salmon smolts in Eastern Maine and liming project feasibility analysis” (reprinted at Downeast Salmon Federation). National Marine Fisheries Service and Maine Atlantic Salmon Commission.[permanent dead link]
- ^ Guhrén, M.; Bigler, C.; Renberg, I. (2006). “Liming placed in a long-term perspective: A paleolimnological study of 12 lakes in the Swedish liming program”. Journal of Paleolimnology. 37 (2): 247–258. Bibcode:2007JPall..37..247G. doi:10.1007/s10933-006-9014-9. S2CID 129439066.
- ^ “Solvay Precipitated Calcium Carbonate: Production”. Solvay. 9 March 2007. Retrieved 30 December 2007.
- ^ a b Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ “Selected Solubility Products and Formation Constants at 25 °C”. California State University, Dominguez Hills. Archived from the original on 25 May 2006. Retrieved 7 June 2007.
- ^ Wang, X.; Conway, W.; Burns, R.; McCann, N.; Maeder, M. (2010). “Comprehensive Study of the Hydration and Dehydration Reactions of Carbon Dioxide in Aqueous Solution”. The Journal of Physical Chemistry A. 114 (4): 1734–40. Bibcode:2010JPCA..114.1734W. doi:10.1021/jp909019u. PMID 20039712.
- ^ a b Mook, W. (2000). “Chemistry of carbonic acid in water”. Environmental Isotopes in the Hydrological Cycle: Principles and Applications (PDF). Paris: INEA/UNESCO. pp. 143–165. Archived from the original (PDF) on 18 March 2014. Retrieved 18 March 2014.
- ^ Wojtowicz, J. A. (1998). “Factors affecting precipitation of calcium carbonate” (PDF). Journal of the Swimming Pool and Spa Industry. 3 (1): 18–23. Archived from the original (PDF) on 18 March 2014. Retrieved 18 March 2014.
- ^ Wojtowicz, J. A. (1998). “Corrections, potential errors, and significance of the saturation index” (PDF). Journal of the Swimming Pool and Spa Industry. 3 (1): 37–40. Archived from the original (PDF) on 24 August 2012. Retrieved 18 March 2014.
- ^ Birch, R. G. (2013). “BABES: a better method than “BBB” for pools with a salt-water chlorine generator” (PDF). scithings.id.au.
External links[edit]
- International Chemical Safety Card 1193
- CID 516889 from PubChem
- ATC codes: A02AC01 (WHO) and A12AA04 (WHO)
- The British Calcium Carbonate Association – What is calcium carbonate Archived 24 May 2008 at the Wayback Machine
- CDC – NIOSH Pocket Guide to Chemical Hazards – Calcium Carbonate
| Карбонат кальция | ||
|---|---|---|
|
||
 |
||
| Систематическое наименование |
карбонат кальция | |
| Традиционные названия | углекислый кальций | |
| Хим. формула | CaCO3 | |
| Состояние | твёрдые белые кристаллы | |
| Молярная масса | 100.0869 г/моль | |
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
|
| Температура | ||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C |
|
| • разложения | 900−1000 °C | |
| Давление пара | 0 ± 1 мм рт.ст. | |
| Константа диссоциации кислоты pKa | 9.0 | |
| Растворимость | ||
| • в воде | (25 °C) 0,0014 г | |
| Показатель преломления | 1,60 | |
| Кристаллическая структура | тригональная, пространств. гр. 2/m | |
| ГОСТ | ГОСТ 4530-76 | |
| Рег. номер CAS | 471-34-1 | |
| PubChem | 10112 | |
| Рег. номер EINECS | 207-439-9 | |
| SMILES |
C(=O)([O-])[O-].[Ca+2] |
|
| InChI |
1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 VTYYLEPIZMXCLO-UHFFFAOYSA-L |
|
| Кодекс Алиментариус | E170 | |
| RTECS | FF9335000 | |
| ChEBI | 3311 | |
| ChemSpider | 9708 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3.
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
- 1 Применение
- 1.1 Массовое производство/использование
- 1.2 В строительстве
- 2 Нахождение в природе
- 3 Геология
- 4 Получение
- 5 Химические свойства
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Таблетки из карбоната кальция
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
Кристаллическая структура кальцита
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
- Доломит
Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
- CaO + H2O ⟶ Ca(OH)2 ,
- Ca(OH)2 + CO2 ⟶ CaCO3 + H2O .
Химические свойства
См. также: Карбонаты
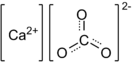
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3 ⟶ CaO + CO2↑ .
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- CaCO3 + CO2 + H2O ⟶ Ca(HCO3)2.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3 + 4C ⟶ CaC2 + 3CO↑
|
Соединения кальция |
|---|
|

















![{displaystyle {ce {CaCO3(s)->[Delta ]CaO(s){+}CO2uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/341d1776ae78128a432b06ec2f5b8968ecf3d50c)