Правила
составления формул кислых солей по
названию.
Чтобы
научиться составлять формулы кислых
солей необходимо уметь составлять
формулы средних солей по кислотным
остаткам соответствующих кислот (см. §
1).
Пример
1:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:




гидрофосфат
калия
KHPO4
Приставка
ГИДРО означает, что соль кислая,
поэтому, в составе кислотного остатка
1 атом Н (атом водорода).Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:






гидрофосфат
калия
I
IIKHPO4
Валентность
калия равна I , так как калий элементI
группы главной подгруппы.Валентность
кислотного остатка HPO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
HPO43
-1 = II
3)
Найдите наименьшее общее кратное (НОК)
– самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
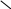




НОК
= 2I
IIK2HPO4
2
: I = 2 2 : II = 1единицу не
пишутСамое
маленькое число, делящаеся на обе
валентностит.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
10 ¾
Пример
2:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:





дигидрофосфат
кальция
СаH2PO4
Приставка
ДИГИДРО означает, что соль кислая и
имеетв
составе кислотного остатка 2 атома Н“ДИ”
означает ДВА (атома водорода)Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:




дигидрофосфат
калия
II
IСаH2PO4
Валентность
кальция равна II , так как кальций
элементII
группы главной подгруппы.Валентность
кислотного остатка H2PO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
H2PO43
-2 = I
3)
Найдите наименьшее общее кратное (НОК)
– самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
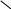





НОК
= 2II
IСа(H2PO4)2
2
: II = 1 2 : I = 2кислотный
остатокнадо
взять в скобки, т.к.результат
делениябольше
1Самое
маленькое число, делящаеся на обе
валентности,т.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
11 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты H3PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте H2CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в H2CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в H2CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Кислые соли. Номенклатура
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты H2SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, поэтому добавляем «гидро»),
NaH2PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль. Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных – частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. Номенклатура
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты H2SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.
Соли: классификация, номенклатура, способы получения
“Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь”
А. Дистервег (немецкий педагог)
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир.
С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса –солей.
I. Понятие о солях
Такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в XVII веке. Именно в это время такие учёные, как Я. Ван Гельмонт (1580–1644), О. Тахений (1620–1699) и Г. Руэль (1703–1770), развили представление о том, что существует отдельный класс веществ — соли, которые можно рассматривать как продукт взаимодействия кислот с основаниями.
Соли – сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Составление формул солей:
II. Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля (1703–1770). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
|
Средние |
Кислые |
Основные |
Двойные |
Смешанные |
Комплексные |
|
Соли, в состав которых входят металл и кислотный остаток |
Соли, в состав которых, кроме металла и кислотного остатка, входят атомы водорода |
Соли, в состав которых, кроме металла и кислотного остатка, входят гидроксогруппы ОН |
Продукты полного замещения атомов водорода двух- или многоосновной кислоты двумя различными металлами |
||
|
Na2SO4 |
NaHSO4 |
Mg(OH)Cl |
K2NaPO4 |
Ca-OCl2 |
Na[Al(OH)4] |
III. Названия солей
- Для средней соли – название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4(валентность I).
Na2SO4– сульфат натрия,
CuSO4– сульфат меди (II)
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обратите внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
- Для основной соли –«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
Mg(OH)Cl – гидроксохлорид магния
Fe(OH)(NO3)2 — гидроксонитрат железа(III);
Fe(OH)2NO3 — дигидроксонитрат железа(III).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди(II) (CuOH)2CO3, образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Кроме принятых в науке названий, для многих солей в широком обиходе сохраняются тривиальные названия, то есть названия, которые были присвоены веществам до того, как учёные установили единую номенклатуру.
Тривиальные названия большей частью связаны либо с какими-то особыми свойствами веществ, либо с областями их применения. Многие из этих названий были присвоены солям алхимиками. В таблице приведены обобщённые сведения о наиболее часто встречающихся в литературе тривиальных названиях солей.
|
Тривиальное название соли |
Химическая формула соли |
Систематическое название соли |
| Адский камень | AgNO3 | нитрат серебра |
| Алебастр | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Берлинская лазурь | KFe[Fe(CN)6] | гексацианоферрат(II) железа(III)-калия |
| Бланфикс | BaSO4 | сульфат бария |
| Бура | Na2B4O7⋅10H2O | декагидрат тетрабората натрия |
| Бура ювелирная | Na2B4O7⋅5H2O | пентагидрат тетрабората натрия |
| Гипс | CaSO4⋅2H2O | дигидрат сульфата кальция |
| Гипс жжёный | CaSO4⋅0,5H2O | полугидрат сульфата кальция |
| Гипс строительный | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Золото сусальное | SnS2 | сульфид олова(IV) |
| Квасцы железоаммонийные | NH4Fe(SO4)2⋅12H2O | додекагидрат сульфата железа(III)-аммония |
| Купорос медный | CuSO4⋅5H2O | пентагидрат сульфата меди(II) |
| Ляпис | AgNO3 | нитрат серебра |
| Марганцовка | KMnO4 | перманганат калия |
| Мел | CaCO3 | карбонат кальция |
| Нашатырь | NH4Cl | хлорид аммония |
| Патина | (CuOH)2CO3 | гидроксокарбонат меди(II) |
| Поташ | K2CO3 | карбонат калия |
| Преципитат | CaHPO4⋅2H2O | дигидрат гидрофосфата кальция |
| Растворимое стекло | Na2SiO3⋅9H2O | нонагидрат силиката натрия |
| Свинцовый сахар | (CH3COO)2Pb⋅3H2O | тригидрат ацетата свинца(II) |
| Селитра аммиачная (аммонийная) | NH4NO3 | нитрат аммония |
| Селитра калийная (индийская) | KNO3 | нитрат калия |
| Селитра кальциевая (норвежская) | Ca(NO3)2 | нитрат кальция |
| Селитра натриевая (чилийская) | NaNO3 | нитрат натрия |
| Сода кальцинированная (стиральная) | Na2CO3 | карбонат натрия |
| Сода кристаллическая | Na2CO3⋅10H2O | декагидрат карбоната натрия |
| Сода питьевая | NaHCO3 | гидрокарбонат натрия |
| Сода пищевая | NH4HCO3 | гидрокарбонат аммония |
| Соль Мора | (NH4)2Fe(SO4)2⋅6H2O | гексагидрат сульфата железа(II)-диаммония |
| Соль английская (горькая) | MgSO4⋅7H2O | гептагидрат сульфата магния |
| Соль бертолетова | KClO3 | хлорат калия |
| Соль глауберова | Na2SO4⋅10H2O | декагидрат сульфата натрия |
| Соль жёлтая кровяная | K4[Fe(CN)6]⋅10H2O | декагидрат гексацианоферрата(II) калия |
| Соль поваренная | NaCl | хлорид натрия |
| Соль красная кровяная | K3[Fe(CN)6] | гексацианоферрат(III) калия |
| Сулема | HgCl2 | хлорид ртути |
| Суперфосфат двойной | Ca(H2PO4)2⋅H2O | моногидрат дигидрофосфата кальция |
| Суперфосфат простой | Ca(H2PO4)2⋅2CaSO4 | |
| Турнбулева синь | KFe[Fe(CN)6] | гексацианоферрат(III) железа(II)-калия |
| Хлорная известь | CaOCl2 | гипохлорит-хлорид кальция |
| Хромпик | K2Cr2O7 | дихромат калия |
| Щёлок | K2CO3 | карбонат калия |
IV. Получение
|
1. Из металлов: металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) = соль + Н2 Zn +2 HCl = ZnCl2 + H2 Металл1 + соль1 = металл2 + соль2 Видео: “Взаимодействие металлов с солями” Примечание: (металл2 стоит в ряду активности правее)
Fe + CuCl2 = FeCl2 + Cu |
|
2.Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + H2O основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
|
3. Реакция нейтрализации: кислота + основание = соль + вода HCl + NaOH = NaCl + H2O |
|
4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 +AgCl↓ соль1 + щелочь = нерастворимое основание + соль 2 CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 соль1 + кислота1 = кислота2 + соль2 2NaCl + H2SO4 = 2HCl + Na2SO4 Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода. |
Это интересно
“Зеркало мира”
 В Боливии есть необычная равнина Salar de Uyuni (солончак Уюни), покрытая толстым слоем соли. Её площадь — это более 12 000 квадратных километров, и в определённые моменты времени она покрывается тонким слоем влаги, превращаясь в огромное зеркало. Это её свойство используют для настройки оптического оборудования на спутниках Земли. Ещё эта равнина является богатым источником лития (более половины мирового запаса).
В Боливии есть необычная равнина Salar de Uyuni (солончак Уюни), покрытая толстым слоем соли. Её площадь — это более 12 000 квадратных километров, и в определённые моменты времени она покрывается тонким слоем влаги, превращаясь в огромное зеркало. Это её свойство используют для настройки оптического оборудования на спутниках Земли. Ещё эта равнина является богатым источником лития (более половины мирового запаса).
V. Тренажеры
Тренажёр №1. “Классы неорганических соединений”
Тренажёр №2. “Классификация солей по растворимости в воде”
Тренажёр №3. “Составление названий солей по формуле”
Тренажёр №4. “Составление формул солей”
Тренажёр №5. Задачи на тему “Расчеты с использованием формул солей”
Проверь себя: “Соотнесите формулы солей, расположенных слева с их названиями”
VI. Задания для закрепления
Задание №1. Дайте названия следующим солям:
NaCl, KNO3, FeCl3, Li2SO4, KHSO4, BaOHCl, CaSO3, NaH2PO4, CuCl2
Задание №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задание №3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
ЦОРы
Видео: “Составление формул солей”
Видео: “Взаимодействие металлов с солями”
Тренажёр №1. “Классы неорганических соединений”
Тренажёр №2. “Классификация солей по растворимости в воде”
Тренажёр №3. “Составление названий солей по формуле”
Тренажёр №4. “Составление формул солей”
Тренажёр №5. Задачи на тему “Расчеты с использованием формул солей”
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Кислые соли
Задания на применение знаний о кислых
солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при
подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного
замещения атомов водорода многоосновных кислот
на металл. Номенклатура кислых солей отличается
от средних только добавлением приставки
«гидро…» или «дигидро…» к названию соли,
например: NaHCO3 – гидрокарбонат
натрия, Са(Н2РО4)2 – дигидрофосфат
кальция.
2. Получение.
Кислые соли получаются при взаимодействии
кислот с металлами, оксидами металлов,
гидроксидами металлов, солями, аммиаком, если
кислота в избытке.
Например:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
CaO + H3PO4 = CaHPO4 + H2O,
NaOH + H2SO4 = H2O + NaHSO4,
Na2S + HCl = NaHS + NaCl,
NH3 + H3PO4 = NH4H2PO4,
2NH3 + H3PO4 = (NH4)2HPO4.
Также кислые соли получаются при
взаимодействии кислотных оксидов со щелочами,
если оксид в избытке. Например:
CO2 + NaOH = NaHCO3,
2SO2 + Ca(OH)2 = Ca(HSO3)2.
3. Взаимопревращения.
Средняя соль ![]() кислая
кислая
соль; например:
K2СО3 ![]() KНСО3.
KНСО3.
Чтобы из средней соли получить кислую, нужно
добавить избыток кислоты или соответствующего
оксида и воды:
K2СО3 + Н2О + СО2 =
2KНСО3.
Чтобы из кислой соли получить среднюю, нужно
добавить избыток щелочи:
KНСО3 + KОН = K2СО3 + Н2О.
Гидрокарбонаты разлагаются с образованием
карбонатов при кипячении:
2KНСО3 ![]() K2СО3
K2СО3
+ Н2О + СО2.
4. Свойства.
Кислые соли проявляют свойства кислот,
взаимодействуют с металлами, оксидами металлов,
гидроксидами металлов, солями.
Например:
2KНSO4 + Mg = H2![]() + MgSO4 + K2SO4,
+ MgSO4 + K2SO4,
2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2KHSO4 + 2NaOH = 2H2O + K2SO4
+ Na2SO4,
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4
+ CuSO4,
2KHSO4 + MgCO3 = H2O + CO2![]() + K2SO4 + MgSO4,
+ K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4![]() + K2SO4 + 2HCl.
+ K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной
соли.
При решении задач на избыток и недостаток нужно
помнить о возможности образования кислых солей,
поэтому сначала составляют уравнения всех
возможных реакций. После нахождения количеств
реагирующих веществ делают вывод о том, какая
соль получится, и решают задачу по
соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH,
пропустили 44,8 л СО2. Найти массу
образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
Р е ш е н и е
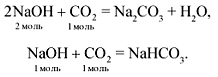
![]() (NaOH) = m/M =
(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
![]() (СО2) = V/Vm
(СО2) = V/Vm
= 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку ![]() (NaOH) :
(NaOH) : ![]() (CO2) = 1,5 : 2 = 0,75 : 1,
(CO2) = 1,5 : 2 = 0,75 : 1,
то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества образовавшейся соли равно
количеству вещества прореагировавшего
гидроксида натрия:
![]() (NaHCO3)
(NaHCO3)
= 1,5 моль.
m(NaHCO3) = M •![]() = 84 (г/моль)•1,5 (моль) = 126 г.
= 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г
растворили в 120 г 9%-й ортофосфорной кислоты.
Полученный раствор прокипятили, затем к нему
добавили 6 г гидроксида натрия. Найти массу
полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, |
|
| m(NaOH) = 6 г. |
Р е ш е н и е
![]()
![]() (P2O5)
(P2O5)
= m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, ![]() 1(H3PO4
1(H3PO4
получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)•![]() = 120 (г)•0,09 = 10,8 г.
= 120 (г)•0,09 = 10,8 г.
![]() 2(H3PO4)
2(H3PO4)
= m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
![]() (H3PO4)
(H3PO4)
= ![]() 1 +
1 + ![]() 2 = 0,11 + 0,04 = 0,15
2 = 0,11 + 0,04 = 0,15
моль.
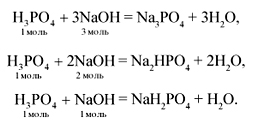
![]() (NaOH) = m/M
(NaOH) = m/M
= 6 (г)/40 (г/моль) = 0,15 моль.
Поскольку
![]() (H3PO4)
(H3PO4)
: ![]() (NaOH) = 0,15 : 0,15 = 1 : 1,
(NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
![]()
![]() (NaH2PO4)
(NaH2PO4)
= 0,15 моль,
m(NaH2PO4) = M•![]() = 120 (г/моль)•0,15 (моль) = 18 г.
= 120 (г/моль)•0,15 (моль) = 18 г.
Ответ: m(NaH2PO4) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили
через 340 г 2%-го раствора аммиака. Назовите соль,
получившуюся в результате реакции, и определите
ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л
пропана, прореагировал с 400 мл 6%-го раствора
гидроксида калия (![]()
= 1,05 г/мл). Найти состав полученного раствора и
массовую долю соли в полученном растворе.
Ответ: ![]() (KНСО3) = 10,23 %.
(KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при
сжигании 9,6 кг угля, пропустили через раствор,
содержащий 29,6 кг гидроксида кальция. Найти массу
полученной соли.
Ответ: m(Ca(HCO3)2) = 64,8 кг.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты
растворили 1,3 кг цинка. Найти массу полученной
соли.
Ответ: m(ZnSO4) = 3,22 кг.
6. Задачи на кислые соли. Образование смеси
двух солей.
Это более сложный вариант задач на кислые соли.
В зависимости от количества реагирующих веществ
возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V)
щелочью в зависимости от молярного соотношения
реагентов могут образоваться следующие
продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
![]() (P2O5):
(P2O5):![]() (NaOH) = 1:6;
(NaOH) = 1:6;
P2O5 + 4NaOH = 2Na2HPO4 + H2O,
![]() (P2O5):
(P2O5):![]() (NaOH) = 1:4;
(NaOH) = 1:4;
P2O5 + 2NaOH + H2O = 2NaH2PO4,
![]() (P2O5):
(P2O5):![]() (NaOH) = 1:2.
(NaOH) = 1:2.
Следует помнить, что при неполной
нейтрализации возможно образование смеси двух
соединений. При взаимодействии 0,2 моль Р2О5
с раствором щелочи, содержащим 0,9 моль NaOH,
молярное соотношение находится между 1:4 и 1:6. В
этом случае образуется смесь двух солей: фосфата
натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH,
то молярное соотношение будет другим: 0,2:0,6 = 1:3,
оно находится между 1:2 и 1:4, поэтому получится
смесь двух других солей: дигидрофосфата и
гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы
будем исходить из предположения, что
одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных
реакций.
2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества
другого реагирующего вещества согласно молярным
соотношениям по уравнениям.
5. Составить систему уравнений с двумя
неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при
сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го
раствора гидроксида калия. Какие вещества и в
каких количествах получаются?
Р е ш е н и е
![]()
![]() (P) = m/M
(P) = m/M
= 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, ![]() (P2O5)
(P2O5)
= 0,1 моль.
m(KOH) = ![]() •m(р-ра)
•m(р-ра)
= 0,084•200 (г) = 16,8 г,
![]() (KOH) = m/M
(KOH) = m/M
= 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
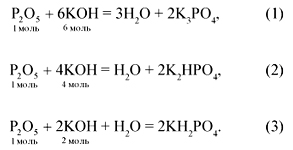
![]() (Р2О5):
(Р2О5):![]() (KОН) = 0,1:0,3 = 1:3,
(KОН) = 0,1:0,3 = 1:3,
следовательно, получится смесь двух солей –
гидрофосфата и дигидрофосфата калия (уравнения 2
и 3).
Обозначим ![]() (Р2О5)
(Р2О5)
в уравнении (2) как х моль, а ![]() (Р2О5) в уравнении (3)
(Р2О5) в уравнении (3)
как у моль, тогда потребуется: ![]() (KОН) = 4х + 2у.
(KОН) = 4х + 2у.
Составим систему уравнений:
![]()
х = 0,1 – у,
4(0,1 – у) + 2у = 0,3,
0,4 – 4у + 2у = 0,3,
2у = 0,1, у = 0,05,
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся
соли вдвое больше количества вещества
вступившего в реакцию оксида фосфора(V), то
получится по 0,1 моль гидро- и дигидрофосфата
калия:
![]() (P2O5)2
(P2O5)2
= 0,05 моль —> ![]() (K2НРО4)
(K2НРО4)
= 0,1 моль,
![]() (Р2О5)3
(Р2О5)3
= 0,05 моль —> ![]() (KН2РО4)
(KН2РО4)
= 0,1 моль.
Ответ: ![]() (K2НРО4) = 0,1 моль,
(K2НРО4) = 0,1 моль,
![]() ( KН2РО4)
( KН2РО4)
= 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей,
полученных при растворении 22,4 л углекислого газа
в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, ![]() (Na2CO3) = 4,05%
(Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, ![]() (NaHCO3) = 12,82 %.
(NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в
растворе, полученном при пропускании 100 м3 аммиака
через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ![]() ((NH4)2HPO4) = 43,8 %,
((NH4)2HPO4) = 43,8 %,
![]() (NH4H2PO4)
(NH4H2PO4)
= 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной
кислоты с массовой долей 11,76 % прибавили 150 г
раствора гидроксида калия с массовой долей
5,6 %. Найти состав остатка, полученного при
выпаривании раствора.
Ответ: m(K3PO4) = 6,36 г,
m(K2HPO4) = 5,22 г.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и
образовавшийся углекислый газ пропустили через
раствор, содержащий 102,6 г гидроксида бария. Найти
массы полученных солей.
Ответ: m(BaCO3) = 39,4 г,
m(Ba(HCO3)2) = 103,6 г.

