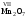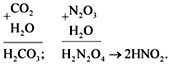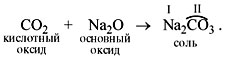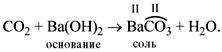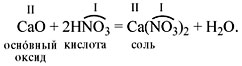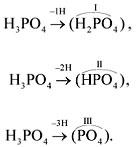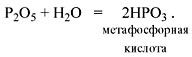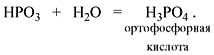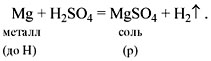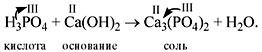Как составлять формулы кислот(по химии)?
Профи
(956),
закрыт
13 лет назад
Бася Барбара
Знаток
(258)
13 лет назад
Они все даны.. Их просто выучить… Соляная-HCl//
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3).
По основности — количество кислых атомов водорода
Одноосновные (HPO3);
Двухосновные (H2SeO4, Азелаиновая кислота) ;
Трёхосновные (H3PO4).
Четырёхосновные (H4СO4).
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH);
По летучести
Летучие (H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
Ирина
Гений
(88042)
13 лет назад
Их вообще-то учат. А состоят они из атомов водорода и кислотного остатка. Валентность водорода – 1. Например, H2SO4 – серная кислота
НЛО
Мыслитель
(9180)
13 лет назад
наименьшее общее кратное 2
H(+)2 SO4(2-)
раставляете сначала заряды ионов, затем находите наименьшее общее кратное и делите например в данном случае (2) разделить на 1 будет два и 2/2= 1 следовательно H2SO4
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



V,
VI,
VII
.являются
кислотными:


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13/2007
Глава 2. Важнейшие классы
неорганических соединений
2.1. Оксиды
Оксиды – сложные вещества, которые состоят из
атомов двух химических элементов, один из
которых кислород.
Определим, какое из следующих соединений оксид:
PH3, H3PO4, P2O5.
К оксидам относят соединение P2O5.
Два других вещества – не оксиды: в состав РН3
не входит атом кислорода, а в состав H3PO4 входят
атомы трех химических элементов – H, Р, O.
Названия оксидов складываются из двух слов:
первое слово – «оксид», второе слово – название
химического элемента, образующего данный оксид,
в родительном падеже. Например: СаО – оксид
кальция.
Если оксид образован химическим элементом с
переменной валентностью, то после названия
элемента нужно указать его валентность.
Например: Fe2О3 – оксид железа(III), FеО –
оксид железа(II).
Задание 2.1. Среди следующих соединений
найдите оксиды и назовите их:
N2O3, NH3, MnO2, H2O,
HCl, NaOH, Na2O, P2O5, H2SO4.
Задание 2.2. Составьте формулы следующих
оксидов:
оксид хрома(III), оксид углерода(IV), оксид магния,
оксид серы(VI), оксид азота(V), оксид калия, оксид
марганца(VI).
Многие оксиды могут реагировать с кислотами
или основаниями. В таких реакциях получаются
соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов,
которые к таким реакциям не способны. Такие
оксиды называют несолеобразующими.
Задание 2.3. Назовите несолеобразующие оксиды:
H2O, CO, N2O, NO, F2O.
Некоторые оксиды имеют особые (тривиальные)
названия: Н2О – вода, СО – угарный газ, СО2
– углекислый газ и др.
Солеобразующие оксиды подразделяют на три
группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только
изучая его химические свойства. Например,
кислотные оксиды реагируют с основаниями и не
реагируют с кислотами. Основные оксиды реагируют
с кислотами и не реагируют с основаниями.
Амфотерные оксиды могут реагировать и с
кислотами, и с основаниями.
По формуле оксида можно определить, какими
свойствами он обладает. Правда, иногда эта оценка
будет приблизительной.
• Неметаллы образуют только кислотные и
безразличные оксиды.
• Металлы в зависимости от валентности могут
образовывать разные оксиды – основные, амфотерные
и кислотные.
Предсказать свойства оксида металла может
помочь эта схема:
Основные оксиды металлов от кислотных оксидов
металлов отличить легко: малая валентность
металла – основный оксид, большая – кислотный.
Как быть с амфотерными оксидами? «Любимая»
валентность металлов в этих оксидах III, но есть и
исключения. Поэтому желательно запомнить
формулы наиболее часто встречающихся амфотерных
оксидов: ZnO, Al2O3, SnO, PbO, Cr2O3.
Задание 2.4. Назовите амфотерные оксиды:
ZnO, SnO, PbO, Al2O3, Cr2O3.
Задание 2.5. Классифицируйте приведенные
ниже оксиды:
V2O5, SO2, ZnO, Fe2O3,
SO3, CO2, Li2O, FeO, Al2O3, H2O,
BaO.
Задание рекомендуется выполнить по следующей
схеме.
1) Определить, какой это оксид – солеобразующий
или несолеобразующий.
2) Определить, какой элемент входит в состав
солеобразующего оксида – металл или неметалл.
Для этого надо выписать из таблицы
Д.И.Менделеева символы элементов-неметаллов. Они
расположены в главных подгруппах на линии бор –
астат и выше этой линии (рис. 1).
|
|
Рис. 1. Элементы-неметаллы
|
3) Если в состав оксида входит атом
неметалла, то оксид кислотный.
4) Если в состав оксида входит атом металла, то
следует определить его валентность и по ней
выяснить характер оксида – основный, амфотерный
или кислотный.
Например: Cr2O3 – амфотерный, т.к. хром
– металл с валентностью III;
N2O3 – кислотный оксид, т.к. азот –
неметалл;
CrO3 – кислотный оксид, т.к. хром – металл с
высокой валентностью VI.
Зная характер оксида, можно описать его
свойства.
Свойства кислотных оксидов
• Кислотные оксиды реагируют c водой, образуя
кислоты. Например:
CO2 + H2O = H2CO3.
Чтобы составить формулу кислоты, нужно сложить
все атомы исходных веществ, записывая на первом
месте атом водорода, на втором – элемент,
образующий оксид, и на последнем – кислород. Если
индексы получились четными, то их можно
сократить:
N2O3 + H2O = H2N2O4
(2HNO2).
Эти же реакции можно записать в виде
арифметического примера:
Задание 2.6. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с водой.
• Кислотные оксиды реагируют с осно?вными
оксидами, образуя соли соответствующей кислоты,
т.е. соль той кислоты, которая образуется при
взаимодействии этого оксида с водой. Например:
Чтобы составить такое уравнение, нужно
действовать по следующей схеме.
1) Составить формулу кислоты (прибавив к
молекуле оксида молекулу воды):
CO2 + H2O = H2CO3.
2) Определить валентность кислотного остатка
(это часть молекулы кислоты без атомов водорода).
В данном случае кислотный остаток имеет
состав СО3, его валентность равна числу
атомов водорода в кислоте, т.е. II.
3) Cоставить формулу соли, записав вместо атомов
водорода атом металла из основного оксида с его
валентностью (в данном случае натрий).
4) Составить формулу соли по валентности
металла и кислотного остатка: Na2CO3.
Задание 2.7. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с оксидом
кальция.
• Кислотные оксиды реагируют с основаниями,
образуя соль соответствующей кислоты и воду.
Например:
Принципы составления уравнений реакций с
основаниями те же, что и для реакций с
осно?вными оксидами (см. выше).
Задание 2.8. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с гидроксидом
натрия NаОН.
З а п о м н и т е! Кислотные оксиды ни с кислотами,
ни c кислотными оксидами не реагируют.
Свойства основных оксидов
• Основные оксиды реагируют с водой,
образуя основания. Реакция протекает, если
получающееся основание растворимо в воде.
Общая формула оснований – М(ОН)х, где х
– число ОН-групп, равное валентности металла М.
Например:
СаО + Н2О = Са(ОН)2,
Fe2O3 + Н2О нет реакции.
Последняя реакция не идет, т.к. основание Fe(ОН)3
нерастворимо в воде. Растворимость веществ в
воде можно определить по таблице растворимости
(рис. 2).
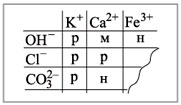 |
Рис. 2.
|
Условные обозначения: р – растворимо в воде, м
– малорастворимо в воде,
н – нерастворимо в воде.
При определении возможности протекания данной
реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он
образован активным металлом. Эти металлы стоят в
ряду напряжений до магния: Li, K, Ba, Ca, Na, Mg…
Задание 2.9. Составьте уравнения реакций основных
оксидов из задания 2.5 с водой.
• Основные оксиды реагируют с
кислотами, образуя соль и воду:
Обратите внимание: при составлении формулы
соли нужно вместо атомов водорода в формуле
кислоты написать символ металла, а затем
расставить индексы согласно валентности.
Задание 2.10. Составьте уравнения реакций
осно?вных оксидов из задания 2.5 с Н2SО4.
• Основные оксиды реагируют с
кислотными оксидами, образуя соли.
• Некоторые основные оксиды
реагируют при нагревании с водородом, при этом
образуются металл и вода:
CuO + H2 = Cu + H2O.
З а п о м н и т е! Основные оксиды с
основаниями и основными оксидами не
реагируют!
В ы в о д. В реакцию легче всего вступают
вещества с противоположными свойствами и не
вступают в реакцию вещества со сходными
свойствами.
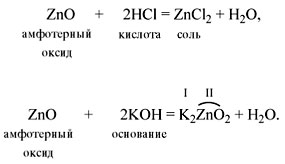
Свойства амфотерных оксидов
Амфотерные оксиды (от греч. amphi – двойной)
проявляют двойственные свойства: они могут
реагировать и с кислотами, и с основаниями
(точнее, со щелочами). При этом образуются соль и
вода. Например:
Задание 2.11. Составьте уравнения реакций
амфотерных оксидов из задания 2.5 с КОН и НNО3.
Задание 2.12. С какими из веществ – Н2О,
NаОН, НСl – могут реагировать следующие оксиды:
Cr2O3, CrO, SO3, V2O5?
Составьте уравнения возможных реакций.
Способы получения оксидов
Оксиды могут быть получены при разложении
некоторых кислот, оснований, солей:
H2SO3 = SO2 + H2O,
Cu(OH)2 = CuO + H2O,
Са(НСО3)2 = Н2О + СО2
+ СаСО3.
Оксиды обычно получают сжиганием в кислороде
простых и сложных веществ:
2Mg + O2 = 2MgO,
C + O2 = CO2,
2H2 + O2 = 2H2O,
CH4 + 2O2 = CO2 + 2H2O.
Обратите внимание: при сгорании сложного
вещества образуются оксиды элементов, которые
входят в его состав. Исключение составляют
только азот и галогены, которые выделяются в виде
простых веществ.
В ы в о д ы по главе 2.1
Молекулы оксидов состоят из атомов двух
элементов. Один из этих элементов – кислород.
Оксиды, образующие соли, бывают кислотными,
амфотерными и основными.
Оксиды реагируют с веществами, которые
проявляют противоположные свойства.
Основные оксиды реагируют с
кислотными оксидами или кислотами, кислотные
оксиды – с основными оксидами или
основаниями, амфотерные оксиды – и с кислотами, и
с основаниями (щелочами).
2.2. Кислоты
Кислоты – это сложные вещества, в состав
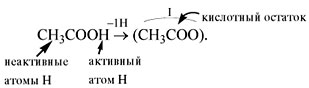
молекул которых входят активные атомы водорода и
кислотные остатки. Активный атом водорода в
химических реакциях способен замещаться на атом
металла, в результате чего всегда получается
соль.
В формулах неорганических кислот атом водорода
записывается на первом месте*.
Например:
В состав молекулы любой кислоты кроме атомов
водорода входит кислотный остаток. Кислотный
остаток – это часть молекулы кислоты без атомов
водорода (которые могут быть замещены на атом
металла). Валентность кислотного остатка равна
числу таких атомов водорода:
При определении валентности кислотного
остатка учитываются те атомы водорода, которые
участвовали в реакции или могут участвовать в
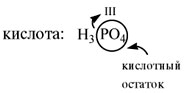
ней. Так, фосфорной кислоте Н3РО4 в
зависимости от условий могут соответствовать
кислотные остатки разного состава:
У органических кислот не все атомы водорода в
молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность
кислотных остатков для кислот, учитывая, что все
атомы водорода кислот активные:
HNO3, H2S, NaHCO3, H2SO3,
KOH, HMnO4.
По числу атомов водорода в молекулах кислоты
делят на одноосновные и многоосновные.
Например:
HCl – одноосновная кислота, т. к. в ее молекуле
один атом водорода;
Н2СО3 – двухосновная кислота, т. к. в
ее молекуле два атома водорода.
По составу кислоты делят на бескислородные
(НСl, Н2S) и кислородсодержащие (НСlO, Н2SO4).
Бескислородные кислоты представляют собой
растворы некоторых газов в воде, при этом и
растворенному газу, и полученному раствору
приписывают одинаковые свойства, хотя это не так.
Например, из простых веществ водорода и хлора
получается газ хлороводород:
H2 + Cl2 = 2HCl.
Этот газ не проявляет кислотных свойств, если
он сухой: его можно перевозить в металлических
емкостях, и никакой реакции не происходит.
Но при растворении хлороводорода в воде
получается раствор, который проявляет свойства
сильной кислоты. Такую кислоту перевозить в
металлических емкостях нельзя.
Названия бескислородных кислот составляют по
схеме:
элемент + водород + «ная» кислота.
Например: H2S – сероводородная кислота
(раствор газа сероводорода в воде).
Некоторые бескислородные кислоты имеют особые
(тривиальные) названия: НСl – соляная кислота
(раствор газа хлороводорода в воде), НF –
плавиковая кислота (раствор газа фтороводорода в
воде).
Задание 2.14. Дайте химические названия
соляной и плавиковой кислотам.
Кислородсодержащие кислоты могут быть
получены при действии воды на кислотные оксиды
(см. выше). Исходные кислотные оксиды называют
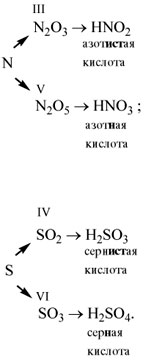
«ангидриды кислот»:
Метафосфорная кислота неустойчива и,
присоединяя воду, превращается в более
устойчивую ортофосфорную кислоту:
Или в суммарном виде:
Р2О5 + 3Н2О = 2Н3РО4
.
Таким образом, Р2O5 – ангидрид
фосфорной кислоты, а также некоторых других,
менее устойчивых кислот.
Обратите внимание: название
кислородсодержащей кислоты содержит в виде
корня название элемента, входящего в состав
ангидрида: фосфор Р
фосфорный ангидрид Р2О5 фосфорная кислота Н3РО4.
Если элементу соответствует несколько кислот,
то для кислоты с большей валентностью
элемента, входящего в состав ангидрида, в
названии употребляют суффиксы «н» или «в».
Для кислот с меньшей валентностью элемента в
название кислоты добавляют суффикс «ист».
Валентность элемента проще всего определять по
формуле ангидрида:
В названии сернистой кислоты основной суффикс
«ист», а суффикс «н» введен дополнительно для
благозвучия.
Сведения о названиях некоторых кислот обобщены
в табл. 3.
Таблица 3
Названия кислот
| Ангидрид | Кислота | Название |
| Нет | НС1 | Соляная, хлороводородная |
| CO2 | Н2СО3 | Угольная |
| SiO2 | …………… | Кремниевая |
| N2O3 | …………… | Азотистая |
| N2O5 | …………… | Азотная |
| SO2 | …………… | …………………….. |
| SO3 | …………… | …………………….. |
| P2O5 | …………… | …………………….. |
| CrO3 | …………… | Хромовая |
| Нет | H2S | Сероводородная |
Задание 2.15. Вместо пропусков в табл.
3 напишите формулы и названия соответствующих
кислот.
Задание 2.16. Напишите на память (никуда не
заглядывая) формулы кислот: кремниевой,
сернистой, серной, сероводородной, азотистой,
азотной, соляной, фосфорной, угольной. Укажите
ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их
способность образовывать соли. Соль образуется в
любой реакции, в которой участвует кислота, при
этом замещаются активные атомы водорода (один
или несколько).
• Кислоты реагируют с металлами. При этом атомы
водорода кислоты замещаются на атомы металла с
образованием растворимой соли и водорода.
Например:
Не все металлы способны вытеснять водород из
растворов кислот. Этот процесс возможен только
для тех металлов, которые стоят в ряду напряжений
(ряд активности) до водорода (рис. 3, см. с. 20):
 |
Рис. 3. Ряд напряжений металлов |
Задание 2.17. Составьте уравнения
возможных реакций:
серная кислота + алюминий,
соляная кислота + серебро,
бромоводородная кислота + цинк.
При составлении уравнений пользуйтесь рядом
напряжений. Не забывайте, составляя формулы
солей, учитывать валентности металла и
кислотного остатка.
Некоторые кислоты могут растворять металлы,
которые стоят в ряду напряжения после водорода,
но водород при этом не выделяется:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
• Кислоты реагируют с основаниями, образуя
соль и воду**. Это реакция
обмена, и поэтому валентность составных частей в
результате реакции не меняется:
Расставим коэффициенты:
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2
+ 6Н2О.
Задание 2.18. Составьте уравнения реакций:
серной кислоты и Fe(ОН)3,
соляной кислоты и Ва(ОН)2,
сернистой кислоты и NаОН.
Не забудьте порядок действий: составить
формулу соли по валентности металла и кислотного
остатка; расставить коэффициенты.
• Кислоты могут реагировать с солями. При этом
сильная кислота вытесняет более слабую из ее
соли.
К сильным кислотам относятся серная, азотная,
соляная и др.
К слабым кислотам относятся угольная,
кремниевая, сероводородная, азотистая.
В реакции обмена кислоты с солью образуются
новая соль и новая кислота. Например:
2HNO3 + CaCO3 = Ca(NO3)2 + H2CO3.
Более подробно о подобных реакциях см. главу 6.
Задание 2.19. Составьте, не обращаясь к
учебнику и пособиям, формулы: а) сильных кислот;
б) слабых кислот.
Задание 2.20. Составьте уравнения реакций:
соляная кислота + FeS,
азотная кислота + Na2SiO3,
серная кислота + K2CO3.
• Как обнаружить кислоту в растворе? Например,
в одном стакане налита вода, а в другом – раствор
кислоты. Как определить, где кислота? Хотя все
кислоты кислые на вкус, пробовать их нельзя, это
опасно. Выручают особые вещества – индикаторы.
Это соединения, которые изменяют цвет в
присутствии кислот.
Синий лакмус в кислоте становится красным;
оранжевый метилоранж тоже становится красным в
присутствии кислот.
В ы в о д ы по главе 2.2
Кислоты классифицируют:
по числу атомов водорода – на одноосновные,
двухосновные и т.д.;по наличию атома кислорода в составе
молекулы – на бескислородные и
кислородсодержащие;по силе – на сильные и слабые;
по устойчивости – на устойчивые и
неустойчивые.
Кислоты реагируют:
с активными металлами (стоящими в ряду
активности до Н),с основаниями,
с основными и амфотерными оксидами,
с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой
(«красной») области.
* В химических формулах
органических кислот атом водорода стоит в конце,
например CH3COOH – уксусная кислота.
** Реакция между кислотой и
основанием называется реакцией нейтрализации.
Продолжение следует