Часть
2. Оксиды.
Часть
3. Основания.
Часть
4. Амфотерные гидроксиды.
Часть
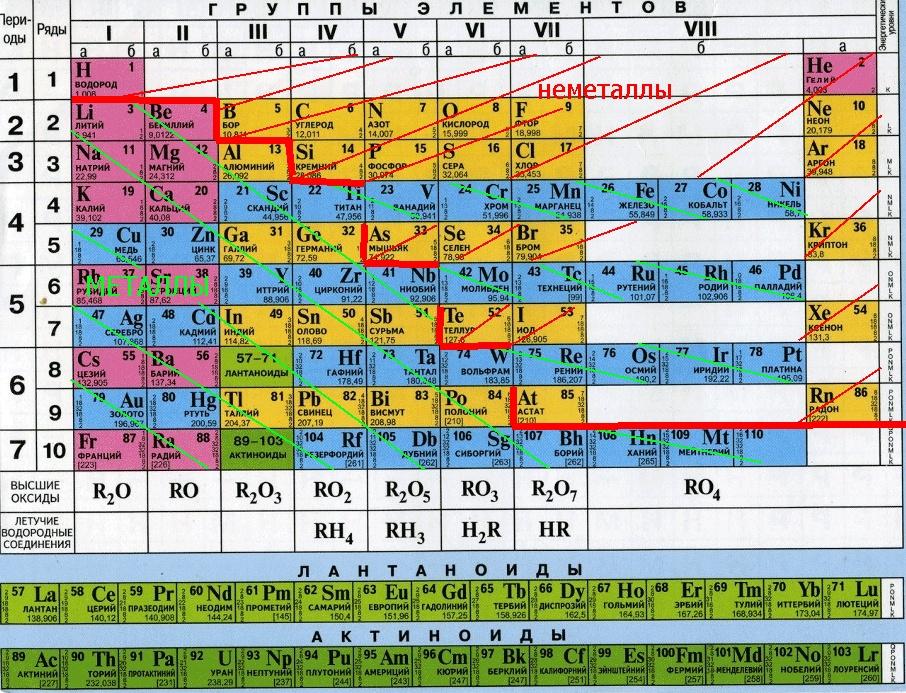
1.Классификация неорганических веществ.
К
важнейшим классам неорганических
веществ по традиции относят:
-
простые
вещества (металлы
и неметаллы),
-
оксиды
(кислотные,
основные и амфотерные), -
гидроксиды
(часть
кислот, основания, амфотерные гидроксиды), -
соли.
Простые
вещества
обычно делят на металлы
и неметаллы.
Металлы
–
простые вещества, в которых атомы связаны
между собой металлической связью.
Неметаллы
– простые вещества, в которых атомы
связаны между собой ковалентными (или
межмолекулярными) связями.
По
химическим свойствам среди металлов
выделяют группу так называемых амфотерных
металлов.
Это
название отражает способность
этих металлов, их оксидов и гидроксидов
реагировать как с кислотами, так и со
щелочами.
Оксиды
– бинарные соединения, одним из двух
элементов в которых является кислород
со
степенью окисления -2.
|
Основные |
Амфотерные |
Кислотные |
Несолеобразующие |
Солеобразные |
|
Оксиды |
Оксиды +2: +3 |
1) 2) |
Оксиды NO, |
Некоторые Fe3O4 |
|
С |
Каждому
солеобразующему оксиду соответствует
гидроксид:
Основным
оксидам соответствуют основания;
Амфотерным
оксидам – амфотерные гидроксиды,
Кислотным
оксидам – кислородсодержащие кислоты.
Гидроксиды
–
соединения, в состав которых входит
группа Э–О-Н.
И
основания, и кислородсодержащие кислоты,
и амфотерные гидроксиды – относятся к
ГИДРОКСИДАМ!
Связь
между оксидом и гидроксидами.
|
Степень |
Оксид |
Гидроксиды |
Примеры |
||
|
Основания |
Кислоты |
||||
|
+1 |
Э2О |
ЭОН |
НЭО |
КОН |
НClO |
|
+2 |
ЭО |
Э(ОН) |
Н2ЭО2 |
Ba(OH) |
? |
|
+3 |
Э2О3 |
Э(ОН) |
НЭО2 –(+H2O) Н3ЭО3 |
Al(OH) |
HNO2 H3PO3 |
|
+4 |
ЭО2 |
—– |
H2ЭО3 H |
—– |
Н2СО3 H |
|
+5 |
Э2О5 |
—– |
НЭО3 Н3ЭО4 |
—– |
HNO3 H3PO4 |
|
+6 |
ЭО3 |
—– |
H2ЭO4 |
—– |
H2SO4 |
|
+7 |
Э2О7 |
—– |
НЭО4 –(+ H |
—– |
HClO4 H5IO6 |
КАК
СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А.
Если чётная степень окисления элемента
в оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду.
Пример:
WO3
–(+H2O)
H2WO4
Б.
Если нечетная степень окисления:
|
Мета-форма |
Орто-форма |
Пример:
Оксид As2O5,
степень окисления мышьяка +5.
Составим
формулу кислоты: Н+As+5O-2x
Так
как суммарный заряд =0, легко рассчитать,
что х=3.
HAsO3
Это МЕТА-форма кислоты – мета-мышьяковая
кислота.
Но
для фосфора и мышьяка существует и более
устойчива ОРТО-форма. Прибавив к
мета-форме Н2О,
получим H3AsO4.
Это
орто-
мышьяковая
кислота.
Основания
–
сложные вещества, содержащие в своем
составе гидроксид-ионы ОН–
и при диссоциации образующие в
качестве анионов только эти ионы.
Типы
оснований
|
Растворимые |
Нерастворимые |
|
1) 2) Ca(OH)2, |
Все |
КИСЛОТНОСТЬ
основания – это число групп ОН в его
формуле:
однокислотные
– содержащие только 1 гидроксогруппу
двухкислотные
– имеющие 2 гидроксогруппу;
трёхкислотные
– с тремя группами ОН.
Кислоты
–
сложные вещества, содержащие в своем
составе ионы оксония Н+
или при взаимодействии с водой образующие
в качестве катионов только эти ионы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

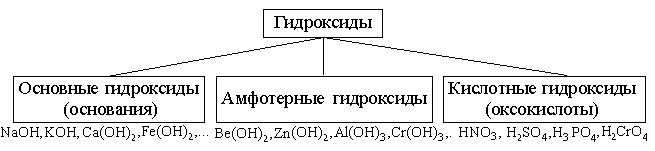
Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 8) Ca(OH)2 9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
Сегодня поговорим об очень большой группе соединений, которые называются гидроксиды. Как говорит учебник химии,
гидроксид – это химическое соединение, в котором есть группа –ОН.
Собственно, именно по этому признаку и можно определить, что перед нами гидроксид: в нём всегда есть одна или несколько гидроксильных групп –ОН.
Также запомните, что есть понятие «щёлочь». К щелочам относят гидроксиды металлов щелочных (то есть стоящих в первой группе таблицы Менделеева в основной подгруппе), щёлочноземельных (то есть стоящих во второй группе таблицы Менделеева в основной подгруппе) и аммония NH4+.
В чём разница между гидроксидами и щелочами
Щёлочь – понятие более узкое, гидроксид – более широкое. То есть щёлочь – всегда гидроксид, но гидроксид – не всегда щёлочь.
Например, гидроксид натрия NaOH. Натрий находится в первой группе периодической таблицы, это щелочной металл. Поэтому NaOH – это щёлочь. Но если вы назовёте его гидроксидом, ошибкой это не будет.
Другой пример. Гидроксид меди (II) Сu(OH)2 – это гидроксид, но никак не щёлочь (посмотрите в таблицу Менделеева. Медь находится в первой группе, но не в основной, а в побочной! Медь – не щелочной металл!). То есть назвать Сu(OH)2 щёлочью будет ошибкой, это гидроксид.
Как составить формулу гидроксида
Первым делом вспоминаем про валентность, без неё в химии никуда. Далее нужно понять, что группа ОН – это цельная структурная единица. Составляя формулу, мы всегда заключаем её в скобки (если ОН группа одна, то скобки не нужны), а индекс, маленькая цифра внизу справа, относится ко всей гидроксильной группе.
Также сразу запомните, что
группа –ОН всегда имеет валентность I.
Чтобы этот факт навсегда врезался вам в память, запомните следующее. Группа –ОН образуется из воды. Формула воды Н2О, это всем известно. Выглядит молекула воды так: Н-О-Н. То есть в ней две части Н– и –ОН. Каждая из этих частей имеет валентность I, это видно и из формулы:
Нам здесь важно, что гидроксильная группа имеет валентность I. Это надо запомнить.
Теперь переходим к практике и решению химии.
Пример 1.
Составьте формулу гидроксида калия.
Это очень просто. Калий в таблице Менделеева находится в первой группе в основной подгруппе, он имеет валентность I. Группа –ОН также имеет валентность I. Следовательно, формула гидроксида калия КОН.
Пример 2.
Составьте формулу гидроксида кальция.
Кальций находится в периодической таблице во второй группе в основной подгруппе, его валентность II. Тогда:
Здесь надо припомнить, как составляется формула вещества, если известна валентность. Нужно, чтобы произведение валентности и индекса у каждого элемента совпадало. Поэтому формула гидроксида кальция выглядит так:
Напоминаю, что если гидроксильных групп больше одной, то мы из заключаем в скобки. Обратите внимание, что такое написание (ОН)2 означает, что в формуле не два атома водорода, а две группы ОН!
Итак, формула гидроксида кальция – Ca(ОН)2.
Пример 3.
Составьте формулу гидроксида железа (III).
Валентность железа задана условиями, поэтому:
Отсюда следует:
Таким образом, формула гидроксида железа (III) – Fe(OH)3.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.

Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.

Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.

Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.

Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.

Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.

Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.

Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.

Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции – соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.

Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.


Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.

Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.

В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.

Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.

Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.

Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы – ОН.

Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.

Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.

Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.

Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.

Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.

Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.

Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.

Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.

Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.

Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.

Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.

Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.

Источник
Теперь необходимо справиться с задачей дать название этому типу солей.

Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.

Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.

В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.

Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.

