Кислоты бывают:
-
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
-
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
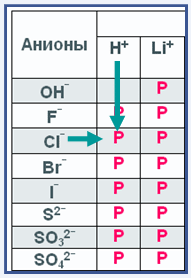
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН– все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl– мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
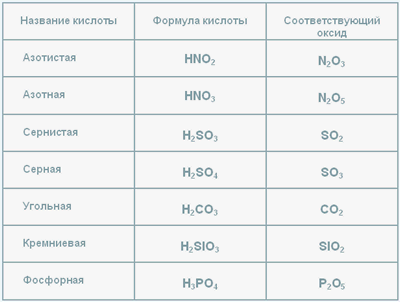
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 – формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2 или SO3.
Таблица кислот и оксидов
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
Пошаговый алгоритм определения степени окисления атомов. Составление формул веществ.
Шаг 1. Выяснить, что понимают под степенью окисления.
С.О.-условный заряд атома, вычисленный из предположения, что все связи атома ионные.
Шаг 2. Вспомнить что такое электроотрицательность.
ЭО- способность атомов химических элементов оттягивать к себе общие электронные пары.
Закономерности изменений значений ЭО в группах и периодах ПС с ростом порядкового номера:
Шаг 3. Выучить правила определения С.О.
Правила определения степеней окисления
1. В простом веществе степень окисления атомов равна 0
2. Сумма степеней окисления атомов в нейтральном соединении равна 0
3. В бинарном соединении С.О. более электроотрицательного атома «-«
менее электроотрицательного « +»
4. Cтепени окисления атомов некоторых элементов в соединениях:
а) фтора (F) –1;
б) металлов Iа группы (Li, Na, K, Rb, Cs) +1, металлов IIа группы (Be, Mg, Ca, Sr, Ba) +2, алюминия (Al) +3;
в) водорода (Н) в соединениях с металлами -1, в остальных соединениях+1;
г) кислорода (О) во фториде OF2 +2,
в перфториде O2F2 +1 ,в остальных пероксидах (содержат группу –О–О–) –1,
в остальных соединениях -2
У остальных неМЕ СО (как правило) – переменная.
-maxСО =№ группы
-minСО=№ группы -8
-между ними такая же четная или нечетная как № группы (иск. фтор, кислород, азот).
Шаг 4.Определить СО по молекулярной формуле.
Алгоритм определения степеней окисления по формуле:
1.Определение степеней окисления начинают с того элемента, у которого С.О. постоянная или известна в соответствии с правилами (см. выше); (Р2О-25);
2.Умножить эту С.О. на индекс атома (или группы) (– 2 * 5 = – 10);
3.Полученное число разделить на индекс второго элемента (или группы) (– 10 / 2 = – 5);
4.Записать полученную С.О. с противоположным знаком (Р+52О-25).
Шаг 5. Научись составлять эмпирические формулы веществ по СО атомов или групп атомов.
Алгоритм составления формул:
1.Запиши знаки элементов, образующих соединение, укажи СО атомов; Al +3O-2
2. Для СО найди наименьшее общее кратное (НОК); НОК (2,3)=6
3. Рассчитай число атомов в соединении, для этого раздели НОК на значения СО; 6/3=2; 6/2=3 Al 2+3O–32
Шаг 6. Научись определять СО по структурной формуле (задание повышенной сложности).
Алгоритм определения:
1.Составь структурную формулу вещества.
2. Обозначь стрелкой на валентном штрихе направление смещения электронной плотности, используя значения ЭО.
3. Рассчитай значения СО атомов.
Cl-1
Ca+2
O-2 Cl+1 ;
Степень окисления — это условный заряд атома химического элемента в веществе.
Правила:
1. Степень окисления элемента в простом веществе равна (0):
,
O20
,
N20
,
F20
,
Cl20
,
Fe0
,
Ca0
.
2. В сложных веществах:
- степень окисления водорода в соединениях с неметаллами равна (+1), а в соединениях с металлами — (–1):
- степень окисления кислорода равна (–2) (исключения: O+2F−12, H+12O−12):
- степень окисления фтора всегда равна (–1):
- степень окисления металла — положительная и совпадает с его валентностью. Может быть постоянной и переменной:
,
K+1
,
Ca+2
,
Mg+2
,
Al+3
;
- степень окисления неметалла может быть как положительная, так и отрицательная. Численные значения тоже совпадают с валентностью:
,
N+4
,
N+3
,
N+2
,
N+1
,
N−3
;
3. Сумма степеней окисления элементов в веществе равна (0).
Пример:
.
Составление формул по известным степеням окисления элементов
Пример:
составим формулу соединения кальция и азота. Степень окисления кальция равна (+2), а азота — (–3).
Запишем символы химических элементов рядом. Первым обычно записывают символ элемента, у которого степень окисления положительная. Укажем значения степеней окисления над символами:
Найдём для них наименьшее общее кратное и разделим на соответствующие значения степеней окисления. Получим индексы в формуле:
Как составить формулу фосфорной кислоты по степени окисления.
И как это вообще делается))).
На этой странице сайта, в категории Химия размещен ответ на вопрос
Как составить формулу фосфорной кислоты по степени окисления?. По уровню сложности вопрос рассчитан на учащихся
5 – 9 классов. Чтобы получить дополнительную информацию по
интересующей теме, воспользуйтесь автоматическим поиском в этой же категории,
чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы
расположена кнопка, с помощью которой можно сформулировать новый вопрос,
который наиболее полно отвечает критериям поиска. Удобный интерфейс
позволяет обсудить интересующую тему с посетителями в комментариях.