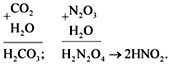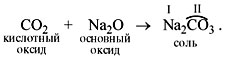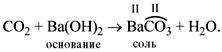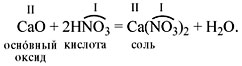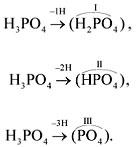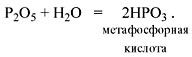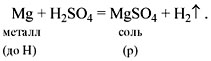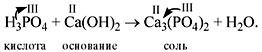Как составить химические формулы кислот соответствующих оксидам?
Ученик
(63),
закрыт
8 лет назад
Александр Титов
Гений
(50738)
9 лет назад
Просто добавить воду в формулу и записать формулу соответствующей кислоты.
На первом месте будет водород, на втором – неметалл, на третьем – кислород.
Например,
Кислотному оксиду SO3 соответствует кислота H2SO4
SO3 + H2O – всего водорода 2 атома, его на 1-е место ставим H2**, далее один атом серы – ставим его после водорода
H2S*, ещё остаётся кислород – три атома от SO3 и один от H2O – итого 4, ставим после серы и получаем H2SO4.
В случае, если атомы в молекуле можно сократить на одно и то же число – сокращаем.
Например, способом выше из N2O5 и H2O получится формально H2N2O6 – сокращаем на 2 и получаем HNO3.
Есть и особые случаи, например, оксиду P2O5 соответствует как метафосфорная (HPO3), так и ортофосфорная (H3PO4) кислота. В первом случае молекул воды условно добавили 2 штуки.
Ещё надо помнить, что не все оксиды являются солеобразующими – несолеобразующим оксидам не соответствуют никакие кислоты, таковы, например, оксиды N2O, NO, CO. Нельзя формально написать, например, H2NO2 – нет такой кислоты.
При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
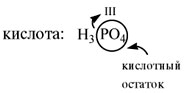
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как составить реакции с оксидами
Реакция 1. Основный оксид + кислотный оксид → соль
Тип реакции – реакция соединения.
Чтобы составить уравнение этой реакции, надо проделать следующие действия:
- Определить идёт ли реакция?
Реакция осуществима, если оксид металла образован элементами из IA и II A групп.
- Определить по формуле кислотного оксида химическую формулу соответствующей ему кислоты, формулу кислотного остатка и его валентность.
- Определить по формуле основного оксида валентность металла.
- Составить по валентностям формулу соли.
- Записать уравнение реакции и подобрать в нем коэффициенты.Пример: Написать уравнение реакции: MgO + N2О5 → …?
Действуем по плану:
- Складываем (в уме или на черновике) формулы кислотного оксида и воды:
- Определяем формулу кислотного остатка NO3, валентность I (равна количеству Н в кислоте).
- По формуле MgO легко находится валентность магния – II.
- Составляем формулу соли: Mg(NO3)2
- Записываем, уравнение реакции и подбираем в нем коэффициенты:
MgO + N2O5 → Mg(NО3)2
Реакция 2. основный оксид + кислота → соль + вода
Тип реакции — реакция обмена.
Составить уравнение этой реакции проще, чем уравнение реакции 1, потому что формула кислоты нам уже известна; зная ее, просто получить и формулу кислотного остатка, и его валентность.
Дальше поступаем так же, как и в предыдущем примере. При составлении уравнения реакции не забудем, что выделяется вода!
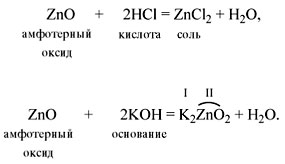
Пример: Составьте уравнение реакции между оксидом алюминия и хлороводородной кислотой.
- Вспомним формулу хлороводородной кислоты — НСl, её остаток Сl (хлорид) имеет валентность I.
- По периодической системе Д.И. Менделеева установим, что валентность алюминия III и формула его оксида Аl2Оз.
- Составим формулу продукта реакции – соли (хлорида алюминия): АlСlз.
- Запишем уравнение реакции и подберем в нем коэффициенты:
Аl2Оз + 6HCl → АlСlз + 3H2O
Реакция 3. Кислотный оксид + основание → соль + вода
Тип реакции – реакция обмена.
Для составления уравнения такой реакции следует выполнить действия:
- По формуле кислотного оксида определить формулу его кислоты, формулу кислотного остатка и его валентность (точно так же, как и при составлении реакции 1).
- По формуле гидроксида найти валентность металла: это просто, ведь она равна числу гидроксогрупп (ОН). Если формула гидроксида неизвестна, ее придется составить, используя таблицу растворимости.
- Дальше поступаем, как и в предыдущих примерах: надо составить формулу соли, записать уравнение реакции (не забыть про воду!) и подобрать коэффициенты.
Пример: Составьте уравнение реакции, происходящей при пропускании углекислого газа через известковую воду.
- Вспомним, что углекислый газ — это оксид углерода (IV) СО2, а известковой водой называется водный раствор гидроксида кальция Са(ОН)2.
- Определим, что оксиду углерода (IV) соответствует угольная кислота Н2СОз; ее кислотный остаток СОз (карбонат) имеет валентность II.
- Не представляет труда вывести формулу продукта реакции — карбоната кальция СаСОз.
- Осталось составить уравнение реакции: СаО + СО2 → СаСОз.
Реакция 4. Основный оксид + вода → основание
Тип реакции — реакция соединения.
Определить идёт ли реакция?
Реакция осуществима, если оксид металла образован элементами из IA и II A групп.
Составить уравнение этой реакции не составит труда, если вы умеете составлять формулы оснований и оксидов.
Пример: Написать уравнение реакции: Н2O + Na2O → …?
Н2O + Na2O → 2NaOH
Реакция 5. Кислотный оксид + вода → кислота
Тип реакции — реакция соединения.
Определить идёт ли реакция?
Реагируют все оксиды, кроме оксида кремния SiO2.
Составление уравнения этой реакции: по формуле кислотного оксида определить формулу его кислоты, точно так же, как и при составлении реакции 1).
Пример: Написать уравнение реакции: Н2O + N2О5 → …?
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13/2007
Глава 2. Важнейшие классы
неорганических соединений
2.1. Оксиды
Оксиды – сложные вещества, которые состоят из
атомов двух химических элементов, один из
которых кислород.
Определим, какое из следующих соединений оксид:
PH3, H3PO4, P2O5.
К оксидам относят соединение P2O5.
Два других вещества – не оксиды: в состав РН3
не входит атом кислорода, а в состав H3PO4 входят
атомы трех химических элементов – H, Р, O.
Названия оксидов складываются из двух слов:
первое слово – «оксид», второе слово – название
химического элемента, образующего данный оксид,
в родительном падеже. Например: СаО – оксид
кальция.
Если оксид образован химическим элементом с
переменной валентностью, то после названия
элемента нужно указать его валентность.
Например: Fe2О3 – оксид железа(III), FеО –
оксид железа(II).
Задание 2.1. Среди следующих соединений
найдите оксиды и назовите их:
N2O3, NH3, MnO2, H2O,
HCl, NaOH, Na2O, P2O5, H2SO4.
Задание 2.2. Составьте формулы следующих
оксидов:
оксид хрома(III), оксид углерода(IV), оксид магния,
оксид серы(VI), оксид азота(V), оксид калия, оксид
марганца(VI).
Многие оксиды могут реагировать с кислотами
или основаниями. В таких реакциях получаются
соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов,
которые к таким реакциям не способны. Такие
оксиды называют несолеобразующими.
Задание 2.3. Назовите несолеобразующие оксиды:
H2O, CO, N2O, NO, F2O.
Некоторые оксиды имеют особые (тривиальные)
названия: Н2О – вода, СО – угарный газ, СО2
– углекислый газ и др.
Солеобразующие оксиды подразделяют на три
группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только
изучая его химические свойства. Например,
кислотные оксиды реагируют с основаниями и не
реагируют с кислотами. Основные оксиды реагируют
с кислотами и не реагируют с основаниями.
Амфотерные оксиды могут реагировать и с
кислотами, и с основаниями.
По формуле оксида можно определить, какими
свойствами он обладает. Правда, иногда эта оценка
будет приблизительной.
• Неметаллы образуют только кислотные и
безразличные оксиды.
• Металлы в зависимости от валентности могут
образовывать разные оксиды – основные, амфотерные
и кислотные.
Предсказать свойства оксида металла может
помочь эта схема:
Основные оксиды металлов от кислотных оксидов
металлов отличить легко: малая валентность
металла – основный оксид, большая – кислотный.
Как быть с амфотерными оксидами? «Любимая»
валентность металлов в этих оксидах III, но есть и
исключения. Поэтому желательно запомнить
формулы наиболее часто встречающихся амфотерных
оксидов: ZnO, Al2O3, SnO, PbO, Cr2O3.
Задание 2.4. Назовите амфотерные оксиды:
ZnO, SnO, PbO, Al2O3, Cr2O3.
Задание 2.5. Классифицируйте приведенные
ниже оксиды:
V2O5, SO2, ZnO, Fe2O3,
SO3, CO2, Li2O, FeO, Al2O3, H2O,
BaO.
Задание рекомендуется выполнить по следующей
схеме.
1) Определить, какой это оксид – солеобразующий
или несолеобразующий.
2) Определить, какой элемент входит в состав
солеобразующего оксида – металл или неметалл.
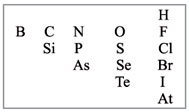
Для этого надо выписать из таблицы
Д.И.Менделеева символы элементов-неметаллов. Они
расположены в главных подгруппах на линии бор –
астат и выше этой линии (рис. 1).
|
|
Рис. 1. Элементы-неметаллы
|
3) Если в состав оксида входит атом
неметалла, то оксид кислотный.
4) Если в состав оксида входит атом металла, то
следует определить его валентность и по ней
выяснить характер оксида – основный, амфотерный
или кислотный.
Например: Cr2O3 – амфотерный, т.к. хром
– металл с валентностью III;
N2O3 – кислотный оксид, т.к. азот –
неметалл;
CrO3 – кислотный оксид, т.к. хром – металл с
высокой валентностью VI.
Зная характер оксида, можно описать его
свойства.
Свойства кислотных оксидов
• Кислотные оксиды реагируют c водой, образуя
кислоты. Например:
CO2 + H2O = H2CO3.
Чтобы составить формулу кислоты, нужно сложить
все атомы исходных веществ, записывая на первом
месте атом водорода, на втором – элемент,
образующий оксид, и на последнем – кислород. Если
индексы получились четными, то их можно
сократить:
N2O3 + H2O = H2N2O4
(2HNO2).
Эти же реакции можно записать в виде
арифметического примера:
Задание 2.6. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с водой.
• Кислотные оксиды реагируют с осно?вными
оксидами, образуя соли соответствующей кислоты,
т.е. соль той кислоты, которая образуется при
взаимодействии этого оксида с водой. Например:
Чтобы составить такое уравнение, нужно
действовать по следующей схеме.
1) Составить формулу кислоты (прибавив к
молекуле оксида молекулу воды):
CO2 + H2O = H2CO3.
2) Определить валентность кислотного остатка
(это часть молекулы кислоты без атомов водорода).
В данном случае кислотный остаток имеет
состав СО3, его валентность равна числу
атомов водорода в кислоте, т.е. II.
3) Cоставить формулу соли, записав вместо атомов
водорода атом металла из основного оксида с его
валентностью (в данном случае натрий).
4) Составить формулу соли по валентности
металла и кислотного остатка: Na2CO3.
Задание 2.7. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с оксидом
кальция.
• Кислотные оксиды реагируют с основаниями,
образуя соль соответствующей кислоты и воду.
Например:
Принципы составления уравнений реакций с
основаниями те же, что и для реакций с
осно?вными оксидами (см. выше).
Задание 2.8. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с гидроксидом
натрия NаОН.
З а п о м н и т е! Кислотные оксиды ни с кислотами,
ни c кислотными оксидами не реагируют.
Свойства основных оксидов
• Основные оксиды реагируют с водой,
образуя основания. Реакция протекает, если
получающееся основание растворимо в воде.
Общая формула оснований – М(ОН)х, где х
– число ОН-групп, равное валентности металла М.
Например:
СаО + Н2О = Са(ОН)2,
Fe2O3 + Н2О нет реакции.
Последняя реакция не идет, т.к. основание Fe(ОН)3
нерастворимо в воде. Растворимость веществ в
воде можно определить по таблице растворимости
(рис. 2).
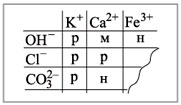 |
Рис. 2.
|
Условные обозначения: р – растворимо в воде, м
– малорастворимо в воде,
н – нерастворимо в воде.
При определении возможности протекания данной
реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он
образован активным металлом. Эти металлы стоят в
ряду напряжений до магния: Li, K, Ba, Ca, Na, Mg…
Задание 2.9. Составьте уравнения реакций основных
оксидов из задания 2.5 с водой.
• Основные оксиды реагируют с
кислотами, образуя соль и воду:
Обратите внимание: при составлении формулы
соли нужно вместо атомов водорода в формуле
кислоты написать символ металла, а затем
расставить индексы согласно валентности.
Задание 2.10. Составьте уравнения реакций
осно?вных оксидов из задания 2.5 с Н2SО4.
• Основные оксиды реагируют с
кислотными оксидами, образуя соли.
• Некоторые основные оксиды
реагируют при нагревании с водородом, при этом
образуются металл и вода:
CuO + H2 = Cu + H2O.
З а п о м н и т е! Основные оксиды с
основаниями и основными оксидами не
реагируют!
В ы в о д. В реакцию легче всего вступают
вещества с противоположными свойствами и не
вступают в реакцию вещества со сходными
свойствами.
Свойства амфотерных оксидов
Амфотерные оксиды (от греч. amphi – двойной)
проявляют двойственные свойства: они могут
реагировать и с кислотами, и с основаниями
(точнее, со щелочами). При этом образуются соль и
вода. Например:
Задание 2.11. Составьте уравнения реакций
амфотерных оксидов из задания 2.5 с КОН и НNО3.
Задание 2.12. С какими из веществ – Н2О,
NаОН, НСl – могут реагировать следующие оксиды:
Cr2O3, CrO, SO3, V2O5?
Составьте уравнения возможных реакций.
Способы получения оксидов
Оксиды могут быть получены при разложении
некоторых кислот, оснований, солей:
H2SO3 = SO2 + H2O,
Cu(OH)2 = CuO + H2O,
Са(НСО3)2 = Н2О + СО2
+ СаСО3.
Оксиды обычно получают сжиганием в кислороде
простых и сложных веществ:
2Mg + O2 = 2MgO,
C + O2 = CO2,
2H2 + O2 = 2H2O,
CH4 + 2O2 = CO2 + 2H2O.
Обратите внимание: при сгорании сложного
вещества образуются оксиды элементов, которые
входят в его состав. Исключение составляют
только азот и галогены, которые выделяются в виде
простых веществ.
В ы в о д ы по главе 2.1
Молекулы оксидов состоят из атомов двух
элементов. Один из этих элементов – кислород.
Оксиды, образующие соли, бывают кислотными,
амфотерными и основными.
Оксиды реагируют с веществами, которые
проявляют противоположные свойства.
Основные оксиды реагируют с
кислотными оксидами или кислотами, кислотные
оксиды – с основными оксидами или
основаниями, амфотерные оксиды – и с кислотами, и
с основаниями (щелочами).
2.2. Кислоты
Кислоты – это сложные вещества, в состав
молекул которых входят активные атомы водорода и
кислотные остатки. Активный атом водорода в
химических реакциях способен замещаться на атом
металла, в результате чего всегда получается
соль.
В формулах неорганических кислот атом водорода
записывается на первом месте*.
Например:
В состав молекулы любой кислоты кроме атомов
водорода входит кислотный остаток. Кислотный
остаток – это часть молекулы кислоты без атомов
водорода (которые могут быть замещены на атом
металла). Валентность кислотного остатка равна
числу таких атомов водорода:
При определении валентности кислотного
остатка учитываются те атомы водорода, которые
участвовали в реакции или могут участвовать в
ней. Так, фосфорной кислоте Н3РО4 в
зависимости от условий могут соответствовать
кислотные остатки разного состава:
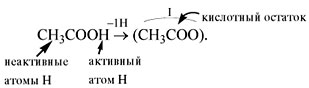
У органических кислот не все атомы водорода в
молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность
кислотных остатков для кислот, учитывая, что все
атомы водорода кислот активные:
HNO3, H2S, NaHCO3, H2SO3,
KOH, HMnO4.
По числу атомов водорода в молекулах кислоты
делят на одноосновные и многоосновные.
Например:
HCl – одноосновная кислота, т. к. в ее молекуле
один атом водорода;
Н2СО3 – двухосновная кислота, т. к. в
ее молекуле два атома водорода.
По составу кислоты делят на бескислородные
(НСl, Н2S) и кислородсодержащие (НСlO, Н2SO4).
Бескислородные кислоты представляют собой
растворы некоторых газов в воде, при этом и
растворенному газу, и полученному раствору
приписывают одинаковые свойства, хотя это не так.
Например, из простых веществ водорода и хлора
получается газ хлороводород:
H2 + Cl2 = 2HCl.
Этот газ не проявляет кислотных свойств, если
он сухой: его можно перевозить в металлических
емкостях, и никакой реакции не происходит.
Но при растворении хлороводорода в воде
получается раствор, который проявляет свойства
сильной кислоты. Такую кислоту перевозить в
металлических емкостях нельзя.
Названия бескислородных кислот составляют по
схеме:
элемент + водород + «ная» кислота.
Например: H2S – сероводородная кислота
(раствор газа сероводорода в воде).
Некоторые бескислородные кислоты имеют особые
(тривиальные) названия: НСl – соляная кислота
(раствор газа хлороводорода в воде), НF –
плавиковая кислота (раствор газа фтороводорода в
воде).
Задание 2.14. Дайте химические названия
соляной и плавиковой кислотам.
Кислородсодержащие кислоты могут быть
получены при действии воды на кислотные оксиды
(см. выше). Исходные кислотные оксиды называют
«ангидриды кислот»:
Метафосфорная кислота неустойчива и,
присоединяя воду, превращается в более
устойчивую ортофосфорную кислоту:
Или в суммарном виде:
Р2О5 + 3Н2О = 2Н3РО4
.
Таким образом, Р2O5 – ангидрид
фосфорной кислоты, а также некоторых других,
менее устойчивых кислот.
Обратите внимание: название
кислородсодержащей кислоты содержит в виде
корня название элемента, входящего в состав
ангидрида: фосфор Р
фосфорный ангидрид Р2О5 фосфорная кислота Н3РО4.
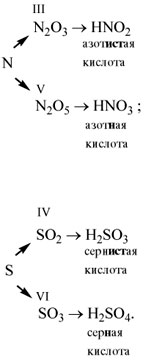
Если элементу соответствует несколько кислот,
то для кислоты с большей валентностью
элемента, входящего в состав ангидрида, в
названии употребляют суффиксы «н» или «в».
Для кислот с меньшей валентностью элемента в
название кислоты добавляют суффикс «ист».
Валентность элемента проще всего определять по
формуле ангидрида:
В названии сернистой кислоты основной суффикс
«ист», а суффикс «н» введен дополнительно для
благозвучия.
Сведения о названиях некоторых кислот обобщены
в табл. 3.
Таблица 3
Названия кислот
| Ангидрид | Кислота | Название |
| Нет | НС1 | Соляная, хлороводородная |
| CO2 | Н2СО3 | Угольная |
| SiO2 | …………… | Кремниевая |
| N2O3 | …………… | Азотистая |
| N2O5 | …………… | Азотная |
| SO2 | …………… | …………………….. |
| SO3 | …………… | …………………….. |
| P2O5 | …………… | …………………….. |
| CrO3 | …………… | Хромовая |
| Нет | H2S | Сероводородная |
Задание 2.15. Вместо пропусков в табл.
3 напишите формулы и названия соответствующих
кислот.
Задание 2.16. Напишите на память (никуда не
заглядывая) формулы кислот: кремниевой,
сернистой, серной, сероводородной, азотистой,
азотной, соляной, фосфорной, угольной. Укажите
ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их
способность образовывать соли. Соль образуется в
любой реакции, в которой участвует кислота, при
этом замещаются активные атомы водорода (один
или несколько).
• Кислоты реагируют с металлами. При этом атомы
водорода кислоты замещаются на атомы металла с
образованием растворимой соли и водорода.
Например:
Не все металлы способны вытеснять водород из
растворов кислот. Этот процесс возможен только
для тех металлов, которые стоят в ряду напряжений
(ряд активности) до водорода (рис. 3, см. с. 20):
 |
Рис. 3. Ряд напряжений металлов |
Задание 2.17. Составьте уравнения
возможных реакций:
серная кислота + алюминий,
соляная кислота + серебро,
бромоводородная кислота + цинк.
При составлении уравнений пользуйтесь рядом
напряжений. Не забывайте, составляя формулы
солей, учитывать валентности металла и
кислотного остатка.
Некоторые кислоты могут растворять металлы,
которые стоят в ряду напряжения после водорода,
но водород при этом не выделяется:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
• Кислоты реагируют с основаниями, образуя
соль и воду**. Это реакция
обмена, и поэтому валентность составных частей в
результате реакции не меняется:
Расставим коэффициенты:
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2
+ 6Н2О.
Задание 2.18. Составьте уравнения реакций:
серной кислоты и Fe(ОН)3,
соляной кислоты и Ва(ОН)2,
сернистой кислоты и NаОН.
Не забудьте порядок действий: составить
формулу соли по валентности металла и кислотного
остатка; расставить коэффициенты.
• Кислоты могут реагировать с солями. При этом
сильная кислота вытесняет более слабую из ее
соли.
К сильным кислотам относятся серная, азотная,
соляная и др.
К слабым кислотам относятся угольная,
кремниевая, сероводородная, азотистая.
В реакции обмена кислоты с солью образуются
новая соль и новая кислота. Например:
2HNO3 + CaCO3 = Ca(NO3)2 + H2CO3.
Более подробно о подобных реакциях см. главу 6.
Задание 2.19. Составьте, не обращаясь к
учебнику и пособиям, формулы: а) сильных кислот;
б) слабых кислот.
Задание 2.20. Составьте уравнения реакций:
соляная кислота + FeS,
азотная кислота + Na2SiO3,
серная кислота + K2CO3.
• Как обнаружить кислоту в растворе? Например,
в одном стакане налита вода, а в другом – раствор
кислоты. Как определить, где кислота? Хотя все
кислоты кислые на вкус, пробовать их нельзя, это
опасно. Выручают особые вещества – индикаторы.
Это соединения, которые изменяют цвет в
присутствии кислот.
Синий лакмус в кислоте становится красным;
оранжевый метилоранж тоже становится красным в
присутствии кислот.
В ы в о д ы по главе 2.2
Кислоты классифицируют:
по числу атомов водорода – на одноосновные,
двухосновные и т.д.;по наличию атома кислорода в составе
молекулы – на бескислородные и
кислородсодержащие;по силе – на сильные и слабые;
по устойчивости – на устойчивые и
неустойчивые.
Кислоты реагируют:
с активными металлами (стоящими в ряду
активности до Н),с основаниями,
с основными и амфотерными оксидами,
с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой
(«красной») области.
* В химических формулах
органических кислот атом водорода стоит в конце,
например CH3COOH – уксусная кислота.
** Реакция между кислотой и
основанием называется реакцией нейтрализации.
Продолжение следует