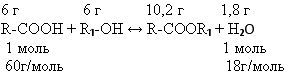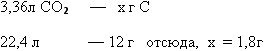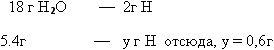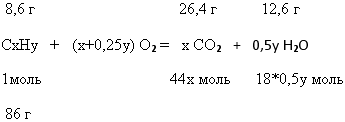Кристаллогидратами называют кристаллические вещества, в состав которых входят молекулы воды.
Формулу кристаллогидрата можно представить состоящей из двух частей:
из безводного вещества (A) и воды, то есть
A⋅xH2O
, где (x) — коэффициент, относящийся к формуле воды.
Для того чтобы рассчитать формулу кристаллогидрата, нужно найти численное значение этого коэффициента.
Чтобы рассчитать количество безводного вещества и количество вещества воды, необходимо знать их массу. Если принять, что масса кристаллогидрата, формулу которого необходимо рассчитать, составляет (100) г, массы компонентов, входящих в его состав, окажутся численно равны их массовым долям, выраженным в процентах.
Пример:
если массовая доля (A) в соединении равна (20)
%
, это означает, что в (100) г соединения находится (20) г данного вещества.
Если в состав кристаллогидрата входят (A) и вода, его формулу в общем виде можно записать как
A⋅xH2O
, где
1:x=nA:nH2O
. Причём
nA=mAMA
, а
nH2O=mH2OMH2O
.

Формула химического соединения показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы или формульной единицы. Массовые соотношения элементов в молекулах можно представить как отношение произведений соответствующих атомных масс на число атомов каждого элемента в молекуле, т.е. можно записать:
m1 : m2 : m3 = xA1 : yA2 : zA3,
где m1, m2, m3 – содержание элементов в соединении (%); x, y, z – число атомов этих элементов в молекуле или в формульной единице; А1, А2, А3 – атомные массы элементов. Из этого уравнения следует
x : y : z = m1 : m2 : m3 , A1 A 2 A3
что позволяет находить отношение между числами атомов в молекуле.
Пример. Необходимо определить формулу вещества, которое со-
держит натрий (32,43 %), серу (22,55 %) и кислород (45,02 %).
Соотношение чисел атомов в формуле данного соединения: x : y : z = 32,4323 : 22,5532 : 45,0216 =1,41: 0,705: 2,82
Если самое меньшее число (0,705) принять за единицу, то данное отношение становится отношением целых чисел:
x : y : z = 2 : 1 : 4,
следовательно, формула соединения Na2SO4. Эта формула будет простейшей, поскольку полученное соотношение может быть выражено также и числами, кратными найденным.
Для установления истинной, или молекулярной, формулы необходимо знать молекулярную (молярную) массу соединения; это позволяет найти истинное соотношение атомов в молекуле. Так, например, бензол содержит углерод (92,3 %) и водород (7,7 %). Найденная из этого состава простейшая формула СН. Но в действительности молекулярная масса бензола, определяемая по плотности его пара, равна не 13 (12 + 1), а 78. Следовательно, истинная формула бензола С6Н6.
Кристаллогидратами называются кристаллические вещества, включающие молекулы воды, например гипс CaSO4·2Н2О, медный купорос CuSO4·5H2O и т.д. Кристаллогидраты при нагревании теряют кристаллизационную воду, переходя в безводные соли. Пользуясь этим,
22
можно определить содержание воды в кристаллогидрате, а затем, зная формулу безводной соли, рассчитать число молекул воды, присоединяющихся к одной молекуле безводной соли.
Экспериментальная часть
Целью работы является определение количества (моль) воды в кристаллогидрате – медном купоросе.
Ход работы.1. Взвесить пустой фарфоровый тигель с точностью до 0,01 г. Во взвешенный тигель насыпать 0,5–1 г медного купороса. Тигель с кристаллогидратом снова взвесить.
2.Поместить тигель в нагретую песочную баню на 20–30 минут.
3.Перенести щипцами тигель в эксикатор и охладить.
4.Взвесить охлажденный тигель.
5.Повторить прогревание тигля, снова охладить его в эксикаторе и взвесить. Если масса изменилась не более чем на 0,01 г, прогревание прекратить. По результатам последнего взвешивания заполнить таблицу результатов опыта:
|
Масса |
Масса тиг- |
Масса |
Масса тигля |
Масса |
Масса |
|
пустого |
ля с кри- |
кристалло- |
с веществом |
безводной |
воды, г |
|
тигля, г |
сталлогид- |
гидрата, г |
после про- |
соли, г |
|
|
ратом, г |
каливания, г |
||||
7.Вычислить количество воды, приходящееся на один моль CuSO4,
изаписать формулу медного купороса, определенную опытным путем.
8.Определить относительную погрешность опыта, исходя из того, что реальная формула медного купороса CuSO4·5H2O.
9.Сделать вывод о проделанной работе.
Контролирующие задания
1.Какие вещества называются кристаллогидратами? Приведите примеры кристаллогидратов.
2.Расположите по увеличению количества сульфаты натрия, лития, бария, цезия, если их массы одинаковы.
3.Для чего применяются в химическом эксперименте тигель, эксикатор, песчаная баня.
4.Какова формула соединения водорода с кислородом, если мольное соотношение Н:О = 1:1, а плотность его газа по водороду равна 17?
5.Определить формулу кристаллической соды, если при нагревании 286 г данной соли образовалось 106 г карбоната натрия.
23
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Установление формулы вещества по массовым долям элементов, входящих в его
состав.
Задача 1. Массовые доли меди и кислорода в оксиде меди соответственно
равны 88,8% и 11,2%. Установить простейшую формулу вещества.
1. Сумма массовых долей меди и кислорода составляет 100%. Следовательно,
других элементов в веществе нет.
2. Находим соотношение между числами молей атомов меди и кислорода:
v(Cи):v(O)=88,8/64:11,2/16=1,39:0,7=1,39/0,7:0,7/0,7=2:1
Следовательно, простейшая формула: Си2О
Задача 2. В оксиде серы на 2 массовые части серы приходится 3 массовые
части кислорода. Установить формулу вещества.
v (S):v(O) =2/32:3/16 = 0,0625:0,1875 = 1:3
Следовательно, на 1 атом серы приходится 3 атома кислорода. Формула: SO3
Задача 3. Найти формулу кристаллогидрата сульфата алюминия, содержащего
48,6 масс % кристаллизационной воды.
В общем виде формула кристаллогидрата может быть записана как Al2(SO4)3*n
H2O Решение задачи сводится к нахождению величины n. Если
кристаллогидрат содержит 48,6 масс % воды ,то это значит, что 100 г.
кристаллогидрата содержит 48,6 г. воды и 51,4 г.безводного сульфата алюминия.
Исходя из этого, можно определить число молей воды, приходящееся на 1 моль Al2(SO4)3.
Молярная масса Al2(SO4)3=342 г/моль, тогда
на 51,4 г. Al2(SO4)3 приходится 48,6 г.
H2O
на 342 г. AL2(SO4)3 приходится x г воды
отсюда x = 342*48,6/51,4 = 323,3 г
Теперь определяем число молей воды, содержащееся в 323,3 г:
М(H2O) = 18г/моль; n = 323,3/18 = 18(моль)
Ответ: Al2(SO4)3*18 H2O
Задачи для самостоятельного решения.
1. Вещество содержит кислорода – 47,06%, фосфора – 22,79%, калия – 28,68%,
водорода – 1,47%.Определите формулу вещества.
2. Образец оксида азота массой 11 г занимает объем 5,6 л (н. у.). Массовая
доля азота в нем – 63,64%.Установите формулу оксида.
3. По данным элементного анализа одноосновной карбоновой кислоты было
установлено, что в ней углерода – 48,65%, водорода – 8,11. Выведите формулу
карбоновой кислоты.
4. Установите молекулярную формулу дибромалкана, содержащего 85,11% брома.
Установление формулы вещества на основании уравнений реакций с его участием.
Задача 1. При нагревании соли массой 12,8 г. образуются вода массой 7,2
г. и азот объема 4,48 л. (н.у.) Определите формулу соли, если её молекулярная
масса равна 64 г/моль.
1. Определим количество моли образовавшегося азота:
v(N2)=V(N2)/Vm=4,48/22,4=0,2моль
2. Вычислим количество молей атомарного азота, соединяющегося в образце
исходного вещества:
v(N)=2n(N2)=2*0,2=0,4 моль.
3. Определим количество вещества полученной воды:
v(H2O)=7,2/18=0,4 моль
4. Количество молей атомарного водорода и кислорода, которые содержались в
образце соли, составляет:
v(H)=2v(H2O); v(H)=2*0,4=0,8 моль-атом. v(O)=v(H2O);
v(O)=0,4моль атом.
5. Находим соотношение количеств веществ атомарных азота, водорода и
кислорода в соединении:
v(N):v(H):v(O)=0,4:0,8:0,4=1:2:1
Следовательно, соль имеет формулу (NH2O)x
6. Зная, что молекулярная масса вещества равна 64г/моль, получаем:
64=14(N)+2(H)+16(O)*x; x=2
Соль имеет элементный состав N2H4O2, или NH4NO2.
При нагревании образуется вода и азот: NH4NO2 = 2H2O+N2
Задача2. Некоторая предельная одноосновная кислота массой 6г требует для
полной этерификации такой же массы спирта. При этом получается 10,2г сложного
эфира. Установите молекулярную формулу кислоты.
1. Записываем в общем виде уравнение реакции:
2. Определяем массу выделившейся воды: (6+6) – 10,2=1,8 г, что составляет n(H2O)=
= 1.8/18 = 0.1 моль
3. По уравнению реакций видим, что 6 г кислоты составляет 0,1 моль, т.к.
кислота и вода находятся в соотношении 1:1
4. Опредиляем молярную массу кислоты:
М (кислоты) = 60г/моль
5. Общая формула кислоты:
Сn-1H2n-1 COOH=60,M(COOH)=45г/моль,
тогда (12n-12)+(2n-1)+45=60 14n=28; n=2
Формулы кислоты СH3COOH– уксусная кислота.
Задачи для самостоятельного решения.
1. Для восстановления 2,68 г оксида трехвалентного металла водородом,
получены при взаимодействии 3,39 г цинка с разбавленной серной кислотой.
Определить формулу оксида.
2. При каталитическом гидрировании 23,2 г альдегида было получено 24 г
соответствующего спирта. Назовите исходный альдегид.
3. При дегидратации 18,5 г предельного одноатомного спирта образовался алкен,
объем которого равен 3,36 л (н. у ). Выход алкена составил 60% от теоретически
возможного. Определите формулу спирта.
Установление формулы вещества по продуктам сгорания.
Первый способ решения.
Задача 1. При сгорании органического вещества массой 4,8 г образовались
3,36 л углекислого газа (н.у) и 5,4 г воды. Плотность паров этого вещества по
водороду составляет 16. Определить формулу вещества.
1. Используя формулу относительной плотности находим молярную массу
органического вещества: М (вещества)=2Дн2= 2*16=32г/моль
2. Вычисляем сколько г углерода содержится в 3,36л углекислого газа,
следовательно, столько же г углерода содержалось в органическом веществе:
3. Аналогично находим массу водорода в 5,4 г воды:
4. Определяем, не входит ли еще другой элемент в состав органического
вещества? Для этого находим сумму масс углерода и водорода, сравниваем с массой
вещества по условию задачи: 1.8 + 0,6 = 2,4 г следовательно, входит еще и
кислород, масса его составляет: 4,8 -2,4 = 2,4 г
5. Находим соотношение между числами молей атомов углерода, водорода и
кислорода:
v(C):v(H):v(O)=1,8/12:0,6/1:2,4/16=0,15:0,6:0,15=1:4:1,отсюда простейшая
формула СH4O.
М(СH4O)=12+4+16=32г/моль. Эта цифра совпадает с молярной массой
органического вещества, следовательно это и есть истинная формула органического
вещества.
Ответ: СH4O
Второй способ решения (через уравнение реакции горения органического
вещества)
Задача 2. При сжигании 8,6 г углеводорода образовалось 26,4 г углекислого
газа и 12,6 г воды. Относительная плотность паров этого вещества по воздуху
равна 2,966. Определите молекулярную формулу этого вещества.
1. Пусть состав органического вещества – СxHy
2. Записываем в общем виде уравнение реакции горения органического вещества:
3. Вычисляем молярную массу органического вещества: М (СxHy) = 2,966*29=86
г/моль

6. Составляем простейшую формулу углеводорода: С6Н14
7. Проведем проверку ответа. Для этого вычислим молярную массу простейшего
углеводорода: М (С6Н14) = 12*6 +14 = 86г/моль. Это
значение совпадает с М (Сх Нy).
8. Истинная формула углеводорода – С6Н14
9. Ответ: С6Н14.
Задачи для самостоятельного решения.
1. При сгорании 1,8 г органического вещества образовалось 3,96 г углекислого
газа и 1,96 г воды. Относительная плотность паров этого вещества по водороду
равна 30. Выведите молекулярную формулу этого органического вещества.
2. При сгорании углеводорода объемом 0,6 л выделился углекислый газ объемом
1,2 л (н.у). Масса 1 л этого углеводорода равна 1,16 г. Определите молекулярную
формулу этого углеводорода.
3. Определите молекулярную формулу органического вещества, если при сжигании
25,2 г его образовалось 40,32 л углекислого газа (н.у.) и 32,4 г воды. Плотность
этого вещества равна 1,875 г/л.
Вывод формулы кристаллогидрата (кальций, хлор, вода)
Выведите формулу кристаллогидрата, в котором массовые доли кальция (Ca), хлора (Cl) и воды (H2O) соответственно равны 0,182, 0,324, 0,494.
Решение задачи
Для установления формулы кристаллогидратов солей следует найти молярное отношение соли и воды.
Сначала я предлагаю найти формулу соли, входящей в кристаллогидрат. Согласно приведенным в условии задачи массовым долям кальция и хлора в 1 г вещества содержится 0,182 г кальция (Ca) и 0,324 г хлора (Cl).
Учитывая, что молярные массы кальция и хлора равны:
M (Ca) = 40 (г/моль),
M (Cl) = 35,5 (г/моль),
и используя формулу нахождения химического количества вещества:
![]() найдем атомное отношение этих элементов (кальций, хлор):
найдем атомное отношение этих элементов (кальций, хлор):
![]()
Искомая формула имеет вид CaCl2 (хлорид кальция).
Учитывая молярные массы хлорида кальция (CaCl2) и воды (H2O):
M (CaCl2)= 111 (г/моль),
M (H2O)= 18 (г/моль)
найдем молярное отношение соли и воды, учитывая, что масса хлорида кальция (CaCl2) в кристаллогидрате равна (0,182 + 0,324):
![]()
Следовательно, искомая формула вещества CaCl2 ∙ 6H2O.
Ответ: формула кристаллогидрата CaCl2 ∙ 6H2O.
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
Например, медный купорос:
CuSO4·5H2O
Кристаллогидраты растворяются в воде, при этом протекают сложные физико-химические процессы, но, если говорить про конечный результат, вещество диссоциирует, а кристаллизационная вода отделяется и попадает в раствор. Условно процесс растворения можно записать в виде уравнения:
CuSO4·5H2O → CuSO4 + 5H2O
Но в ЕГЭ по химии лучше не записывать растворение кристаллогидрата, как химическую реакцию!
Названия кристаллогидратов, которые могут встретиться в ЕГЭ по химии:
CuSO4·5H2O — медный купорос, пентагидрат сульфата меди (II)
Na2CO3 × 10H2O — кристаллическая сода, декагидрат карбоната натрия
ZnSO4 × 7H2O — цинковый купорос, гептагидрат сульфата цинка
Как решать задачи на кристаллогидраты?
Рассмотрим приемы, которые можно использовать при решении задач на кристаллогидраты, на примере.
1. В 300 мл воды растворили 7,6 г CuSO4·5H2O (медного купороса). Определите массовую долю CuSO4 в образовавшемся растворе.
Для определения массы соли в составе кристаллогидрата по массе кристаллогидрата можно использовать два способа.
Первый способ.
В составе кристаллогидрата медного купороса на одну частицу кристаллогидрата приходится одна частица сульфата меди (II). На две частицы кристаллогидратов тогда приходится две частицы сульфата меди и т.д. Аналогично на 1 порцию (моль) частиц кристаллогидрата приходится 1 порция (1 моль) частиц сульфата меди (II).
То есть молярное соотношение (отношение количества вещества) кристаллогидрата CuSO4·5H2O и сульфата меди (II) равно CuSO4 1:1
n(CuSO4·5H2O):n(CuSO4) = 1:1
Или:
n(CuSO4·5H2O) = n(CuSO4)
Находим молярные массы гидрата и сульфата меди (II):
М(CuSO4·5H2O) = 64 + 32 + 64 + 5·18 = 250 г/моль
М(CuSO4) = 64 + 32 + 64 = 160 г/моль
Количество вещества кристаллогидрата:
n(CuSO4·5H2O) = m/M = 7,6/250 = 0,0304 моль
n(CuSO4) = n(CuSO4·5H2O) = 0,0304 моль
Масса сульфата меди в составе кристаллогидрата:
m(CuSO4) = M·n = 160 г/моль·0,0304 моль = 4,864 г
Второй способ.
Определим массовую долю сульфата меди в составе кристаллогидрата:
ω(CuSO4) = М(CuSO4)/М(CuSO4·5H2O) = 160 г/моль/250 г/моль = 0,64 или 64%
Тогда массу сульфата меди в образце кристаллогидрата массой 7,6 г можно определить, зная массовую долю сульфата меди:
m(CuSO4) = ω(CuSO4) · m(CuSO4·5H2O) = 0,64 · 7,6 г = 4,864 г
Масса исходной воды:
m(H2O) = ρ·V = 1 г/мл · 300 мл = 300 г
Массу раствора сульфата меди (II) находим по принципу материального баланса: складываем все материальные потоки, которые пришли в систему, вычитаем уходящие материальные потоки.
mр-ра(CuSO4) = m(CuSO4·5H2O) + m(H2O) = 7,6 г + 300 г = 307,6 г
Массовая доля сульфата меди (II) в конечном растворе:
ω(CuSO4) = m(CuSO4)/mр-ра(CuSO4) = 4,864 г/307,6 г = 0,0158 или 1,58%
Ответ: ω(CuSO4) = 0,0158 или 1,58%
2. Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл?
Масса конечного раствора сульфата железа:
mр-ра(FeSO4) = ρ·V = 1,086 г/мл·1250 мл = 1357,5 г
Масса сульфата железа в этом растворе:
m(FeSO4) = ω(FeSO4) · mр-ра(FeSO4) = 1357,5 г · 0,09 = 122,175 г
n(FeSO4) = m(FeSO4)/M(FeSO4) = 122,175 г/152 г/моль = 0,804 моль
Молярное соотношение (отношение количества вещества) кристаллогидрата FeSO4•7H2O и сульфата железо (II) равно FeSO4 1:1
n(FeSO4•7H2O):n(FeSO4 ) = 1:1
Отсюда:
n(FeSO4•7H2O) = n(FeSO4 ) = 0,804 моль
Масса кристаллогидрата:
m(FeSO4•7H2O) = n(FeSO4•7H2O) · M(FeSO4•7H2O) = 0,804 моль · 278 г/моль = 223,45 г
Ответ: m(FeSO4•7H2O) = 223,45 г
3. В растворе хлорида алюминия с ω(AlCl3) = 2% растворили 100 г кристаллогидрата AlCl3·6H2O. Вычислите, какой стала массовая доля AlCl3 в полученном растворе, если объём раствора 1047 мл, а его плотность 1,07 г/мл.
Масса конечного раствора хлорида алюминия:
mр-ра,2(AlCl3) = ρ·V = 1,07 г/мл·1047 мл = 1120,29 г
Тогда масса исходного раствора хлорида аммония:
mр-ра,1(AlCl3) = mр-ра,2(AlCl3) – m(AlCl3·6H2O) = 1120,29 г – 100 г = 1020,29 г
Масса хлорида алюминия в исходном растворе:
m1(AlCl3) = ω1(AlCl3) · mр-ра,1(AlCl3) = 0,02 · 1020,29 г = 20,4 г
Массовая доля хлорида алюминия в кристаллогидрате:
ω(AlCl3) = М(AlCl3)/М(AlCl3·6H2O) = 133,5 г/моль/241,5 г/моль = 0,5528 или 55,28%
Масса хлорида алюминия в кристаллогидрате:
mв к/г(AlCl3) = ω(AlCl3) · m(AlCl3·6H2O) = 100 г · 0,5528 = 55,28 г
Общая масса хлорида алюминия в конечном растворе:
m2(AlCl3) = mв к/г(AlCl3) + m1(AlCl3) = 55,28 г + 20,4 г = 75,68 г
Массовая доля хлорида алюминия в конечно растворе:
ω2(AlCl3) = m2(AlCl3)/mр-ра,2(AlCl3) = 75,68 г/1120,29 г = 0,068 или 6,8%
Ответ: ω2(AlCl3) = 0,068 или 6,8%
4. Вычислите массы FeSO4·7H2O (железного купороса) и воды, необходимые для приготовления 500 г раствора с массовой долей FeSO4 7%.
Ответ: m(FeSO4·7H2O) = 64 г; m(H2O) = 436 г.
5. Вычислите объём воды и массу кристаллогидрата Na2SO4·10H2O (глауберовой соли), которые требуются для приготовления 500 г раствора с массовой долей Na2SO4 15%.
Ответ: m(Na2SO4·10H2O) = 170,45 г; V(H2O) = 329,55 мл.
6. Какую массу кристаллогидрата Na2SO4·10H2O необходимо растворить в 400 мл воды, чтобы получить раствор с ω(Na2SO4) = 10%?

7. Нужно приготовить 320 г раствора с ω(CuSO4) = 12%. Рассчитайте массу кристаллогидрата CuSO4·5H2O и массу раствора с ω1(CuSO4) = 8%, которые потребуются для приготовления заданного раствора.
Ответ: m(CuSO4·5H2O) = 22,86 г; m8% р-ра = 297,14 г.
8. Вычислите, какую массу кристаллогидрата AlCl3·6H2O нужно растворить в 1 кг раствора хлорида алюминия с массовой долей AlCl3 2%, чтобы получить раствор с массовой долей AlCl3 3%.
Ответ: m(AlCl3·6H2O) = 19,2 г.
9. Сколько граммов кристаллогидрата Na2SO4·10H2O необходимо добавить к 100 мл раствора сульфата натрия с массовой долей Na2SO4 8% и плотностью 1,07 г/мл, чтобы удвоить массовую долю Na2SO4 в растворе?
Ответ: m(Na2SO4·10H2O) = 30,6 г.
10. Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
Ответ: m(CuSO4·5H2O) = 92,6 г.
11. Вычислите массу CuSO4·5H2O (медного купороса), необходимую для приготовления 5 л раствора с массовой долей CuSO4 8% (плотность раствора 1,084 г/мл)? Рассчитайте молярную концентрацию CuSO4 в этом растворе.
Ответ: m(CuSO4·5H2O) = 677,5 г; c(CuSO4) = 0,54 моль/л.
12. Массовая доля кристаллизационной воды в кристаллогидрате сульфата натрия (Na2SO4·xH2O) составляет 55,9%. Определите формулу кристаллогидрата. Вычислите массовую долю сульфата натрия в растворе, полученном при
растворении 80,5 г данного кристаллогидрата в 2 л воды.
Ответ: Na2SO4·10H2O; ω(Na2SO4) = 1,7%.
13. К раствору сульфата железа(II) с массовой долей FeSO4 10% добавили 13,9 г кристаллогидрата этой соли. Получили раствор массой 133,9 г, с массовой долей FeSO4 14,64%. Определите формулу кристаллогидрата.
14. После растворения 13,9 г кристаллогидрата сульфата железа(II) (FeSO4·xH2O) в 86,1 г воды массовая доля FeSO4 в растворе оказалась равной 7,6%. Определите формулу кристаллогидрата.
15. При охлаждении 200 мл раствора сульфата магния с ω(MgSO4) = 24% (плотность раствора 1,270 г/мл) образовался осадок кристаллогидрата MgSO4·7H2O массой 61,5 г. Определите массовую долю MgSO4 в оставшемся
растворе.
Ответ: ω2(MgSO4) = 12,73%.
16. При охлаждении 400 мл раствора сульфата меди(II) с массовой долей CuSO4 25% (плотность раствора 1,19 г/мл) образовался осадок кристаллогидрата CuSO4·5H2O массой 50 г. Определите массовую долю CuSO4 в оставшемся растворе.
17. При охлаждении 500 г раствора сульфата железа(II) с массовой долей FeSO4 35% выпало в осадок 150 г кристаллогидрата FeSO4·7H2O. Определите массовую долю FeSO4 в оставшемся растворе.
18. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 8,4 г железа и после завершения реакции ещё 100 г 9,8%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
19. Медный купорос (CuSO4 × 5H2O) массой 100 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 32,5 г цинка и после завершения реакции ещё 560 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в полученном растворе.
20. К 20%-ному раствору соли, полученному при растворении в воде 50 г медного купороса (CuSO4 × 5H2O), добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 146 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
21. Нитрид натрия массой 8,3 г растворили в 490 г 20%-ного раствора серной кислоты. К полученному раствору добавили 57,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю кислоты в конечном растворе. Учитывать образование только средних солей.
22. Медный купорос (CuSO4 × 5H2O) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
23. Медный купорос (CuSO4 × 5H2O) массой 37,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 11,2 г железа и после завершения реакции ещё 100 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
24. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 20%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 292 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
25. При растворении 25 г медного купороса (CuSO4 × 5H2O) в воде был получен 20%-ный раствор соли. К этому раствору добавили измельчённую смесь, образовавшуюся в результате прокаливания порошка алюминия массой 2,16 г с оксидом железа(III) массой 6,4 г. Определите массовую долю сульфата меди(II) в полученном растворе.
26. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
27. Свинцовый сахар ((CH3COO)2Pb × 3H2O) массой 37,9 г растворили в воде и получили 10%-ный раствор соли. К этому раствору добавили 7,8 г цинка и после завершения реакции добавили еще 156 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
28. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
29. При растворении в воде 114,8 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
30. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
Ответ: w(NaOH) = 3,8%
31. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 16%. К этому раствору добавили 26 г цинка и после завершения реакции ещё 320 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
32. Фосфид кальция массой 18,2 г растворили в 182,5 г 20%-ного раствора соляной кислоты. К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
Ответ: w(Na2CO3) = 6%
Задачи на состав и определение формулы кристаллогидратов:
- Вычислите массовую долю бария в кристаллогидрате гидроксида бария, в котором число атомов водорода в 1,8 раз больше числа атомов кислорода.
- Имеется смесь равных масс гептагидрата гидрофосфата натрия и дигидрата дигидрофосфата натрия. Сколько в это смеси приходится атомов кислорода на один атом фосфора?
- Число атомов водорода, равное числу Авогадро, содержится в 21,9 г кристаллогидрата ацетата цинка. Установите формулу кристаллогидрата.
- В некоторой порции пентагидрата сульфата меди содержится 0,25 моль воды. Вычислите массу этой порции кристаллогидрата.
- В какой массе дигидрата сульфата кальция содержится число электронов, равное числу Авогадро?
- Вычислите число атомов и число электронов 14г гептагидрата сульфата никеля (II).
- Рассчитайте массу атомов водорода, содержащихся в 143 моногидрата ацетата меди.
- В некоторой порции кристаллогидрата сульфата желез (III) число атомов кислорода в 15 раз больше числа Авогадро, а число атомов железа точно соответствует числу Авогадро. Выведите формулу кристаллогидрата.
- В 0,250 моль кристаллогидрата разница между массой кристаллизационной воды и массой беводной соли равна 59,5. Массовая доля кристаллизационной воды составляет 28,83%. Вычислите относительную молекулярную массу кристаллогидрата.
- В кристаллогидрате, образованном средней солью металла, массовая доля кристаллизационной воды равна 50,0%. Вычислите массу водорода, содержащегося в 100 г этого кристаллогидрата.
- В кристаллогидрате, образованном солью бескислородной кислоты, массовая доля соли равна 0,755. Вычислите массу кислорода, содержащегося в 1.00 г этого кристаллогидрата.
- В некоторой порции кристаллогидрата ацетата магния находится 9,632∙1023 атомов углерода и 3,371∙1024 атомов водорода. Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
- В некоторой порции кристаллогидрата ацетата бария находится 4,816∙1023 атомов углерода и 8,428∙1023 атомов кислорода. Вычислите число атомов водорода, находящихся в этой порции кристаллогидрата.
14. В 0,250 моль дигидрата ацетата металла 2А-группы содержится 1,535∙1025 электронов. Установите, какой металл входит в состав кристаллогидрата.
Задачи на реакции с участием кристаллогидратов:
- Оксид меди (II) массой 16 г обработали 40 мл 5,0 %-го раствора серной кислоты (ρ=1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
- Декагидрат карбоната натрия обработали раствором азотной кислоты массой 150 г, при этом выделилось 2,67 л углекислого газа (н.у.). Вычислите массовую долю азотной кислоты в исходном растворе.
- К сульфиду калия массой 3,30 г, находящемуся в водном растворе, добавили 0,02 моль гексагидрата хлорида меди. Вычислите массу образовавшегося осадка.
- При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
- Какую массу медного купороса необходимо добавить к 150 г 12%-ного раствора гидроксида натрия, чтобы щёлочь полностью прореагировала?
- 7,5 г медного купороса (пентагидрат сульфата меди) растворили в 142,5 воды. К полученному раствору добавили 150 мл 10 %-ного раствора гидроксида калия (плотность 1,1 г/мл). Определить состав полученного раствора в массовых процентах.
- Какую массу декагидрата карбоната натрия необходимо растворить в 130 г 10%-ного раствора хлорида алюминия, чтобы полностью осадить гидроксид алюминия? Определить состав раствора (в массовых процентах) после отделения осадка.
8. В 1 л воды растворили 57,2 г кристаллической соды (декагидрат карбоната натрия). Через полученный раствор пропустили 1,12 л углекислого газа. Найти массовые доли веществ в полученном растворе.
Задачи на материальный баланс и растворы с участием кристаллогидратов:
- Медный купорос массой 12,5 г; растворили в 87,5 мл воды. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 200 г раствора сульфата меди (II) с массовой долей соли 4% растворили 50 г медного купороса. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 5 л воды растворили дигидрат хлорида бария массой 250 г. Вычислите массовую долю (в %) безводной соли в полученном растворе.
- В 135,6 г воды растворили глауберову соль массой 64,4 г. Рассчитайте массовую долю (в %) безводной соли в полученном растворе.
- Необходимо приготовить 2 л 0,1 М водного раствора сульфата меди (II). Какая масса медного купороса потребуется для этого?
- Выпарили досуха 0,5 л 15-процентного раствора сульфата натрия (плотность 1,14 г/см3). Вычислите массу полученных кристаллов, учитывая, что соль выделяется в виде кристаллогидрата — декагидрата сульфата натрия.
- До какого объема надо разбавить 500 мл 20-процентного раствора хлорида натрия (плотность 1,152 г/мл), чтобы получить 4,5-процентный раствор плотностью 1,029 г/мл?
- Смешали 500 мл 32 — процентного раствора азотной кислоты плотностью 1,2 г/мл и один литр воды. Вычислите массовую долю (в %) азотной кислоты в полученном растворе.
- Рассчитайте объем 25% раствора сульфата цинка (плотность 1,3 г/мл), который необходимо разбавить водой для получения 0,5 М раствора этой соли объемом 4л.
- Декагидрат карбоната натрия массой 0,05 кг растворили в воде объемом 0,15 л. Вычислите массовую долю безводной соли в полученном растворе.
- В воде объемом 0,157 м3 растворили медный купорос массой 43 кг. Вычислите массовую долю безводной соли в полученном растворе.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Массовая доля безводной соли в кристаллогидрате равна 64%. Какую массу кристаллогидрата нужно взять для приготовления 150 г 50%-го раствора соли?
- В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- В каком объеме воды следует растворить 0,3 моль пентагидрата сульфата меди (II) для получения 12%-го раствора?
- Рассчитайте, сколько г FeSO4×7H2O и воды потребуется для приготовления 200 мл 18 мас % раствора сульфата железа (II) с плотностью 1,19 г/мл.
- Кристаллогидрат фосфата натрия Nа3РО4×12Н2О количеством вещества 1 моль растворили в 75 моль воды. Плотность получившегося раствора оказалась равной 1,098 г/мл. Вычислите молярную концентрацию ионов натрия в этом растворе.
- В 225 г 25,5%-го раствора бромида кальция растворили гексагидрат бромида кальция массой 50,0 г. Вычислите массовые доли веществ в получившемся растворе.
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- К 2% раствору хлорида алюминия добавили 100 г кристаллогидрата АlСl3∙6Н2О. Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
- Сколько граммов кристаллогидрата СuSО4∙5Н2О и какой объем раствора сульфата меди, содержащего 5 мас.% СuSО4 и имеющего плотность 1,045 г/мл, надо взять для приготовления 400 мл раствора сульфата меди, содержащего 7 мас.% СuSО4 и имеющего плотность 1,06 г/см3?
- Сколько граммов кристаллогидрата Nа2СО3∙10 Н2О надо добавить к 400 мл раствора карбоната натрия, содержащего 5 мас.% Na2СО3 и имеющего плотность 1,05 г/см , чтобы получить 16 мас.% раствор, плотность которого 1,17 г/см ?
- Какой объем 5% раствора сульфата натрия надо взять, чтобы растворение в нем 150 г кристаллогидрата Nа2SO4∙10Н2О привело к образованию 14% раствора? Плотности растворов Nа2SО4 равны, соответственно, 1,044 и 1,131 г/мл.
- Алюмокалиевые квасцы КАl(SО4)2∙12Н2О количеством вещества 10 ммоль растворили в 10 моль воды. Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
- В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Какую массу кристаллогидрата сульфата хрома (III), кристаллизующегося с 18 молекулами воды, можно получить из 80 мл раствора с концентрацией сульфата хрома 0,8 моль/л?