Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2019 года; проверки требуют 8 правок.
| Нитрат алюминия | |
|---|---|
  |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий; нитрат алюминия(+3), тринитрат алюминия, алюминия (III) нитрат |
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89[1] |
| Термические свойства | |
| Температура | |
| • плавления | +66 °C (с разл.)[1]; нонагидрат: 73,5[1] |
| • разложения | +150-200 °C |
| Энтальпия | |
| • образования |
− 927 кДж/моль; нонагидрат: − 3757[2]; гексагидрат: − 2871[3] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9[4] |
| • в в метаноле | при 35 °C: 14,45[5] |
| • в в этаноле | при 35 °C: 8,63[5] |
| • в в этиленгликоле | при 35 °C: 18,32[5] |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS |
13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
InChI=1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1 JLDSOYXADOWAKB-UHFFFAOYSA-N |
| RTECS |
BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| Безопасность | |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Токсичность | Низкая |
| NFPA 704 |
0 0 3 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т алюми́ния, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства[править | править код]
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе[2][6]. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях[6]. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C. Разлагается в горячей воде[2].
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды[2].
Плотность водного раствора нитрата алюминия при 18 °C[7]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства[править | править код]
- При растворении в воде подвергается гидролизу[8]:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7[9].
- При нагревании гидролиз можно провести полностью[8]:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям[8].
- На холоде:
- При нагревании:
- При нагревании разлагается [8]:
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия[10].
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение[править | править код]
Лабораторные методы[править | править код]
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты[10].
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2))[10][11]:
Промышленное производство[править | править код]
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V)[8]:
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение[править | править код]
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике[12].
Опасность[править | править код]
ЛД50 (крысы, перорально) = 4,28 г/кг[13].
Примечания[править | править код]
- ↑ 1 2 3 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 76. — ISBN 5-7107-8085-5.
- ↑ 1 2 3 4
Алюминия нитрат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 212. - ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 441. — ISBN 5-7107-8085-5.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 618. — ISBN 5-7107-8085-5.
- ↑ 1 2 3 Perry D.L. , Phillips S.L. Handbook of Inorganic Compounds. — CRC Press, 1995. — P. 9. — ISBN 0-8493-8671-3.
- ↑ 1 2
Patnaik P. Handbook of inorganic chemical. — McGraw-Hill, 2003. — P. 9. — ISBN 0-07-049439-8. - ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 641. — ISBN 5-7107-8085-5.
- ↑ 1 2 3 4 5 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ / Под редакцией проф. Р.А.Лидина. — 3-е изд.. — М.: «Химия», 2000. — С. 84. — ISBN 5-7245-1163-0.
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука». — Т. 1971. — С. 16.
- ↑ 1 2 3 Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — P. 153. — 526 p. — ISBN 0-7514-0103-X.
- ↑ Турова Н.Я. Неорганическая химия в таблицах. — М.: «Высший химический колледж РАН», 1997. — С. 66.
- ↑ Vincoli J. W. Aluminium nitrate // Risk Management for Hazardous Chemicals. — CRC Press, 1997. — 3136 p. — ISBN 1-56670-200-3.
- ↑ Gardner’s commercially important chemicals: synonyms, trade names, and properties / Edited by Milne G.W.A.. — New Jersey: John Wiley and Sons, 2005. — P. 22. — ISBN 0-471-73518-3.
Литература[править | править код]
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X.
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001. — ISBN 5-06-003363-5.
- Лидин Р. А. Справочник по общей и неорганической химии. — М.: КолосС, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основы общей химии. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
Ссылки[править | править код]
- Синтез нитрата алюминия на сайте Youtube. Архивная копия от 29 марта 2020 на Wayback Machine (англ.)
Aluminium Nitrate, also known as aluminium (III) nitrate has a white crystalline solid appearance. Aluminium nitrate is a salt consisting of aluminium and nitric acid and it is easily soluble in water. This salt has a density of 1.72 g/cm3. It is a strong electrolyte and oxidizing agent. It has the capacity to hold water and retain it. Nitric aluminium salt is the other name for it. It has a boiling point of 135°C and a melting point of 72.8°C. Aluminium nitrate salt is used in some industrial processes for the extraction of heavy elements and is also used in the industry for the production of alumina.
What is Aluminium Nitrate Formula?
The chemical formula of aluminium nitrate is Al(NO3)3. Aluminium contains 3 electrons in the outer shell, can efficiently lose its three electrons forms a cation, and has an electric charge of +3 making an ion and giving it the formula Al+3.
Nitrate is a combination of one nitrogen and three oxygen atoms, a polyatomic ion, and a charge of -1 with the formula NO3-1.
Both cation and polyatomic ion combines together to form a salt of aluminium nitrate. Hence, the chemical formula of aluminium nitrate is Al(NO3)3.
Structure of Aluminium Nitrate
The chemical formula structure is represented as below:

Preparation methods
- Aluminium nitrate is produced by the reaction of aluminium (III) chloride and nitric acid,
AlCl3 + HNO3 → Al(NO3)3 + HCl
- It can also form through the reaction of aluminium sulfate and barium nitrate,
Al2(SO4)3 + 3Ba(NO3)2 → 2Al(NO3)3 + 3BaSO4
Properties of Aluminium Nitrate
- The molar mass of aluminium nitrate is 212.996 g/mol.
- The boiling point and the melting point of aluminium nitrate are 135˚C and 72.8˚C respectively.
- It is odorless and has the appearance of a white crystalline solid.
- Aluminium nitrate has a density of 1.72 g/cm3.
- It is soluble in water.
- Aluminium nitrate salt can react with some hydroxides or other salts to form a new nitrate,
Al(NO3)3 + 3NaOH → Al(OH)3 + 3NaNO3
- By the neutralization of dilute nitric acid with aluminium (III) chloride formation of aluminium nitrate can take place,
3HNO3 + AlCl3 → Al(NO3)3 + 3HCl
Harmful effects and Safety measures
It is hazardous to people when inhaled. Aluminium nitrate is a strong oxidizer hence it can react with other compounds and may cause fire when comes in contact. It is harmful if swallowed or inhaled can cause damage to the respiratory tract and irritation to the eyes and burns on the skin.
Avoid contact with eyes, skin, and clothing. Empty containers retain product residue and can be hazardous. Keep away from clothing, incompatible materials, and combustible materials. Keep reduction valves free from grease and oil. Following proper precautionary and preventive controlling methods should be maintained.
Uses of Aluminium Nitrate
- It is present in antiperspirants.
- Used in the manufacture of gasoline.
- This salt is used in the preparation of insulating papers.
- Used in transformer core laminates
- It also Used for uranium extraction
- It acts as a powerful oxidizing agent
- Aluminium nitrate can be used as a corrosion inhibitor
- It is used in tanning leather.
Sample Questions
Question 1: Does Aluminium nitrate act as a protective layer?
Answer:
The surface is covered by this aluminium oxide, so the rest aluminium which is available beneath the surface doesn’t get oxidized consequently reactivity of aluminium diminishes. Thus, the explanation, a defensive layer of aluminium nitrate is framed when aluminium is plunged into nitric acid.
Question 2: What are the aluminium applications and foods that are rich in aluminium?
Answer:
Additionally, with electrical cables and links, aluminium is utilized in engines, machines, and power frameworks. TV receiving wires and satellite dishes, even a few LED bulbs are made of aluminium. Incalculable articles that streamline as well as increment the nature of our day-to-day routine are somewhat made of aluminum, for example, Albums, vehicles, coolers, kitchenware, electric electrical cables, bundling for food and medication, PCs, furniture and airplanes.
The most ordinarily utilized food varieties that might contain significant measures of aluminum-containing food added substances are cheeses, baking powders, cake blends, frozen batter, hotcake blends, self-rising flours, and salted vegetables.
Question 3: Why is aluminium called a hazardous substance?
Answer:
Aluminium nitrate is a salt made out of aluminium and nitric corrosive, it belongs to a group of reactive elements – organic nitrate and nitrite compounds. The nitrate particle is polyatomic, meaning made out of at least two particles that are covalently bonded. This particle makes up the form base of nitric acid.
Aluminium is listed on the Hazardous Substance List since it is regulated by OSHA and cited by ACGIH, DOT, NIOSH, DEP, NFPA, and EPA. Aluminium is on the Special Health Hazard Substance List because of it is a highly flammable property in powder form.
Question 4: Why is aluminium toxic to humans and how do they get aluminium poisoning?
Answer:
Human openness to aluminium is inescapable and, maybe, incalculable. Aluminium’s free metal cation, Al(3+), is exceptionally organically responsive and naturally accessible aluminium is unnecessary and basically poisonous. Aluminium has not been characterized concerning cancer-causing nature. However, aluminum creation has been delegated as cancer-causing to people by the International Agency for Research on Cancer (IARC)
Aluminium (Al) is every now and again open to animal and human populations to the degree that intoxications might happen. Taking of Al is by the inward breath of sprayers or particles, ingestion of food, water, and medicaments, skin contact, immunization, dialysis, and vaccination. Although, aluminium is discharged from the body, and thus eliminated from the body by various courses including by means of the excrement, pee, sweat, skin, hair, nails, sebum and semen.
Question 5: For what aluminium nitrate was Nonahydrate used?
Answer:
Nonahydrate and other hydrated aluminium nitrates have numerous applications. These salts are utilized to create alumina for the arrangement of protecting papers, in cathode tube heating components, and on transformer center laminates. The hydrated salts are likewise utilized for the extraction of actinide components.
Last Updated :
16 Jun, 2022
Like Article
Save Article
Содержание
- Физические свойства
- Химические свойства
- Получение
- Лабораторные методы
- Промышленное производство
- Применение
- Опасность
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
| Нитрат алюминия | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий; нитрат алюминия(+3), тринитрат алюминия, алюминия (III) нитрат |
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Термические свойства | |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1 JLDSOYXADOWAKB-UHFFFAOYSA-N |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| Безопасность | |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Токсичность | Низкая |
| NFPA 704 |
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- При нагревании:
- При нагревании разлагается :
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V):
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
Нитрат алюминия — это неорганическое вещество, соль алюминия и азотной кислоты. Широко применяется в промышленности, раствор нитрата необходим для прокрашивания тканей, востребован в качестве реагента на предприятиях, используется в металлургии, при изготовлении трансформаторов, на нефтеперерабатывающих заводах. Нитрат алюминия малоопасен для здоровья, но может вызвать взрыв и возгорание.
Содержание
- Что такое нитрат алюминия, формула, виды
- Физические свойства, внешний вид
- Химические свойства
- Реакции с нитратом алюминия
- Производство и получение
- Применение
- Применение алюминия нитрата в текстильной и химической промышленности
- Применение алюминия нитрата в электротехнике и нефтепереработке
- Опасность, токсичность, меры предосторожности
- Где купить и сколько стоит
- Заключение
Что такое нитрат алюминия, формула, виды
Нитрат алюминия представляет собой соединение амфотерного металла алюминия и остатка азотной кислоты. Формула – Al(NO3)3. Один атом алюминия удерживает три нитратные группировки за счёт валентности, равной трём.
В природе существует несколько видов нитратов алюминия, которые отличаются наличием гидроксильных группировок в составе:
- AlOH(NO3)2;
- Al(OH)2NO3.
За счёт свойства алюминия впитывать влагу образуются гидратированные соли, гидраты: нонагидрат – Al(NO3)3 ∙ 9H2O, а также вещества ряда Al(NO3)3 ∙ xH2O, где х → 4, 6, 8, 9.
Физические свойства, внешний вид

Нитрат алюминия – это белый либо бесцветный мелкокрупинчатый кристаллический порошок. Характеризуется высокой гигроскопичностью, легко поглощает влажность и комкается. За счёт этого свойства алюминия нитрата он дымится на открытом воздухе. Обладает хорошей растворимостью, смешивается с водой, в том числе холодной. Растворяется в полярных органических растворителях: спирте, ацетоне, феноле, эфирах. Раствор нитрата алюминия даёт кислую реакцию среды за счёт выделения большого количества ионов H+. В горячей воде нитрат алюминия разлагается.
Неустойчив к температурным воздействиям. Температура плавления составляет 66 °С, в условиях вакуума возгонка проходит при 55 °С. Напитавшийся влагой нитрат алюминия немного изменяется. Нонагидрат – расплывающиеся кристаллы, при нагревании до 73 °С отдаёт присоединённые молекулы воды.
Химические свойства
Нитрат алюминия проявляет двойственные химические свойства за счёт амфотерности металла – способности функционировать как кислота и основание. Его широкие реакционные возможности определяют повсеместное применение. Для нитрата алюминия характерен обмен с выпадением осадка или необратимым гидролизом. Действует как сильный окислитель.
Реакции с нитратом алюминия
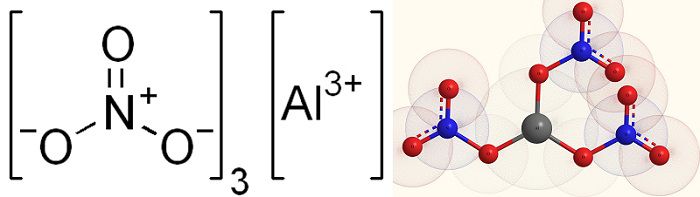
Структурная формула и молекула нитрата алюминия
Нитрат алюминия реагирует с едкой щелочью, находящейся в недостатке. При этом в осадок отделяется белый гидроксид алюминия:
Al(NO3)3 + 3NaOH → 3NaNO3 + Al(OH)3↓
При воздействии избытка едкого натра продукты меняются, образуется комплексный тетрагидроксоалюминат:
Al(NO3)3 + 4NaOH → Na[Al(OH)4] + 3NaNO3
Нитрат алюминия реагирует с фосфатами, формируя аморфный триалюминийфосфат:
Al(NO3)3 + Na3PO4 → AlPO4↓ + 3NaNO3
Реакция с полным разложением итоговой смеси соединений возможна, поскольку нитрат алюминия реагирует с водным раствором карбоната:
2Al(NO3)3 + 3Na2CO3 + 3H2O → 2Al(OH)2 + 3CO2↑ + 6NaNO3
При прокаливании до 200 °С запускается реакция термолиза, идёт разложение на составляющие компоненты: бурый газ и кислород, оксид.
4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑
Нитрат алюминия реагирует с водой, формируется раствор нитрата, в котором ступенчато протекает реакция распада. Она обратима. При этом идёт по катиону, поскольку соль образована слабым основанием и сильной кислотой. В результате равновесие смещается влево, а значение pH – в кислотную сторону (менее 7).
Al(NO3)3 + H2O → AlOH(NO3)2 + H+ +NO3–
Нитрат алюминия реагирует с раствором аммиака. На холоду реакция даёт нерастворимую гидрооксиь алюминия и аммиачную селитру:
Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4NO3
При подогревании раствора нитрата наблюдается изменение состава выхода:
Al(NO3)3 + 3NH3 + 3H2O → AlO(OH)↓ + 3NH4NO3 + H2O
Производство и получение
Нитрат алюминия в лабораторных условиях получают путём растворения металлического алюминия в кислоте:
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O↑ + 15H2O
Схожего результата можно добиться действием на раствор гидроксида алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 +3H2O
Возможна добыча реактива при применении сульфата алюминия с нитратом бария:
Al(SO4)3 + 3Ba(NO3)2 → 2Al(NO3)3 + 3BaSO4↓
В промышленных масштабах нитрат алюминия получают окислением оксида алюминия при участии пентаоксида диазота:
Al2O3 + N2O5 → 2Al(NO3)3
Иногда для этого используют бромиды, однако технология усложняется прохождением синтеза в две стадии.
Применение
Применение алюминия нитрата распространилось на многие сферы, но из-за специфического физико-химического состава он наиболее востребован в химии, текстиле и кожевенном деле. Его часто используют для выпуска ламп накаливания, построения электротрансформаторов, в качестве антикоррозийного напыления.
Применение алюминия нитрата в текстильной и химической промышленности
Вещество в растворе применяется для усиления окраски тканей благодаря свойству алюминия нитрата проникать вглубь нитей. Он действует как протрава – агент, закрепляющий на волокнах частички пигмента. При этом нитрат алюминия бережен по отношению к качеству материала. Его добавляют для сохранения яркого и насыщенного цвета на долгое время.
Поскольку нитрат алюминия – сильный окислитель, взаимодействующий с органикой, что важно для дубления кожи. Он влияет на белковый комплекс на поверхности, делая кожу менее восприимчивой к воздействию отрицательных температур и растяжения. Чаще всего нитрат вносят на этапе замачивания.
Нитрат алюминия – ценный реактив, необходимый для органического и неорганического синтеза. На его основе получают различные газы и соли алюминия, работает как катализатор, ускоряющий процессы превращения веществ.
Применение алюминия нитрата в электротехнике и нефтепереработке
Нитрат алюминия нужен при производстве нитей накаливания – основного компонента ламп. Его также применяют для создания изоляционной бумаги, которая обеспечивает электроизоляцию. Нитрат алюминия — это основной компонент специальных губок для инновационной очистки сырой нефти, применяющихся на нефтяных заводах. Пористый по физическим свойствам материал быстро впитывает летучие алканы, образующиеся при переработке. Это значительно удешевляет процесс очистки.
Соединение можно встретить в тонком строении электротрансформаторов: в их нагревательных элементах, слоистых сердечниках. В дезодорантах добавка нитрата алюминия способствует закупориванию пор и уменьшению потливости, а также адсорбирует выделяющийся запах.
Опасность, токсичность, меры предосторожности
Нитрат алюминия относится к 4 классу опасности. При контакте с открытыми участками кожи и слизистой вызывает раздражение и покраснение, поэтому необходимо при работе с ним надевать защитные перчатки и очки, избегать вдыхания. Реактив пожаро- и взрывоопасен, его следует хранить вдали от источников тепла и прямого солнечного света.
Где купить и сколько стоит
Нитрат алюминия продаётся заводами-производителями в оптовых количествах: от 25 кг. Цена составляет 160-200 руб/кг. Его можно купить в специализированных интернет-магазинах, стоимость реагента от 1500 руб/кг.
Заключение
Нитрат алюминия – это очень гигроскопичная соль с высокой реакционной активностью. Она востребована для окрашивания тканей, выделки кожи, переработки нефтепродуктов, создания электротехнических устройств.
Читайте также:
- Сульфат алюминия: свойства, применение
- Хлорид алюминия: свойства, применение
- Алюмосиликаты: свойства, виды, получение, применение
- Оксид магния: описание, польза и вред, применение, реакции
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
![]() Загрузка…
Загрузка…
Нитрат алюминия — свойства, получение и применение
Содержание
- Физические свойства
- Химические свойства
- Получение
- Лабораторные методы
- Промышленное производство
- Применение
- Опасность
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.

- При нагревании гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- При нагревании:
- При нагревании разлагается :
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V):
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
Аl(NО3)3 — свойства и применение
Соли металлов очень часто используются для изготовления различных элементов, которые играют важное значение в других отраслях промышленности. Поэтому их довольно часто синтезируют из разнообразных соединений, чтобы затем использовать в своих целях. Нитрат алюминия относится к наиболее востребованным веществам, так как обладает прекрасными свойствами и может быть применен в широких масштабах.
Благодаря высокой химической активности солеобразующих металлов, свойства будут весьма ярко проявляться, так что именно поэтому стараются выбирать активные соединения. С ними проще работать, но могут потребоваться специальные условия хранения, так как в некоторых случаях реакция происходит прямо на открытом воздухе, что недопустимо, так как не будет контроля.
Химическая формула и свойства соединения
Условными обозначениями формула нитрата алюминия выглядит следующим образом:Аl(NО3)3. Это соединение обладает следующими параметрами:
Это соединение обладает следующими параметрами:
- • пребывает в твердом агрегатном состоянии при нормальных условиях;
- • молярная масса составляет 212,996 грамм на моль;
- • плотность равняется 1,89 грамм на кубический сантиметр;
- • плавится вещество всего при 66 градусах по Цельсию;
- • массовая доля азота в нитрате алюминия составляет 19,7%;
- • в химических реакциях проявляет высокую активность, которая увеличивается при нагревании до определенного уровня, так как дальше начинается разложение.
Нитрат алюминия 3 можно получить несколькими способами, которые дают одинаково хороший результат, а отличаются лишь необходимостью наличия разных компонентов:
1. Самым простым способом будет растворение или так называемое травление чистого металла в разведенной азотной кислоте: 8Аl+30НNО3=8Аl(NО3)3+3N2О+15Н2О.
2. Также можно осуществлять воздействие азотной кислотой на основание алюминия: Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
3. Можно проводить реакцию замещения, для чего используются менее активные металлы, которые вытесняются алюминием: Аl2(SО4)3+3BА(NО3)2=2Аl(NО3)3+3BАSО4.
4. Чтобы сразу получить безводный раствор, нужно провести реакцию кристаллогидрата, которая может иметь два вида взаимодействий:
- • Аl(ОН)3·9Н20+9N2О5=Аl(NО3)3+18НNО3;
- • АlCl3+3ClNО3=Аl(NО3)3+3Cl2.
5. В промышленности твердое вещество также получают двумя основными методами:
- • Аl2О3+3N2О5=2Аl(NО3)3;
- • Аl(ОН)3+3N2О5=Аl(NО3)3+3НNО3.

6. Можно применять в качестве исходного сырья бромид алюминия, тогда реакция будет протекать постепенно в две стадии:
- • вначале идет поляризация: 2АlBr3+8N2О5=2[NО2]—[Аl(NО3)4]++3Br2+6NО2.
- • а затем реакция завершается: 2[NО
2]—[Аl(NО3)4]+=2Аl(NО3)3+4N2О+О2.
Как видно, раствор нитрата алюминия и твердое вещество можно получить большим количеством способов, причем для этого даже не потребуются специальные условия.
Реакции, в которых может принимать участие вещество
Алюминий относится к категории амфотерных элементов, так что при определенных условиях он может проявлять разные свойства. Это широко используется в промышленности, чтобы можно было управлять химическими реакциями в зависимости от необходимости. Нитрат алюминия взаимодействует с большим количеством соединений различного рода, так что может использоваться в широком спектре работ:
Нитрат алюминия взаимодействует с большим количеством соединений различного рода, так что может использоваться в широком спектре работ:
- • Цепочка алюминий→нитрат алюминия→гидроксид алюминия может быть пройдена ровно за два простых этапа в следующей последовательности:
4Аl+4НNО3=4Аl(NО3)3+2Н2;
3Аl(NО3)3+3KОН=3Аl(ОН)3+3KNО3.
- • Нитрат алюминия→хлорид алюминия можно получить при помощи воздействия на вещество соляной кислотой: Аl(NО3)3+3НCl=АlCl3+3НNО3.
- • Оксид алюминия→нитрат алюминия получают по простой схеме: Аl2О3+3N2О5=2Аl(NО3)3.
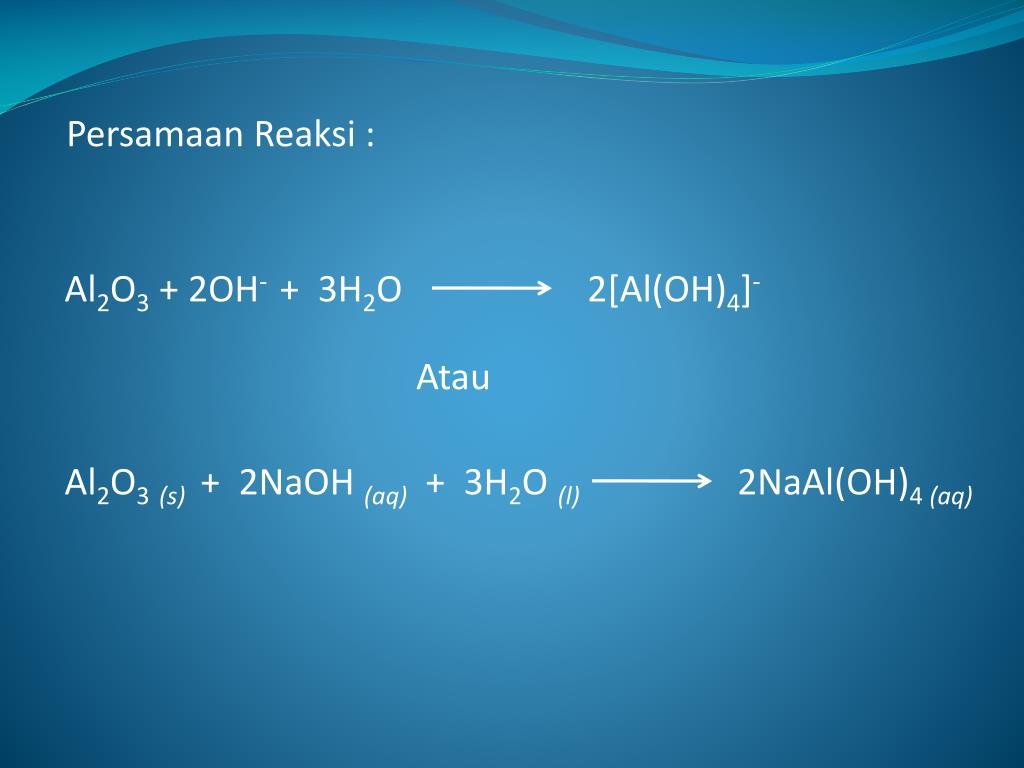
- • Нитрат алюминия и гидроксид натрия во взаимодействии дают следующий результат Аl(NО3)3+3NАОН=Аl(ОН)3↓+3NАNО3.
- • Нитрат цинка и алюминий при взаимодействии проведут реакцию вытеснения менее активного металла: 3Zn(NО3)2+2Аl=2Аl(NО3)3
+3Zn. - • Нитрат калия с алюминием не реагирует, так как калий является более активным металлом, поэтому алюминий не может вытеснять его из соединений.
- • А вот такому виду замещения, как алюминий→нитрат железа ничего не мешает: 3Fe(NО3)2+2Аl=2Аl(NО3)3+3Fe.
- • Разложение нитрата алюминия происходит при нагревании среды до 150-200 градусов по Цельсию: 4Аl(NО3)3=2Аl2О3+12NО2+3О2.
Это только небольшой перечень реакций, в которые вступает вещество.
Использование алюминиевой соли азотной кислоты
Вещество используется на текстильных фабриках для протравки тканей перед покраской, играет важную роль при дублении кожи, служит для изготовления нитей накаливания. Каталитические свойства применяется для очистки нефти от различных вредных примесей, а также может убирать коррозию с металлов и некоторых сплавов. Входит в состав некоторых антиперспирантов.
Каталитические свойства применяется для очистки нефти от различных вредных примесей, а также может убирать коррозию с металлов и некоторых сплавов. Входит в состав некоторых антиперспирантов.
Опасность вещества для человека находится на низком уровне или отсутствует вовсе. Твердые элементы можно брать в руки без защитных перчаток, а нюхать материал без какого-либо опасения получить ожог дыхательный путей. Случаи попадания алюминиевого нитрата в пищеварительную систему человека не фиксировались, так что сказать об опасности сложно.
При проведении испытаний на крысах после внутреннего употребления погибла половина испытуемой группы. Так что наверняка опасность присутствует, но в любом случае, ни одно химическое вещество нельзя употреблять в пищу, пока его свойства не будут исследованы и не доказана польза для организма.
Нитрат алюминия | Сульфат алюминия
Нитрат алюминия представляет собой соединение, представляющее собой соль азотной кислоты и алюминия. В нормальных условиях нитрат алюминия существует в виде кристаллогидрата. Что касается визуальной формы нитрата алюминия, то она обычно представляет собой кристаллическое твердое вещество или порошок и имеет желтую окраску. Нитрат алюминия является твердым соединением в соответствии со Стандартной температурой и давлением. Формула соединения – Al(NO3)3.
В нормальных условиях нитрат алюминия существует в виде кристаллогидрата. Что касается визуальной формы нитрата алюминия, то она обычно представляет собой кристаллическое твердое вещество или порошок и имеет желтую окраску. Нитрат алюминия является твердым соединением в соответствии со Стандартной температурой и давлением. Формула соединения – Al(NO3)3.
Физические свойства нитрата алюминия
У этого соединения много различных физических свойств. Например, нитрат алюминия имеет молярную массу, равную 212,996 г/моль. Что касается плотности соединения, то она составляет 1,401 г/см3. Кроме того, как и любое другое соединение, нитрат алюминия имеет температуры плавления и кипения, которые составляют 72,8°С и 135°С соответственно. Растворимость нитрата алюминия известна в различных жидкостях. Нитрат алюминия не имеет запаха, а его молекулярная масса составляет 375,13. Химическая формула нитрата алюминия – Al(NO₃)₃.
Получение нитрата алюминия
Вы не сможете легко получить нитрат алюминия, просто объединив азотную кислоту и алюминий. В этом случае алюминий образует пассивирующий слой. Но нитрат алюминия можно получить, если соединить трихлорид алюминия и азотную кислоту. Поступая таким образом, вы также создадите побочный продукт, нитрозилхлорид, который выделяется из раствора в виде газа. Нитрат алюминия можно также получить, если смешать сульфат алюминия и нитрат свинца. Из раствора выпадет сульфат свинца, а в растворе останется только нитрат алюминия.
В этом случае алюминий образует пассивирующий слой. Но нитрат алюминия можно получить, если соединить трихлорид алюминия и азотную кислоту. Поступая таким образом, вы также создадите побочный продукт, нитрозилхлорид, который выделяется из раствора в виде газа. Нитрат алюминия можно также получить, если смешать сульфат алюминия и нитрат свинца. Из раствора выпадет сульфат свинца, а в растворе останется только нитрат алюминия.
Растворимость нитрата алюминия в различных веществах
Нитрат алюминия пытались растворить в таких веществах, как вода, метанол, этанол и этиленгликоль. Нитрат алюминия растворим во всех этих веществах. Что касается воды, он растворяется в количестве 160 г/100 мл при 100 °C. В случае метанола растворимый показатель составляет 14,45 г/100 мл. Нитрат алюминия растворяется в этаноле при концентрации 8,63 г/100 мл. А когда дело доходит до этиленгликоля, существует коэффициент растворимости 18,32 г/100 мл.
Применение нитрата алюминия
Это соединение представляется весьма ценным и имеет множество важных применений. Во-первых, нитрат алюминия оказался очень сильным окислителем. По этой причине он абсолютно бесценен в процессе окисления. Хотя это основное применение нитрата алюминия, существуют и другие применения, и их тоже следует учитывать.
Во-первых, нитрат алюминия оказался очень сильным окислителем. По этой причине он абсолютно бесценен в процессе окисления. Хотя это основное применение нитрата алюминия, существуют и другие применения, и их тоже следует учитывать.
Нитрат алюминия используется для извлечения урана. Процесс добычи урана заключается в извлечении урана из земли. Учитывая, насколько важен уран, без него очень сложно представить современный мир. Нитрат алюминия используется для этого процесса извлечения урана. Поэтому проведение экстракции было бы намного сложнее без нитрата алюминия.
Наверное, каждый человек нашего века знает об антиперспирантах и области их применения. Антиперспиранты относятся к группе дезодорантов и препятствуют потоотделению, а также влияют на запах тела человека. Обычно антиперспиранты наносят под руки. Нитрат алюминия является незаменимым компонентом антиперспирантов, производство которых невозможно без нитрата алюминия.
Соединение нитрата алюминия также широко используется в качестве компонента ингибиторов коррозии. Ингибиторы коррозии — это вещества, которые добавляют в различные устройства для предотвращения коррозии этих устройств. Например, ингибиторы коррозии широко используются со всеми типами ультразвуковых очистителей. А нитрат алюминия всегда добавляется в ингибиторы коррозии и служит одним из важнейших компонентов этих средств.
Ингибиторы коррозии — это вещества, которые добавляют в различные устройства для предотвращения коррозии этих устройств. Например, ингибиторы коррозии широко используются со всеми типами ультразвуковых очистителей. А нитрат алюминия всегда добавляется в ингибиторы коррозии и служит одним из важнейших компонентов этих средств.
Другой важной областью применения нитрата алюминия является крашение, где он используется в качестве протравы. Морилка – это специальное средство, которое служит определенной цели, заключающейся в связывании красителей с материалами. Когда дело доходит до нитрата алюминия, он специально используется с хлопком. Без использования нитрата алюминия красители просто не будут связываться с хлопком. По этой причине нитрат алюминия является очень важным компонентом в процессе окрашивания хлопкового материала.
Нефть и масла также очищаются нитратом алюминия. Большое значение в промышленности имеют процессы переработки нефти и нефти. Например, благодаря такой переработке сырая нефть может быть преобразована в бензин или газолин, LPG (сжиженный нефтяной газ), керосин, дизельное топливо, мазут и реактивное топливо. И ни один из этих процессов не может осуществляться без использования нитрата алюминия. Это еще одно доказательство важности нитрата алюминия для промышленности.
И ни один из этих процессов не может осуществляться без использования нитрата алюминия. Это еще одно доказательство важности нитрата алюминия для промышленности.
И, конечно же, азотнокислый алюминий, как химическое соединение, широко используется для демонстрации студентам и учащимся различных типов химических реакций. При применении нитрата алюминия эти реакции приобретают действительно интересный и яркий вид. Видя такие яркие реакции, студенты и школьники лучше понимают процессы, происходящие в химии, становятся более умными и образованными.
Что касается других гидратированных и негидратированных типов нитратов алюминия, они также широко используются в промышленности. Использование, которое выделяется среди всех, заключается в следующем. Соли нитрата алюминия используются для производства глинозема, который затем используется для производства различных видов изоляционной бумаги. Электронно-лучевая трубка состоит из различных элементов, а в ее нагревательных элементах используется нитрат алюминия. Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Хорошо известно, что различные соединения широко используются в области медицины, и в этой области также предпринимались попытки применить нитрат алюминия. Однако на данный момент его применяли только к крысам во время различных испытаний. Результаты этих тестов были разными, включая как эффективное, так и неэффективное использование нитрата алюминия по отношению к крысам. Что касается применения нитрата алюминия для человека, то оно еще не применялось. В то же время исследования в этой области продолжаются и, возможно, когда-нибудь нитрат алюминия будет применяться по отношению к человеку. Нитрат алюминия может стать эффективным для лечения людей, как и любое другое соединение.
Меры предосторожности при пожаре
Несмотря на то, что нитрат алюминия является легковоспламеняющимся соединением, он может вызвать некоторые проблемы, связанные с пожаром, поэтому при работе с ним необходимо соблюдать некоторые меры предосторожности. При сгорании нитрата алюминия могут образовываться токсичные оксиды азота. А если компаунд сгорит вместе с некоторыми горючими продуктами, то пожар в результате может существенно увеличиться. Кроме того, все емкости, служившие для хранения нитрата алюминия, следует тщательно промыть водой. В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
При сгорании нитрата алюминия могут образовываться токсичные оксиды азота. А если компаунд сгорит вместе с некоторыми горючими продуктами, то пожар в результате может существенно увеличиться. Кроме того, все емкости, служившие для хранения нитрата алюминия, следует тщательно промыть водой. В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
Нитрат алюминия следует хранить вдали от канализации и источников воды. Следует избегать контакта нитрата алюминия с пламенем, искрами и различного рода возгораниями.
Как защитить себя при работе с нитратом алюминия?
Хотя это вещество не очень опасно, вы должны действовать надлежащим образом, чтобы защитить себя при обращении с ним. Например, при работе с нитратом алюминия следует надевать средства защиты. Защитное снаряжение включает лицевой щиток и защитные очки. Кроме того, следует также использовать перчатки из резины и пылезащитные респираторы.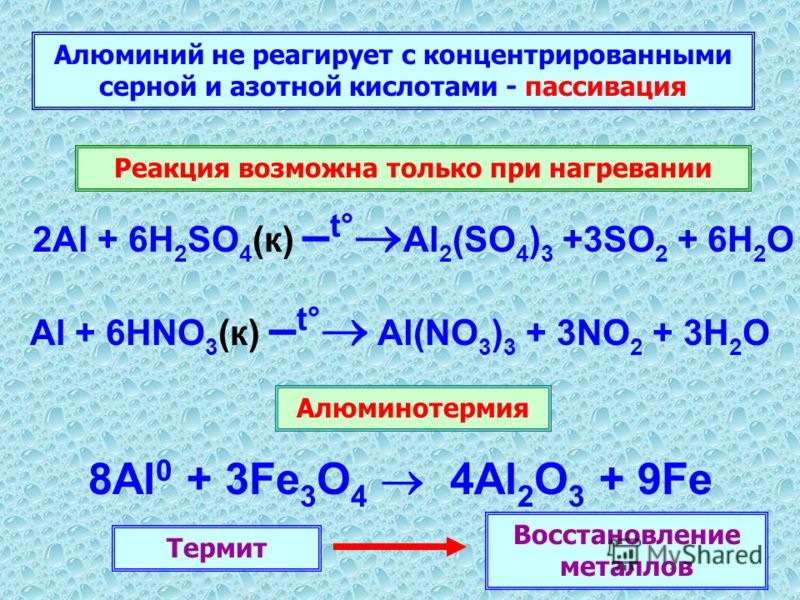
Если вы по какой-то причине проглотили это вещество в большой дозе, у вас будут серьезные осложнения со здоровьем, включая раздражение желудка, рвоту, понос и тошноту. В случае любого из них в результате приема нитрата алюминия следует обратиться к врачу.
Если нитрат алюминия попал в глаза или на кожу, у вас может возникнуть раздражение глаз или кожи. После попадания нитрата алюминия в глаза следует промыть глаза большим количеством воды в течение 15 минут. Поверхность кожи также следует промыть водой с легким мылом.
Формула нитрата алюминия
Al(NO3)3
Свойства нитрата алюминия
Название паспорта безопасности: Алюминий нитрат нонагидрат
Молярная масса: 212,996 г/моль (безводный), 6 г/моль903на4 (безводный), 375,103на4 Температура плавления: 66 ° C (151 ° F, 339 K) (безводный), 73,9 ° C (165,0 ° F, 347,0 K) (без гидрата)
Температура кипения: 150 ° C (302 ° F, 423 K) (без гидрата) разлагается
Плотность: 1,72 г/см3 (нонагидрат)
Al(NO3)3·9h3O (Al[NO3]3[h3O]9) Кристаллическая структура — SpringerMaterials
Получить доступ
СИФ
Скачать справку (pdf)
-
Влияние пандемии COVID-19
-
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
-
Для просмотра контента, пожалуйста
войдите в систему или обратитесь к представителю Springer.
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
|
Стандартизированные данные |
||
|---|---|---|
| Космическая группа |
|
|
| и | ||
| б | ||
| в | ||
| α | ||
| β | ||
| γ | ||
| а/б | ||
| б/к | ||
| к/с | ||
| В |
Координаты атома
Стандартизированный
|
|||||||||
Детали эксперимента
-
Влияние пандемии COVID-19
-
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
-
Для просмотра контента, пожалуйста
войдите в систему или обратитесь к представителю Springer.
Ссылка
-
Влияние пандемии COVID-19
-
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
-
Для просмотра контента, пожалуйста
войдите в систему или обратитесь к представителю Springer.
3D интерактивная структура
-
Влияние пандемии COVID-19
-
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
-
Для просмотра контента, пожалуйста
войдите в систему или обратитесь к представителю Springer.
Об этом контенте
Имя базы данных
PAULING FILE Multinaries Edition – 2012 г.
Идентификатор набора данных
sd_1600139
Авторские права
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Главный редактор
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Кредиты
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред.

![{mathsf {Al(NO_{3})_{3}+4H_{2}Oleftrightarrows [Al(H_{2}O)_{4}]^{{3+}}+3NO_{3}^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20e7f089b6f887fdf2b9bc0243c59168ba412052)
![{mathsf {[Al(H_{2}O)_{4}]^{{3+}}+H_{2}Oleftrightarrows [Al(H_{2}O)_{3}(OH)]^{{2+}}+H_{3}O^{+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b99b79a01eb414967bc983c36ed9faf716e34a2)


![{mathsf {Al(NO_{3})_{3}+4NaOH=Na[Al(OH)_{4}]+3NaNO_{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fdad34d0f1bcad0329d43d50a4fadcffcee3155)










![{mathsf {2AlBr_{3}+8N_{2}O_{5}=2[NO_{2}]^{-}[Al(NO_{3})_{4}]^{+}+3Br_{2}+6NO_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bef4333c8d98bf4e9855d208a2770329f0dde6fb)
![{mathsf {2[NO_{2}]^{-}[Al(NO_{3})_{4}]=2Al(NO_{3})_{3}+4NO_{2}+O_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce2690b48a974e284fda6581b1515299bb3b260b)


