Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2019 года; проверки требуют 3 правки.
| Нитрат цинка | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
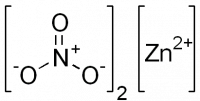
| Хим. формула | Zn(NO3)2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 12825; 125073 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| InChI |
InChI=1S/2NO3.Zn/c2*2-1(3)4;/q2*-1;+2 ONDPHDOFVYQSGI-UHFFFAOYSA-N |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Безопасность | |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение,
соль металла цинка и азотной кислоты с формулой Zn(NO3)2,
бесцветные кристаллы,
растворяется в воде,
образует кристаллогидраты.
Получение[править | править код]
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
Физические свойства[править | править код]
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Применение[править | править код]
- Протрава при крашении тканей.
Литература[править | править код]
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Zinc nitrate |
|
| Other names
Zinc dinitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.038 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1514 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Zn(NO3)2 |
| Molar mass | 189.36 g/mol (anhydrous) 297.49 g/mol (hexahydrate) |
| Appearance | colorless, deliquescent crystals |
| Density | 2.065 g/cm3 (hexahydrate) |
| Melting point | 110 °C (230 °F; 383 K) (anhydrous) 45.5 °C (trihydrate) 36.4 °C (hexahydrate) |
| Boiling point | ~ 125 °C (257 °F; 398 K) decomposes (hexahydrate) |
|
Solubility in water |
327 g/(100 mL), 40 °C (trihydrate) 184.3 g/(100 mL), 20 °C (hexahydrate) |
| Solubility | very soluble in alcohol |
|
Magnetic susceptibility (χ) |
−63.0·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Oxidant, may explode on heating |
| GHS labelling: | |
|
Pictograms |
 
|
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 1206 |
| Related compounds | |
|
Other anions |
Zinc sulfate Zinc chloride |
|
Other cations |
Cadmium nitrate Mercury(II) nitrate |
|
Related compounds |
Copper(II) nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc nitrate is an inorganic chemical compound with the formula Zn(NO3)2. This colorless, crystalline salt is highly deliquescent. It is typically encountered as a hexahydrate Zn(NO3)2·6H2O. It is soluble in both water and alcohol.
Synthesis[edit]
Zinc nitrate is usually prepared by dissolving zinc metal, zinc oxide, or related materials in nitric acid:
- Zn + 2 HNO3 → Zn(NO3)2 + H2
- ZnO + 2 HNO3 → Zn(NO3)2 + H2O
These reactions are accompanied by the hydration of the zinc nitrate.
The anhydrous salt arises by the reaction of anhydrous zinc chloride with nitrogen dioxide:[1]
- ZnCl2 + 4 NO2 → Zn(NO3)2 + 2 NOCl
Reactions[edit]
Treatment of zinc nitrate with acetic anhydride gives zinc acetate.[2]
On heating, zinc nitrate undergoes thermal decomposition to form zinc oxide, nitrogen dioxide and Oxygen:
- 2 Zn(NO3)2 → 2 ZnO + 4 NO2 + 1 O2
Applications[edit]
Zinc nitrate has no large scale application but is used on a laboratory scale for the synthesis of coordination polymers.[3] Its controlled decomposition to zinc oxide has also been used for the generation of various ZnO based structures, including nanowires.[4]
It can be used as a mordant in dyeing. An example reaction gives a precipitate of zinc carbonate:
- Zn(NO3)2 + Na2CO3 → ZnCO3 + 2 NaNO3
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 455. ISBN 978-0-08-037941-8.
- ^ O. F. Wagenknecht; R. Juza (1963). “Zinc Acetate”. In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2. NY,NY: Academic Press. p. 1087.
- ^ Barnett, Sarah A; Champness, Neil R (November 2003). “Structural diversity of building-blocks in coordination framework synthesis—combining M(NO3)2 junctions and bipyridyl ligands”. Coordination Chemistry Reviews. 246 (1–2): 145–168. doi:10.1016/S0010-8545(03)00121-8.
- ^ Greene, Lori E.; Yuhas, Benjamin D.; Law, Matt; Zitoun, David; Yang, Peidong (September 2006). “Solution-Grown Zinc Oxide Nanowires”. Inorganic Chemistry. 45 (19): 7535–7543. doi:10.1021/ic0601900. PMID 16961338.
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат цинка | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 12825; 125073 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| InChI |
1S/2NO3.Zn/c2*2-1(3)4;/q2*-1;+2 ONDPHDOFVYQSGI-UHFFFAOYSA-N |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
-
- ZnO + 2HNO3 → Zn(NO3)2 + H2O
-
- Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O
-
- ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2↑ + H2O
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
-
- Zn + 2N2O4 → Zn(NO3)2 + 2NO↑
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Применение
- Протрава при крашении тканей.
- Справочник
- Справочник структурных формул
- н
- Нитрат цинка
Нитрат цинка
Zn(NO3)2
Zn(+2)(N(+5)O(-2)3)2
O`^-/N^+`|O|O^-/0Zn^++O`^-/N^+`|O|O^-
Брутто-формула: N2O6Zn
Молекулярная масса: 189.378
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| N | Азот (Nitrogen) | 14.007 | 2 | 14.8% |
| O | Кислород (Oxygen) | 15.999 | 6 | 50.7% |
| Zn | Цинк (Zinc) | 65.37 | 1 | 34.5% |
Синонимы
- Азотнокислый цинк
- Нитрат цинка
- AC1L2NHO
- Celloxan
- Nitrate de zinc
- Nitrate de zinc [French]
- Nitric acid, zinc salt(CAS)
- UNII-EDO66F5U49
- X 4 (nitrate)
- Zinc dinitrate
- Zinc nitrate
- Zinc nitrate (Zn(NO3)2)
- Zincnitrate hydrate;
- zinc;dinitrate(IUPAC)
Входит в группы
Неорганические соли
Структурная формула
Истинная, эмпирическая, или брутто-формула: N2O6Zn
Химический состав Нитрата цинка
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Zn | Цинк | 65,37 | 1 | 50,7% |
| N | Азот | 14,007 | 2 | 14,8% |
| O | Кислород | 15,999 | 6 | 50,7% |
Молекулярная масса: 189,378
Нитрат цинка-неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
ZnO + 2HNO3 → Zn(NO3)2 + H2O
Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O
ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2 + H2O
Безводную соль получают реакцией металлического цинка с диоксидом азота:
Zn+2N2O4 → Zn(NO3)2+2NO
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3
.
Применение
Протрава при крашении тканей.






