Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019 года; проверки требуют 14 правок.
| Нитрат меди(II) | |
|---|---|
  |
|
| Систематическое название | Нитрат меди(II) |
| Другие названия | Медь азотнокислая |
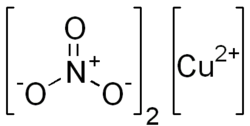
| Химическая формула | Cu(NO3)2 |
| Внешний вид |
Бесцветные кристаллы (безводный) Голубые кристаллы (кристаллогидраты) |
| Свойства | |
| Молярная масса |
безводный: 187,57 г/моль; тригидрат: 241.63 г/моль; гексагидрат: 295,69 г/моль |
| Температура плавления |
безводный: 255 °C[1]; тригидрат: 114,5 °C; гексагидрат: 24,4 °C |
| Температура разложения | безводный: 170 °C |
| Плотность |
безводный: 3,05 г/см³; тригидрат: 2,32 г/см³; гексагидрат: 2,074 г/см³ |
| Растворимость в воде | 124,7 г/100 мл |
| Токсикологические данные | |
| LD50 | тригидрат: 940 мг/кг |
| Структура | |
| Кристаллическая решётка |
безводный: ромбическая; тригидрат: ромбическая; гексагидрат: триклинная; 1,5- и 2,5-гидраты: моноклинная |
| Термодинамические свойства | |
| Стандартная энтальпия образования |
безводный: −310 кДж/моль; тригидрат: −1217 кДж/моль |
| Стандартная молярная энтропия | +192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −117 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 10031-43-3 |
| Регистрационный номер EINECS | 221-838-5 |
| ChEBI | 78036 |
| Номер ООН | 1477 |
| Код SMILES | [Cu++].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| Код InChI | InChI=1S/Cu.2NO3/c;2*2-1(3)4/q+2;2*-1 |
| Безопасность | |
| R-фразы | R8, R22, R34 |
| S-фразы | S17, S26, S36/37/39, S45, S60 |
| H-фразы |
H272, H314, H318, H302 |
| P-фразы |
P221, P210, P303+P361+P353, P305+P351+P338, P405, P501 |
| Пиктограммы опасности |
|
| Пиктограммы опасности СГС |
|
| NFPA 704 |
0 1 3 OX |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Нитра́т ме́ди(II) — неорганическое вещество с формулой 
Нахождение в природе[править | править код]
Нитрат меди(II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит[2] | Руаит[3] | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства[править | править код]
Безводный нитрат меди(II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО[4].
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов[5]:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, параметры ячейки a = 0,591 нм, b = 0,777 нм, c = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, параметры ячейки a = 1,12 нм, b = 0,505 нм, c = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, параметры ячейки a = 1,64539 нм, b = 0,49384 нм, c = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, параметры ячейки a = 2,22 нм, b = 0,490 нм, c = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C[6].
Химические свойства[править | править код]
Разложение[править | править код]
Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты. Реакция протекает в горячей воде:
Гидролиз[править | править код]
Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди(II) подвергается обратимому гидролизу:
В упрощённом виде:
Обменные реакции[править | править код]
В водных растворах нитрат меди(II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II))
Прочие реакции[править | править код]
Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I):
Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка (аддукта):
Получение[править | править код]
Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди, оксида меди(II) или гидроксида меди(II):
Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота. Реакция протекает при 80 °C в этилацетате):
Применение[править | править код]
Нитрат меди(II) используют для получения чистого оксида меди(II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей[5].
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»)[7].
Токсичность[править | править код]
Нитрат меди(II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.[8]
Примечания[править | править код]
- ↑ При быстром нагревании или избыточном давлении.
- ↑ Герхардтит на webmineral.com. Дата обращения: 28 июля 2010. Архивировано 2 мая 2012 года.
- ↑ Руаит на webmineral.com. Дата обращения: 28 июля 2010. Архивировано 2 мая 2012 года.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 147. — 637 с. — ISBN 978-5-358-01303-2.
- ↑ 1 2 [www.xumuk.ru/encyklopedia/2460.html Нитрат меди на xumuk.ru]. Дата обращения: 15 июля 2010.
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104. — 685 с. — ISBN 5-7107-8085-5.
- ↑ Menke J. B. Nitration with nitrates (неопр.) // Recueil des Travaux Chimiques des Payes-Bas. — 1925. — Т. 44. — С. 141.
- ↑ Merck Safety Data Sheet — Copper(II) nitrate trihydrate (pdf)
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов
|
| Нитрат меди (II) | |
|---|---|
 |
|
| Систематическое название | Нитрат меди (II) |
| Другие названия | Медь азотнокислая |
| Химическая формула | Cu(NO3)2 |
| Внешний вид | Бесцветные кристаллы (безводный) Голубые кристаллы (кристаллогидраты) |
| Молярная масса | безводный: 187,57 г/моль; тригидрат: 241.63 г/моль; гексагидрат: 295,69 г/моль |
| Температура плавления | безводный: 255 °C; тригидрат: 114,5 °C; гексагидрат: 24,4 °C |
| Температура разложения | безводный: 170 °C |
| Плотность | безводный: 3,05 г/см³; тригидрат: 2,32 г/см³; гегсагидрат: 2,074 г/см³ |
| Растворимость в воде | 124,7 г/100 мл |
| LD50 | тригидрат: 940 мг/кг |
| Кристаллическая решётка | безводный: ромбическая; тригидрат: ромбическая; гексагидрат: триклинная; 1,5- и 2,5-гидраты: моноклинная |
| Стандартная энтальпия образования | безводный: −310 кДж/моль; тригидрат: −1217 кДж/моль |
| Стандартная молярная энтропия | +192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −117 кДж/моль |
| ГОСТ | ГОСТ 4163-68 |
| Регистрационный номер CAS | 10031-43-3 |
| Регистрационный номер EC | 221-838-5 |
| Пиктограммы опасности |  |
| Пиктограммы опасности СГС |   |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Нитрат меди (II) — неорганическое вещество с формулой Cu(NO3)2 , является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди (II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Разложение
- 3.2 Гидролиз
- 3.3 Обменные реакции
- 3.4 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность

Нахождение в природе
Нитрат меди (II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит | Руаит | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
Безводный нитрат меди (II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО.
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, параметры ячейки a = 0,591 нм, b = 0,777 нм, c = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, параметры ячейки a = 1,12 нм, b = 0,505 нм, c = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, параметры ячейки a = 1,64539 нм, b = 0,49384 нм, c = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, параметры ячейки a = 2,22 нм, b = 0,490 нм, c = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C.
Химические свойства
Разложение
Нитрат меди (II) при нагревании разлагается с образованием оксида меди (II) и диоксида азота:
- 2Cu(NO3)2 →>170∘C 2CuO + 4NO2 + O2
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
- 3NO2 + H2O ⟶ 2HNO3 + NO↑
Гидролиз
Нитрат меди (II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
- Cu(NO3)2 + 4H2O ⟶ [Cu(H2O)4]2+ + 2NO3−
Катион тетрааквамеди (II) подвергается обратимому гидролизу:
- [Cu(H2O)4]2+ + H2O ⇄ [Cu(H2O)3(OH)]+ + H3O+ , pKa = 7,34
В упрощённом виде:
- Cu2+ + H2O ⇄ CuOH+ + H+
Обменные реакции
В водных растворах нитрат меди (II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
- Cu(NO3)2 + 2NaOH ⟶ Cu(OH)2 ↓ + 2NaNO3
с фосфатом натрия (выпадает синий осадок)
- 3Cu(NO3)2 + 2Na3PO4 + 3H2O ⟶ Cu3(PO4)2 ⋅ 3H2O↓ + 6NaNO3
с жёлтой кровяной солью (выпадает красный осадок)
- 2Cu(NO3)2 + K4[Fe(CN)6] ⟶ Cu2[Fe(CN)6]↓ + 4KNO3
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
- Cu(NO3)2 + 4NH3 ⋅ H2O ⟶ [Cu(NH3)4](NO3)2 + 4H2O
с азидами щелочных металлов (выпадает коричневый осадок азида меди (II))
- Cu(NO3)2 + 2MN3 →0−10∘C Cu(N3)2 ↓ + 2MNO3 (M = Li, Na)
Прочие реакции
Нитрат меди (II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди (I):
- 4Cu(NO3)2 + 18(NH2OH ⋅ H2O) ⟶ 4CuN3↓ + 9N2O↑ + 12NH3↑ + 27H2O
- 4Cu(NO3)2 + (N2H4 ⋅ H2O) + 4NaOH ⟶ 4CuN3↓ + N2↑ + 4NaN3 + 5H2O
Нитрат меди (II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
- Cu(NO3)2 + N2O4 ⟶ Cu(NO3)2 ⋅ N2O4↓
Получение
Нитрат меди (II) может быть получен растворением в азотной кислоте металлической меди, оксида меди (II) или гидроксида меди (II):
- Cu + 4HNO3 ⟶ Cu(NO3)2 + 2NO2↑ + 2H2O
- CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O
- Cu(OH)2 + 2HNO3 ⟶ Cu(NO3)2 + 2H2O
Безводный нитрат меди (II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
- Cu + 2N2O4 ⟶ Cu(NO3)2 + 2NO↑

Применение
Нитрат меди (II) используют для получения чистого оксида меди (II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей.
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»).
Токсичность
Нитрат меди (II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.
|
Соединения меди |
|---|
|
|
Нитраты |
|---|
|
Copper II Nitrate consists of the elements Copper, Nitrogen and Oxygen. Copper is a metal with good electrical & thermal conductivity. It is present in group-11 of the periodic table. Copper is represented with the symbol Cu and its atomic number is 29. Nitrogen is a colorless, tasteless, odorless gas and the most plentiful element in Earth’s atmosphere. It is present in group-15 of the periodic table and is represented with the symbol N. Oxygen is a highly reactive nonmetal present in group-16 of the periodic table. Its atomic number is 8 and is represented by the symbol O.
What is Copper II Nitrate?
Copper II Nitrate is an inorganic, blue-colored crystalline compound with the molecular formula Cu(NO3)2. It is obtained in two forms- trihydrate and hexahydrate forms.
When the Cu(NO3)2 compound is burned, it produces toxic nitrogen oxides. The other names of Copper II Nitrate are Cupric nitrate and Copper Dinitrate. It exists naturally in nature and is partially found in some minerals such as rouaite and gerhardtite.
Structure of Copper II Nitrate
The chemical/molecular formula of the compound Copper II Nitrate is Cu(NO3)2, whose molecular structure can be represented as shown below:

Copper II Nitrate Structure
Preparation of Copper II Nitrate
- Copper II Nitrate is prepared by Copper metal and Nitric Acid reaction. The chemical reaction is given by-
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
- The other way to prepare Copper II Nitrate is by treating Copper with Dinitrogen tetraoxide.
Cu + 2N2O4 → Cu(NO3)2 + 2NO
Physical Properties of Copper II Nitrate
- The Copper II Nitrate appears to be a Blue colored Crystalline solid.
- The molecular weight of Cu(NO3)2 is equal to 187.5558 g/mol.
- Copper II Nitrate is soluble in water, ethanol, and ammonia.
- The boiling and melting points of Copper II Nitrate are 170 °C and 114.5 °C respectively.
- The density of Cu(NO3)2 is 3.05 g/cm3.
Chemical Properties of Copper II Nitrate
- Copper II Nitrate is used in pyrolysis process at above 180 °C to produce Cupric Oxide. The chemical reaction is mentioned below-
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Copper Dinitrate reacts with acetic anhydride to boost the nitration process of aromatic compounds such as benzene.
- When blue-colored Copper (II) Nitrate reacts with colorless Sodium Hydroxide produces a light blue color precipitate as,
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
Harmful Effects of Copper II Nitrate
- Copper II Nitrate irritates the eyes, skin, throat and lungs.
- It is non-combustible compound but combined with wood and paper leads to severe fire breakout.
Safety measures of Copper II Nitrate
- Keep the Copper II Nitrate compound away from the body to prevent irritation in body parts.
- We need to make sure that Cu(NO3)2 shouldn’t come into contact with explosives, and wood.
Uses of Copper II Nitrate
- Copper II Nitrate is used as an insecticide.
- It is used in the production of medicines and light-sensitive papers.
- Copper Dinitrate is used to generate the Cupric oxide.
- It manufactures pyrotechnic, coats and blue colors.
- On burning Copper II Nitrate generates toxic oxides of Nitrogen.
Sample Questions
Question 1: Copper II Nitrate is health hazardous compound?
Answer:
Yes. It is a health hazardous compound. Copper II Nitrate cause irritation to the throat, lungs, eyes and skin. It is combined with wood to cause fire breakouts.
Question 2: Give pyrolysis process of Copper II Nitrate.
Answer:
Copper II Nitrate is heated at 180 °C in boiling tube to produce copper oxide, nitrogen dioxide and oxygen gas.
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Question-3: Find the molecular weight of Copper II Nitrate.
Answer:
Copper II Nitrate consists of 1 Copper atom, 2 Nitrogen, 6 Oxygen atoms.
Atomic weight of Copper = 63.546
Atomic weight of each Nitrogen = 14.0067
Atomic weight of each Oxygen = 15.999
Molecular weight of Cu(NO3)2 = 63.546 + (2 × 14.0067) + (6 × 15.999)
=187.55
Question 4: What happens when Ammonia reacts with Copper II Nitrate?
Answer:
When Ammonia is added to the Copper II Nitrate we get a pale blue precipitate Cu(OH)2 and the dark blue colored compound because of Cu(NH3)4 2+.
Question 5: What are the uses of Copper II Nitrate?
Answer:
Copper II Nitrate is used in production of medicines. It is used in making of papers. It acts as an insecticide. It generate cupric oxide. It is also used in chemical analysis.
Question 6: Give a way to prepare Cupric Nitrate.
Answer:
Copper II Nitrate is prepared by the reaction of Copper metal with Nitric Acid. The chemical reaction is given by-
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
Question 7: Is Cupric Nitrate Ionic or covalent compound?
Answer:
Copper II Nitrate is an ionic compound. Because copper is a metal and Nitrogen and oxygen elements are non metals. So there exists an ionic bond between a metal and non metal. So ionic bond is present in between Cu+2 and NO3–.
Last Updated :
01 Jun, 2022
Like Article
Save Article
| Нитрат меди(II) | |
  |
|
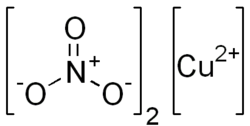
| Систематическое название |
Нитрат меди(II) |
|---|---|
| Другие названия |
Медь азотнокислая |
| Химическая формула |
Cu(NO3)2 |
| Внешний вид |
Бесцветные кристаллы (безводный) |
| Свойства | |
| Молярная масса |
безводный: 187,55 г/моль; |
| Температура плавления |
безводный: 255 °C[1]; |
| Температура разложения |
безводный: 170 °C |
| Плотность |
безводный: 3,05 г/см³; |
| Растворимость в воде |
124,7 г/100 мл |
| Токсикологические данные | |
| LD50 |
тригидрат: 940 мг/кг |
| Структура | |
| Кристаллическая решётка |
безводный: ромбическая; |
| Термодинамические свойства | |
| Стандартная энтальпия образования |
безводный: −310 кДж/моль; |
| Стандартная молярная энтропия |
+192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса |
−117 кДж/моль |
| Классификация | |
| Регистрационный номер CAS |
10031-43-3 |
| Регистрационный номер EC |
221-838-5 |
| Безопасность | |
| R-фразы |
R22; R36/38; R50/53 |
| S-фразы |
S61 |
| H-фразы |
H272; H302; H315; H319; H410 |
| P-фразы |
P210; P273; P302+P352; P305+P351+P338 |
|
Символы опасности |
|
|
Символы опасности СГС |
|
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Нитра́т ме́ди(II) — неорганическое вещество с формулой  , является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди(II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
, является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди(II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Разложение
- 3.2 Гидролиз
- 3.3 Обменные реакции
- 3.4 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
- 7 Примечания
Нахождение в природе
Нитрат меди(II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит[2] | Руаит[3] | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
Безводный нитрат меди(II) при нормальных условиях — твердое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО[4].
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов[5]:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, а = 0,591 нм, b = 0,777 нм, с = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, а = 1,12 нм, b = 0,505 нм, с = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, а = 1,64539 нм, b = 0,49384 нм, с = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, а = 2,22 нм, b = 0,490 нм, с = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C[6].
Химические свойства
Разложение
Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
Гидролиз
Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди(II) подвергается обратимому гидролизу:
В упрощённом виде:
Обменные реакции
В водных растворах нитрат меди(II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II))
Прочие реакции
Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I):
Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Получение
Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди, оксида меди(II) или гидроксида меди(II):
Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
Применение
Нитрат меди(II) используют для получения чистого оксида меди(II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей[5].
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»)[7].
Токсичность
Нитрат меди(II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — [8]
Примечания
- ↑ При быстром нагревании или избыточном давлении.
- ↑ Герхардтит на webmineral.com. Архивировано из первоисточника 2 мая 2012.
- ↑ Руаит на webmineral.com. Архивировано из первоисточника 2 мая 2012.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 147. — 637 с. — ISBN 978-5-358-01303-2
- ↑ 1 2 Нитрат меди на xumuk.ru. Архивировано из первоисточника 2 мая 2012.
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104. — 685 с. — ISBN 5-7107-8085-5
- ↑ Menke J. B. (1925). «Nitration with nitrates». Recueil des Travaux Chimiques des Payes-Bas 44: 141.
- ↑ Merck Safety Data Sheet — Copper(II) nitrate trihydrate (pdf)
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения меди |
|---|
|
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) • |
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
Нитрат меди – это неорганическое медьсодержащее соединение. Вещество нашло применение во многих сферах, прежде всего в органическом и неорганическом синтезе в качестве источника добычи меди и её оксидов, ценного катализатора. Раствор нитрата меди – протрава для усиления окраски тканей, используется в сельском хозяйстве, пиротехнике, строительстве.
Содержание
- Что такое нитрат меди, виды, формулы
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение нитрата меди, уравнение
- Применение
- Применение меди нитрата в сельском хозяйстве
- Применение меди нитрата в химии и других сферах
- Опасность нитратов меди, меры предосторожности
- Где купить и сколько стоит
- Заключение
Что такое нитрат меди, виды, формулы
Нитрат меди – это соль амфотерного металла меди и остатка азотной кислоты. Химическая формула:
Cu(NO3)2
За счёт специфического свойства меди (двойственная валентность), она способна в зависимости от условий удерживать возле себя либо 1 либо два атома других элементов. Соответственно, существует две разновидности нитрата меди:
- нитрат меди I – CuNO3;
- нитрат меди II – Cu(NO3).
Однако вариация с единичной валентностью меди является теоретической, т.е. вещество существует в теории, но не было получено на практике. Это связано с вероятной неустойчивостью такого объединения. Поэтому о его качествах рассуждают гипотетически.
В природе чистый нитрат меди не встречается, однако с примесями его находят в минералах. Герхардтит помимо нитрата меди также содержит гидроксилол. Минерал имеет тёмно-зелёную окраску, стеклянный блеск, низкую твёрдость по шкале Мооса, прозрачен. Довольно часто встречается в Италии, Чехии, Украине, Франции.
Нитрат меди в окружающей среде находят в руаитах, отличающихся изумрудным окрасом. Это хрупкое образование, прозрачное, имеет вид пластинчатых кристаллов, обнаруживается значительно реже. Известны месторождения в Африке, Германии.
Физические свойства, внешний вид
Нитрат меди представляет собой мелкие синие кристаллы без вкуса и запаха. Они эффективно растворяются в воде и поглощают влагу из воздуха, образуя кристаллогидраты. Раствор нитрата проявляет кислую среду за счёт обилия катионов H+. Стремительно образует раствор с водой, а также растворителями органической природы: этанол, метанол, летучие ароматические соединениям: фенол, толуол, бензол.
Температура плавления нитрата меди высока и составляет порядка 255 °С при плотности 3,05 г/см3. Термолиз протекает при 170 °С.
Если подвергать водный раствор нитрата кристаллизации, можно выделить гидраты ряда Cu(NO3)2 ∙ хH2O, где х = 6, 3, 2,5 и 1,5. В отличие от других подобных веществ, имеющих связь с водой, нитрат меди объединяется с математически нецелыми частями, формируя реагенты, описываемые формулами Cu(NO3)2 ∙ 2,5H2O и Cu(NO3)2 ∙ 1,5H2O. Свойства меди нитрата, напитавшегося водой, немного отличаются: растворы менее плотные и формируются значительно быстрее.
Химические свойства, реакции
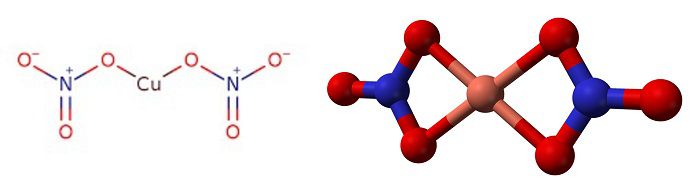
Структурная формула и молекула нитрата меди
Нитрат меди — это высокореактивное вещество. Он вступает во взаимодействие с растворами и твёрдыми формами многих солей, гидроксидами, кислотами. Так, нитрат меди реагирует с едкой щелочью, в ходе реакции формируется гидроксид меди:
Cu(NO3)2 + NaOH → 2NaNO3 + Cu(OH)2↓
Раствор нитрата меди реагирует с фосфатами, в этой реакции выпадает нерастворимый осадок:
3Cu(NO3)2 + 2Na3PO4 → Cu3(PO4)2↓ + 6NaNO3
Нитрат меди реагирует с сероводородом, вступая в реакцию осаждения сульфида чёрного цвета:
Cu(NO3)2 + H2S → CuS↓ + 2HNO3
При прокаливании нитрата запускается реакция термического разложения:
Cu(NO3)2 → 2СuO + 4NO2↑ + О2↑
Если пропускать через раствор нитрата меди электрический ток, наблюдается реакция электролиза:
Cu(NO3)2 + H2O → 2Cu↓ + 4HNO3 + O2↑
В растворе нитрата меди протекает индикаторная реакция выхода аммиаката:
Cu(NO3)2 + 4NH3 → [Cu(NH3)4](NO3)2
Раствор при этом окрашивается в яркий сине-фиолетовый цвет, выдающий присутствие в нём меди.
Нитрат меди реагирует с йодидами, характерна окислительно-восстановительная реакция с выделением чистого йода и смеси нитрата с йодидом:
Cu(NO3)2 + 4NaI → 2CuI + I2 + 4NaNO3
Производство и получение нитрата меди, уравнение

Получение нитрата меди в лаборатории основано на растворении в кислотах металла меди. Типичный синтез показан в уравнении меди реакции:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Нитрат меди растворяется в полярных растворителях, что применяется для получения его из гидроксида:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
В промышленных масштабах получение вещества ведется посредством схожих реакций.
Нитрат меди I предположительно можно синтезировать восстановлением раствора нитрата медью Реакция описывается уравнением меди нитрата:
[Cu(NH3)4](NO3)2 + Cu → 2CuNO3 + 4NH3
Применение
Нитрат меди применяется во многих областях. Применение захватывает преимущественно отрасль химии, где нитрат меди выступает как катализатор и реактив для превращения других веществ с медью. В текстильной промышленности – это фиксатор и протрава для прокрашивания тканевых волокон, в пиротехнических изделиях нитрат меди придаёт пламени жёлтый цвет.
Применение меди нитрата в сельском хозяйстве
Применение нитрата меди подавляет развитие болезнетворных микроорганизмов, патогенных грибков за счёт сильной окислительной способности. Вещество разрушает мембраны грибов, нарушает целостность их гиф и предотвращает формирование мицелия. В садоводстве и комнатном цветоводстве нитрат меди в комплексе с другими препаратами защищает растения от плесени и загнивания.
Нитрат меди нацелен на борьбу с такими микозами, как:
- антракноз;
- фитофтороз;
- корневая гниль;
- мучнистая роса;
- ржавчина.
Применение меди нитрата в химии и других сферах
Нитрат меди востребован при получении оксидов меди. Он играет роль реактива, поставляющего основной металл. Кроме того, раствор нитрата – источник медьсодержащих агентов, обладающих выраженной каталитической активностью. При добавлении в смесь уксусного альдегида готовят реагент Менке, необходимых для реакции нитрования органики. Он адсорбируется на глине, а затем измельчается до суспензии, применяемый для окисления тиолов.
Нитрат меди важен для прокраски нитей. Он выступает протравой, позволяющей сохранить пигмент на волокнах надолго. Он не позволяет ему состирываться и выгорать на солнце, надолго фиксирует яркость и естественный цвет.
Опасность нитратов меди, меры предосторожности
Нитрат меди относится к 3 классу опасности (умеренно опасно). При попадании на открытые участки кожи вызывает сильное раздражение. Разъедает кожные покровы, оставляя глубоки ожоги. Вдыхание порошка опасно, поскольку нежная слизистая дыхательных путей повреждается. Провоцирует кашель, иногда повреждает бронхи. При применении нитрата меди необходимо соблюдать меры безопасности: носить защитные перчатки, респиратор и очки. После контакта тщательно мыть руки и споласкивать полость рта, при первых признаках отравления – срочно обратиться к врачу.
Где купить и сколько стоит
Нитрат меди продают заводы-производители. Оптовая цена раствора нитрата меди за 1 л составляет 500 рублей при минимальной закупке 40 литров. Он доступен к покупке в интернет-магазинах по стоимости 600 рублей за 100 г.
Заключение
Нитрат меди – это активная соль, которую из-за особых свойств применяют для синтеза медных реактивов, превращений органики, создания пиротехники. Она необходима для защиты растительности от грибковых заболеваний, окраски текстиля. Вещество опасно, работать с ним следует в специальной одежде.
Читайте также:
- Гидроксиды меди: виды, свойства, применение
- Сульфат меди Е519: свойства, применение, вред и польза
- Нитрат алюминия: свойства, реакции, применение
- Сульфид алюминия: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
![]() Загрузка…
Загрузка…



![{displaystyle {mathsf {Cu(NO_{3})_{2}+4 H_{2}Olongrightarrow [Cu(H_{2}O)_{4}]^{2+}+2 NO_{3}^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a457d67525be6380e626c568ac672651c9425f92)
![{displaystyle {mathsf {[Cu(H_{2}O)_{4}]^{2+}+ H_{2}Orightleftarrows [Cu(H_{2}O)_{3}(OH)]^{+}+ H_{3}O^{+}}}, pK_{a} =7,34}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fefdc2299ff5aef0f5c6b593ce7a73b6c875f02f)



![{displaystyle {mathsf {2Cu(NO_{3})_{2}+ K_{4}[Fe(CN)_{6}]longrightarrow Cu_{2}[Fe(CN)_{6}]!downarrow +4 KNO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eddab57b9e1e9d8024fc40eb39595deef0c5c416)
_{2}+4 H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0b3ef50bc9653a0e1d20c8134cde299de3e397b)















![mathsf{Cu(NO_3)_2 + 4 H_2O longrightarrow [Cu(H_2O)_4]^{2+} + 2 NO_3^-}](https://dic.academic.ru/dic.nsf/ruwiki/b17d2c8ac25770f6a1118d2eac5a980a.png)
![mathsf{[Cu(H_2O)_4]^{2+} + H_2O rightleftarrows [Cu(H_2O)_3(OH)]^+ + H_3O^+} , pK_a = 7,34](https://dic.academic.ru/dic.nsf/ruwiki/eead5a428babd744e9232a27f5050cea.png)



![mathsf{2 Cu(NO_3)_2 + K_4[Fe(CN)_6] longrightarrow Cu_2[Fe(CN)_6] downarrow + 4 KNO_3}](https://dic.academic.ru/dic.nsf/ruwiki/8408d28d195929764d7df9e667931f19.png)
_2 + 4 H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/212c0a3b0b768c3637db974ea52959fc.png)








