Оксид кальция


4.7
Средняя оценка: 4.7
Всего получено оценок: 163.
4.7
Средняя оценка: 4.7
Всего получено оценок: 163.
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
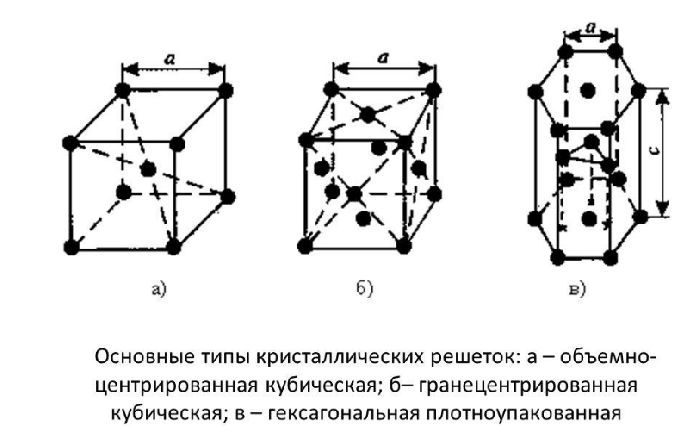
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Общее описание вещества представлено в таблице.
|
Признак |
Значение |
|
Формула соединения оксид кальция |
CaO |
|
Температура плавления |
2627°C |
|
Температура кипения |
2850°C |
|
Растворимость |
В глицерине. В этаноле не растворяется, с водой образует гидроксид |
|
Молярная масса |
56,077 г/моль |
|
Плотность |
3,37 г/см3 |
|
Химическая связь в кристалле |
Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.

Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
2Ca + O2 → 2CaO;
- при термической обработке гидроксида или солей кальция –
Ca(OH)2 → CaO + H2O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
|
Реакции |
Что образуется |
Молекулярное уравнение |
|
С водой |
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла |
CaO + H2O → Ca(OH)2 |
|
С кислотами |
Растворяется, образуя соли |
CaO + 2HCl → CaCl2 +H2O |
|
С оксидами неметаллов (кислотными остатками) |
Образуются соли |
CaO + SO2 → CaSO3 |
|
С углеродом при нагревании |
Образуется карбид кальция |
CaO + 3С → СаС2 + CO |
|
С алюминием |
Восстанавливает кальций. Образуется оксид алюминия |
3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.


Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Владимир Комаров
10/10
-

Сергей Ефремов
4/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 163.
А какая ваша оценка?
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Оксид кальция


Средняя оценка: 4.7
Всего получено оценок: 125.
Средняя оценка: 4.7
Всего получено оценок: 125.
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
 Рис. 1. Кубические гранецентрированные кристаллические решётки.
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
Признак
Значение
Формула соединения оксид кальция
В глицерине. В этаноле не растворяется, с водой образует гидроксид
Химическая связь в кристалле
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Реакция получения оксида кальция из известняка выглядит следующим образом:
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции
Что образуется
Молекулярное уравнение
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла
Растворяется, образуя соли
С оксидами неметаллов (кислотными остатками)
С углеродом при нагревании
Образуется карбид кальция
CaO + 3С → СаС2 + CO
Восстанавливает кальций. Образуется оксид алюминия
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.
 Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.
Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.

Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Структура, свойства и применение оксида кальция (CaO)
оксид кальция (CaO) является неорганическим соединением, которое содержит кальций и кислород в ионных формах (не путать с пероксидом кальция, CaO2). Это известно во всем мире как известь, слово, которое обозначает любое неорганическое соединение, которое содержит карбонаты, оксиды и гидроксиды кальция, а также другие металлы, такие как кремний, алюминий и железо..
Этот оксид (или известь) также в разговорной речи называют негашеной или гашеной известью, в зависимости от того, гидратирована она или нет. Известь является оксидом кальция, а гашеная известь — его гидроксидом. В свою очередь, известняк (известняк или затвердевшая известь) на самом деле является осадочной породой, состоящей в основном из карбоната кальция (CaCO3).

Это один из крупнейших природных источников кальция и является сырьем для производства оксида кальция. Как получается этот оксид? Карбонаты подвержены термическому разложению; нагревание карбонатов кальция при температуре выше 825 ° С, что приводит к образованию извести и углекислого газа.
Вышеприведенное утверждение можно описать следующим образом: CaCO3(s) → CaO (s) + CO2(G). Поскольку земная кора богата известняком и кальцитом, а в океанах и на пляжах имеются многочисленные морские раковины (сырье для производства оксида кальция), оксид кальция является относительно дешевым реагентом.
- 1 Формула
- 2 Структура
- 3 свойства
- 3.1 Растворимость
- 4 использования
- 4.1 В качестве раствора
- 4.2 При производстве очков
- 4.3 В майнинге
- 4.4 Как средство для удаления силикатов
- 5 наночастиц оксида кальция
- 6 Ссылки
формула
Химическая формула оксида кальция — СаО, в котором кальций подобен кислотному иону (акцептору электронов) Са 2+ , и кислород в качестве основного иона (донора электронов) ИЛИ 2— .
Почему кальций имеет +2 заряда? Потому что кальций принадлежит к группе 2 периодической таблицы (г-н Бекамбара) и имеет только два валентных электрона, доступных для образования связей, которые уступают атому кислорода.
структура
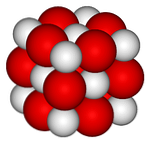
На верхнем изображении представлена кристаллическая структура (типа драгоценной соли) для оксида кальция. Объемные красные сферы соответствуют ионам Ca 2+ и белые сферы с ионами O 2- .
В этом кубическом кристаллическом расположении каждый ион Са 2+ окружен шестью ионами O 2- , закупорены в октаэдрических отверстиях, оставленных между ними большими ионами.
Эта структура максимально выражает ионный характер этого оксида, хотя заметное различие радиусов (красная сфера больше, чем белая) придает более слабую кристаллическую ретикулярную энергию по сравнению с MgO.
свойства
Физически это кристаллическое белое твердое вещество без запаха и с сильными электростатическими взаимодействиями, которые ответственны за его высокие температуры плавления (2572 ° C) и кипения (2850 ° C). Кроме того, он имеет молекулярную массу 55,958 г / моль и интересную способность быть термолюминесцентным.
Это означает, что кусок оксида кальция, подверженный воздействию пламени, может сиять интенсивным белым светом, известным на английском языке под названием центр внимания, или по-испански, легкий кальций. Ионы Са 2+ , при соприкосновении с огнем они вызывают красноватое пламя, как показано на следующем изображении.

растворимость
CaO является основным оксидом, который обладает сильным сродством к воде в той степени, в которой он поглощает влагу (это гигроскопичное твердое вещество), и немедленно реагирует с образованием гашеной извести или гидроксида кальция:
Эта реакция является экзотермической (выделяет тепло) из-за образования твердого тела с более сильными взаимодействиями и более стабильной кристаллической решеткой. Тем не менее, реакция является обратимой, если Ca (OH) нагревается2, обезвоживание и освещение гашеной извести; затем лайм «возрождается».
Полученный раствор является очень основным, и если он насыщен оксидом кальция, он достигает рН 12,8.
Кроме того, он растворим в глицерине и в растворах кислоты и сахара. Поскольку это основной оксид, он, естественно, имеет эффективные взаимодействия с кислотными оксидами (SiO2, в2О3 и вера2О3, например) растворим в их жидких фазах. С другой стороны, он нерастворим в спиртах и органических растворителях.
приложений
CaO широко используется в промышленности, а также для синтеза ацетилена (CH≡CH), для извлечения фосфатов из сточных вод и в реакции с диоксидом серы из газообразных отходов..
Другие применения оксида кальция описаны ниже:
Как ступка
Если оксид кальция смешан с песком (SiO2) и вода спекается с песком и медленно реагирует с водой с образованием гашеной извести. В свою очередь, СО2 воздуха растворяется в воде и вступает в реакцию с солью с образованием карбоната кальция:
CaCO3 Это более стойкое и более твердое соединение, чем CaO, в результате чего раствор (предыдущая смесь) затвердевает и фиксирует кирпичи, блоки или керамику между ними или на желаемой поверхности..
В производстве очков
Основным сырьем для производства стекол являются оксиды кремния, которые смешивают с известью, карбонатом натрия (Na2Колорадо3) и другие добавки, которые затем подвергают нагреванию, в результате чего получается стеклообразное твердое вещество. Это твердое вещество впоследствии нагревается и выдувается в любых фигурах.
В горном деле
Гашеная известь занимает больший объем, чем негашеная, благодаря взаимодействиям водородных связей (О-Н-О). Это свойство используется, чтобы разбить камни изнутри.
Это достигается путем наполнения их компактной смесью извести и воды, которая герметизирована, чтобы сосредоточить ее тепло и экспансивную силу в породе..
Как средство для удаления силикатов
CaO сплавляется с силикатами с образованием коалесцирующей жидкости, которая затем извлекается из сырья определенного продукта..
Например, железные руды являются сырьем для производства металлического железа и стали. Эти минералы содержат силикаты, которые являются нежелательными примесями для процесса и устраняются только что описанным способом..
Наночастицы оксида кальция
Оксид кальция можно синтезировать в виде наночастиц, варьируя концентрации нитрата кальция (Са (NO3)2) и гидроксид натрия (NaOH) в растворе.
Эти частицы являются сферическими, основными (а также твердыми на макроуровне) и имеют большую площадь поверхности. Следовательно, эти свойства выгодны каталитическим процессам. Что? В настоящее время следствие отвечает на этот вопрос.
Эти наночастицы были использованы для синтеза замещенных органических соединений, полученных из пиридинов, при разработке новых лекарств для проведения химических превращений, таких как искусственный фотосинтез, для очистки воды от тяжелых и вредных металлов, а также для фотокаталитические агенты.
Наночастицы могут быть синтезированы на биологической подложке, такой как листья папайи и зеленый чай, для использования в качестве антибактериального средства..
источники:
http://obrazovaka.ru/himiya/oksid-kalciya-formula.html
http://ru.thpanorama.com/articles/qumica/xido-de-calcio-cao-estructura-propiedades-y-usos.html
Физические свойства
Оксид кальция CaO — бинарное неорганическое вещество. Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
CaCO3 = CaO + CO2
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
CaH2 + O2 = CaO + H2O
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами:
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. Оксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
3CaO + 2H3PO4 = Ca3(PO4)2↓ + 3H2O
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
CaO + H2O = Ca(OH)2
Оксид кальция, характеристика, свойства и получение, химические реакции.
Оксид кальция – неорганическое вещество, имеет химическую формулу CaO.
Краткая характеристика оксида кальция
Физические свойства оксида кальция Иные свойства оксида кальция
Получение оксида кальция
Химические свойства оксида кальция
Химические реакции оксида кальция
Применение и использование оксида кальция
Краткая характеристика оксида кальция:
Оксид кальция – неорганическое вещество, порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы. Не имет запаха.
Так как валентность кальция равна двум, то оксид кальция содержит один атом кислорода и один атом кальция.
Химическая формула оксида кальция CaO.
Оксид кальция широко известен как негашёная известь.
Оксид кальция в воде не растворяется, а вступает в реакцию с ней. Практически не растворяется в этаноле. Не растворяется в диэтиловом эфире.
Оксид кальция относится к высокотоксическим веществам. Класс опасности 2. Это едкое вещество, особенно опасен при смешивании с водой.
Препарат в виде пыли и капель взвеси раздражает слизистые оболочки органов дыхания, попадая на кожу, вызывает тяжелые ожоги, особенно сильно действует на слизистую оболочку глаз.
Предельно допустимая концентрация в воздухе рабочей зоны производственных помещений – 3 мг/м3.
При работе с препаратом следует применять индивидуальные средства защиты (респираторы, защитные очки, резиновые перчатки), а также соблюдать меры личной гигиены. Не допускать попадания препарата на слизистые оболочки и на кожу.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы общей приточно-вытяжной вентиляцией, а места наибольшего пыления – укрытиями с местной вытяжной вентиляцией. Испытания препарата в лабораториях следует проводить в вытяжном шкафу.
При проведении анализа окиси кальция с использованием горючего газа следует соблюдать меры противопожарной безопасности.
См. ГОСТ 8677-76 Реактивы. Кальция оксид. Технические условия (с Изменением N 1).
Физические свойства оксида кальция:
| Наименование параметра: | Значение: |
| Химическая формула | CaO |
| Синонимы и названия иностранном языке | calcium oxide (англ.) известь негашеная (рус.) кальция окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы, без запаха |
| Цвет | бесцветный, от белого до бледно-жёлтого |
| Вкус | —* |
| Запах | не имеет |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,37 |
| Температура кипения, °C | 2850 |
| Температура плавления, °C | 2570 |
| Температура возгонки (сублимации), °C | не имеет |
| Температура разложения, °C | не имеет |
| Молярная масса, г/моль | 56,0774 |
* Примечание:
— нет данных.
Получение оксида кальция:
Оксид кальция получается в результате следующих химических реакций:
- 1. путем термического разложения известняка:
Сa2СО3 → CaО + СО2 (t = 900-1200 oC).
Это промышленный способ получения оксида кальция. Технологически данный процесс в промышленности реализуют в специальных шахтных печах.
- 2. путем сжигания кальция на воздухе:
2Сa + О2 → 2CaО (t = 300 oC).
- 3. путем термического разложения гидроксида кальция:
Сa(OH)2 → СaO + H2О (t = 520-580 oC).
- 4. путем термического разложения нитрата кальция:
2Сa(NO3)2 → 2СaO + 4NO2 + O2 (t = 450-500 oC).
Химические свойства оксида кальция. Химические реакции оксида кальция:
Оксид кальция относится к основным оксидам.
Химические свойства оксида кальция аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида кальция с хлором:
2CaO + 2Cl2 → 2CaCl2 + O2 (t = 700 oC).
В результате реакции образуется хлорид кальция и кислород.
2. реакция оксида кальция с кремнием:
2CaO + 5Si → 2CaSi2 + SiO2 (t = 1300 oC).
В результате реакции образуется силицид кальция и оксид кремния.
3. реакция оксида кальция с углеродом:
CaО + 3С → CaС2 + СО (t = 1900-1950 oC);
2CaO + 5C → 2CaC2 + CO2 (t = 700 oC).
В результате реакции образуется карбид кальция и оксид углерода.
4. реакция оксида кальция с алюминием:
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 oC);
2Al + 6CaO → 3CaO•Al2O3 + 3Ca (to);
2Al + 6CaO → Ca3Al2O6 + 3Ca (to).
В результате реакции образуется кальций и соответственно алюминат кальция, оксид алюминия-кальция и алюмината трикальция.
5. реакция оксида кальция с водой:
CaО + Н2О → Ca(ОН)2.
Оксид кальция реагирует с водой, образуя гидроксид кальция. Процесс имеет название «гашение извести». Химическая реакция происходит с выделением энергии (тепла).
6. реакция оксида кальция с оксидом углерода (углекислым газом):
CaО + СО2 → CaСО3.
Оксид кальция реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат кальция.
7. реакция оксида кальция с оксидом серы:
CaО + SО2 → CaSО3;
CaО + SО3 → CaSО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит кальция, во втором случае – сульфат кальция.
8. реакция оксида кальция с оксидом кремния:
CaО + SiО2 → CaSiО3 (t = 1100-1200 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат кальция.
9. реакция оксида кальция с оксидом фосфора:
CaO + P2O5 → Ca(PO3)2;
3CaO + P2O5 → Ca3(PO4)2 (to);
2CaO + P2O5 → Ca2P2O7.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль соответственно: метафосфат кальция, фосфат кальция и дифосфата кальция.
Аналогично проходят реакции оксида кальция и с другими кислотными оксидами.
10. реакция оксида кальция с оксидом алюминия:
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат кальция.
11. реакция оксида кальция с оксидом марганца:
CaО + MnO2 → CaMnO3 (t°);
Mn2O3 + CaO → CaMn2O4 (t = 900 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соответственно: соль – манганит кальция либо оксид марганца-кальция.
Аналогично проходят реакции оксида кальция и с другими амфотерными оксидами.
12. реакция оксида кальция с оксидом свинца:
СaО + 2PbO2 → Сa2PbО4 (tо).
В результате реакции образуется соль – плюмбит кальция. Реакция протекает при сплавлении реакционной смеси.
Аналогично проходят реакции оксида кальция и с другими оксидами.
13. реакция оксида кальция с тетраоксидом диазота:
СaО + 2N2О4 → N2O3 + Сa(NO3)2 (t = 250 °C).
Реакция идет в жидком тетраоксиде диазота. В результате реакции образуются оксид азота (III) и соль – нитрат кальция.
14. реакция оксида кальция с плавиковой кислотой:
СaO + 2HF → СaF2 + H2O.
В результате химической реакции получается соль – фторид кальция и вода.
15. реакция оксида кальция с азотной кислотой:
СaO + 2HNO3 → 2Сa(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат кальция и вода.
Аналогично проходят реакции оксида кальция и с другими кислотами.
16. реакция оксида кальция с бромистым водородом (бромоводородом):
СaO + 2HBr → СaBr2 + H2O.
В результате химической реакции получается соль – бромид кальция и вода.
17. реакция оксида кальция с йодоводородом:
СaO + 2HI → СaI2 + H2O.
В результате химической реакции получается соль – йодид кальция и вода.
Применение и использование оксида кальция:
Оксид кальция используется в производстве строительных материалов, в качестве пищевой добавки E-529.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида кальция
реакции с оксидом кальция
Коэффициент востребованности
9 578
.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1
 Запомни при составлении
Запомни при составлении
формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» –
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице “растворимости…“.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.

рис.2
 Запомни если степени
Запомни если степени
окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
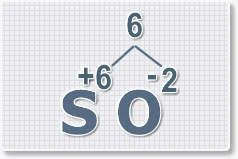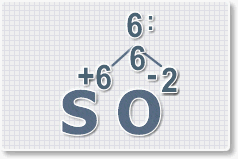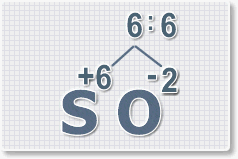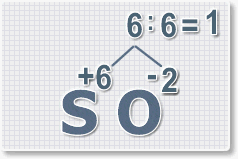
Рис.3
6 : 2 = 3
это индекс для кислорода
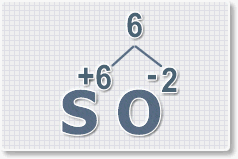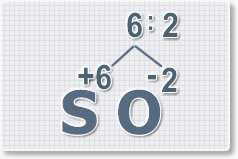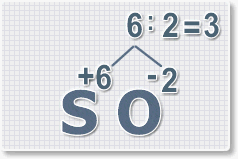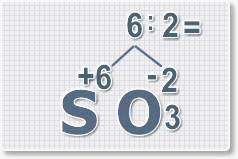
Рис.4
В результате получим
формулу оксида серы (VI):

* * *
