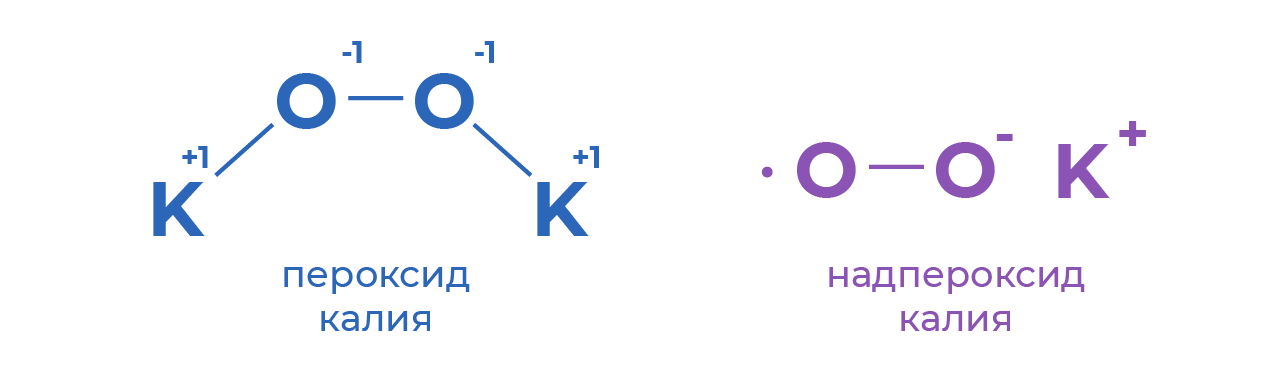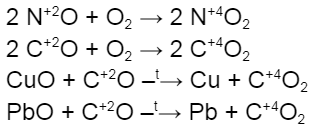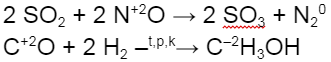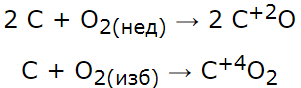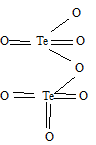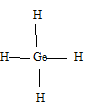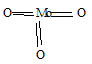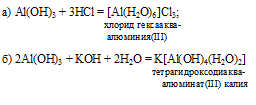ДЛЯ начала нам понадобится таблица Менделеева
1) ФОРМУЛЫ ВЫСШИХ ОКСИДОВ
высший оксид -это оксид с максимальной валентностью
максимальная валентность определяется по номеру группы ( главной подругппы),в которой находится элемент
ПРИМЕР:
алюминий находится в третьей группе ,значит его валентность будет III
III 6 II
Al 2 O3
III -валентность алюминия
II- валентность кислорода (постоянная)
6 – наименьшее общее кратное между II и III
6 делим на валентность алюминия III получаем его индекс 2
6 делим на валентность кислорода II получаем индекс кислорода 3
и получается Al₂O₃
еще пример: фосфор – в пятой группе ,значит максимальная валентность V
P2O5 и т.д.
2) летучее водородное соединение
только элементы IV,V,VI и VII групп образуют ЛЕТУЧИЕ водородные соединения.
валентность элемента в соединении с водородм равна 8-номер группы.
пример
хлор находится в 7 группе, значит его валентность с водородом будет 8-7=1
и формула
I I
H Cl
сера – 6 группа валентность 8-6=2. значит валентность серы будет II
I II
H ₂ S
вот и все тонкости
Удачи
Оксиды, их классификация, физические свойства
Оксиды, их классификация, физические свойства
Оксиды – интересные и уникальные вещества. Они очень распространены в окружающей среде: стекло (основной компонент SiO₂), алюминиевая посуда (снаружи покрыта прочной оксидной пленкой Al₂O₃), ржавчина на железе (Fe₂O₃), песок на пляже (опять же SiO₂), газированные напитки (CO₂)… Причина их широкой распространенности – хорошая реакционная способность кислорода воздуха окислять практически всё на своём пути. По этой же причине так мало металлов и неметаллов, которые в природе находятся в самородном состоянии.
Что же такое оксид?
Оксид – это бинарное соединение, содержащее кислород со степенью окисления -2. Важно помнить, что к оксидам не относятся пероксиды и надпероксиды. Пероксид – бинарное соединение, содержащее кислород со степенью окисления -1. Например, H₂O₂ или Na₂O₂. Надпероксид (или супероксид) – бинарное соединение, содержащее кислород со степенью окисления -1/2. Например, KO₂.
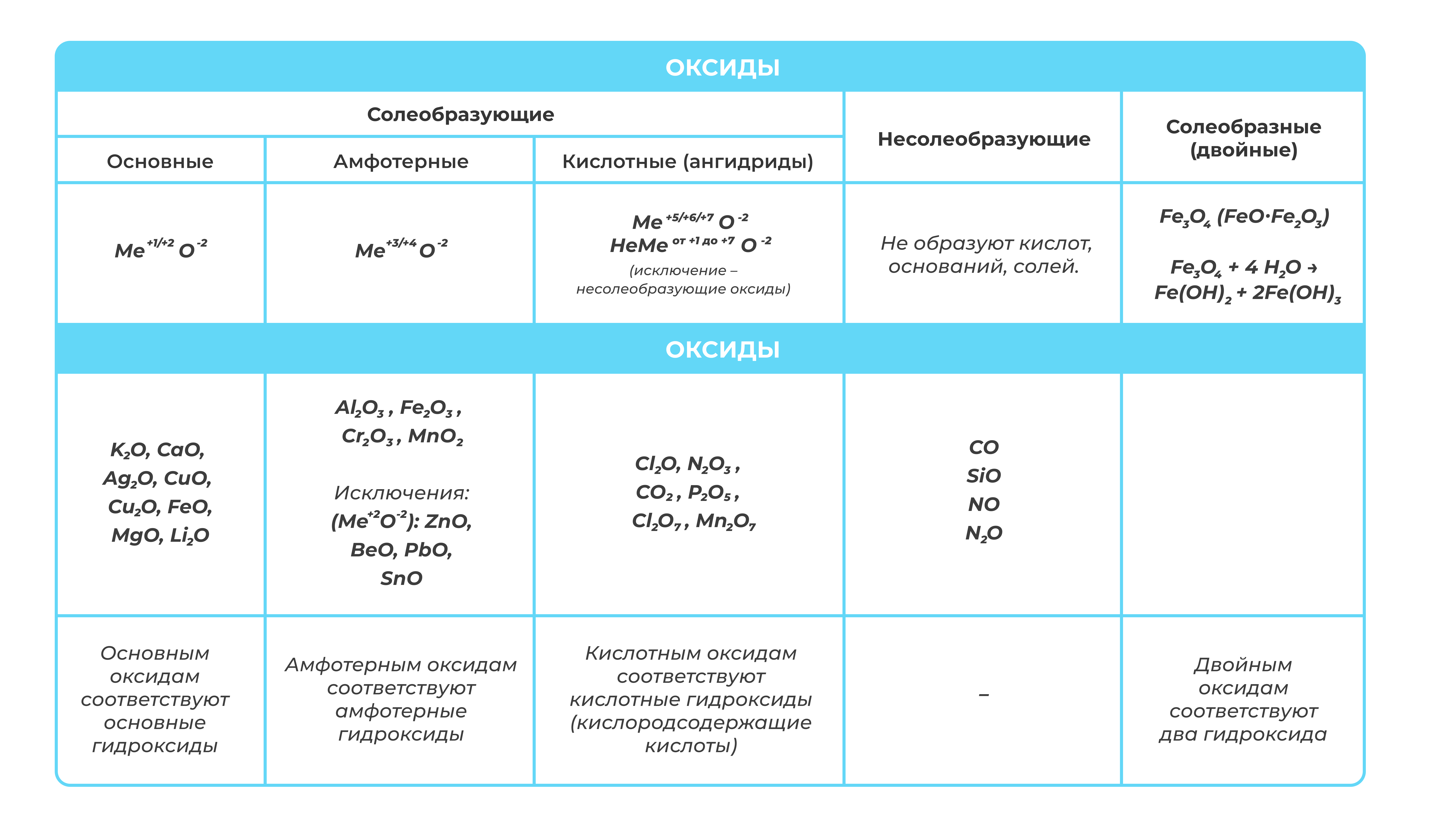
Классификация оксидов
А теперь рассмотрим классификацию оксидов:
Физические свойства оксидов:
Оксиды встречаются во всех трёх агрегатных состояниях, которое зависит от вида оксида.
Кислотные и несолеобразующие оксиды.
Газообразное состояние встречается только у оксидов неметаллов: углекислого газа – CO₂, бурого газа – NO₂, сернистого газа – SO₂, веселящего газа – N₂O и угарного газа CO. В жидком состоянии встречаются Mn₂O₇ (зеленовато-бурый или красный маслянистый), SO₃ (бесцветный) и N₂O₃ (синий)…
Оксиды неметаллов встречаются и в твёрдом агрегатном состоянии. Они имеют молекулярную кристаллическую решетку и низкие температуры плавления (искл. SiO₂ – атомная КР и высокая tплав).
Температуры плавления и кипения некоторых кислотных оксидов.
Основные и амфотерные оксиды.
Такие оксиды при обычных условиях – твердые вещества, которые имеют ионную кристаллическую решетку и высокие температуры плавления.
Температуры плавления и кипения некоторых основных и амфотерных оксидов.
В природе существуют примеры оксидов, которые разлагаются при высокой температуре. Например, оксид ртути(II) распадается на простые вещества при 500°C :
2 HgO 2 Hg + O₂
Такой способ получения кислорода в 1774 году открыл английский ученый Джозеф Пристли.
Задания:
А теперь попробуем разобрать на примерах, где нам эти знания пригодятся на ЕГЭ.
1. Составь формулу оксида элемента в высшей степени окисления, расположенного в:
а. VA группе 3 периода;
б. IIIA группе 3 периода;
в. VIIA группе 3 периода;
г. IIB группе 4 периода.
Укажи его характер.
Ответ: P₂O₅ – кислотный оксид, Al₂O₃ – амфотерный оксид, Cl₂O₇ – кислотный оксид, ZnO – амфотерный оксид.
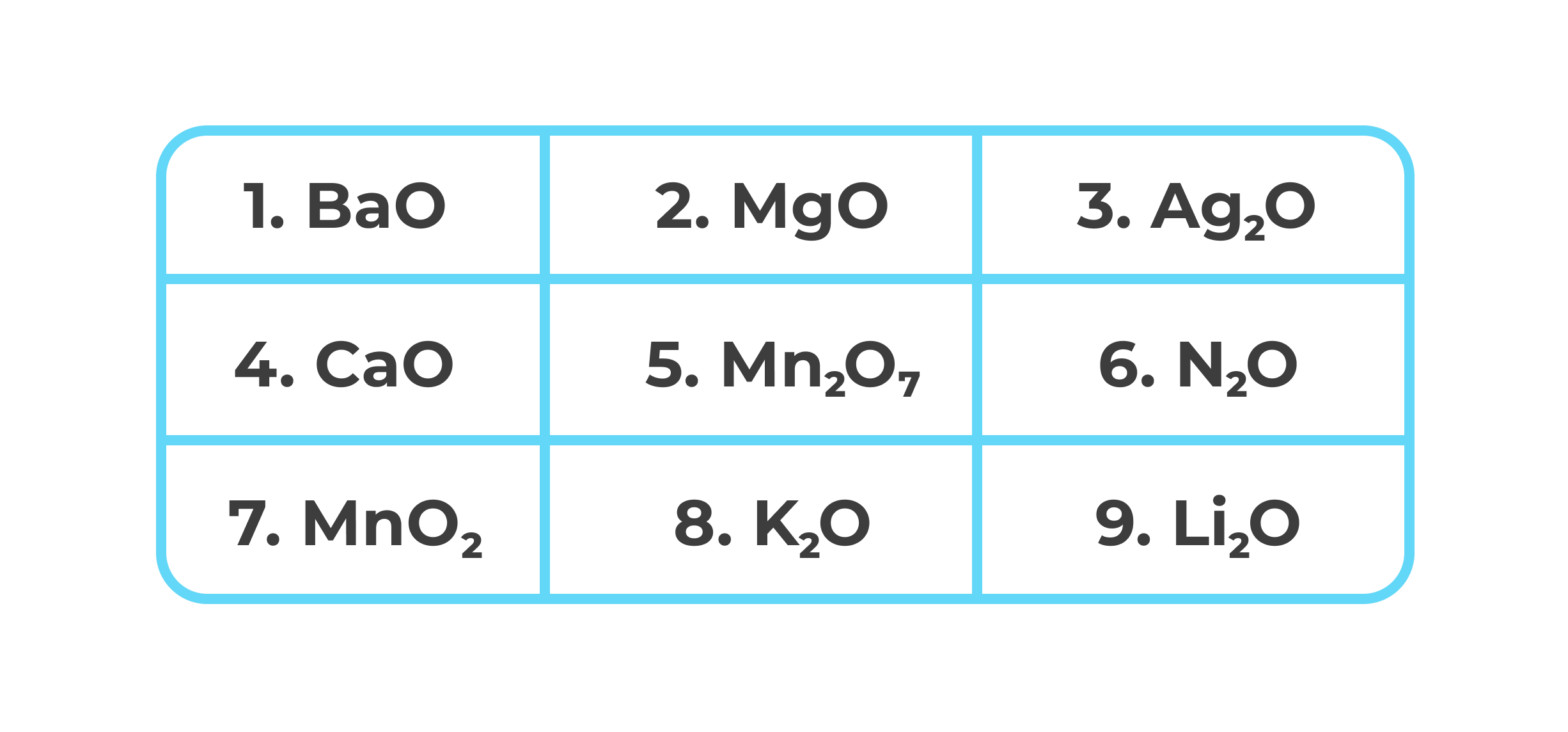
2. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выбери формулы: А) амфотерного оксида; Б) кислотного оксида; В) несолеобразующего оксида.
Ответ: 756
Химические свойства оксидов
Химические свойства оксидов
Оксид – это вещества, в формуле которых мы встретим кислород (О) в степени окисления −2. Какими химическими свойствами они обладают и как с ними решать задания, мы поговорим в этой статье.
Рассмотрим схемы, которые позволят изучить данную тему за 5 минут.
Условные обозначения:
 |
– условия протекания реакции. |
 |
– продукты реакции. |
Химические свойства основных оксидов.
1. Взаимодействие с водой.
 |
оксид растворимого основания |
Примеры реакций: Na₂O + H₂O → 2 NaOH CuO + H₂O –/→ |
 |
растворимое основание (щелочь) |
2. Взаимодействие с кислотным или амфотерным оксидом.
 |
хотя бы один из реагирующих оксидов должен быть «сильным» (образует сильное основание или кислоту) |
Примеры реакций: CaO + CO₂ ZnO + Na₂O FeO + SiO₂ –/→ |
 |
средняя соль |
3. Взаимодействие с кислотой или амфотерным гидроксидом.
 |
хотя бы один из реагентов должен быть “сильным” (образует сильное основание или кислоту) |
Примеры реакций: Na₂O + 2 HCl → 2 NaCl + H₂O ! K₂O + 2 H₃PO₄(изб.) → 2 KH₂PO₄ + H₂O ! K₂O + H₃PO₄ → K₂HPO₄ + H₂O ! 3 K₂O + 2 H₃PO₄(нед.) → 2 K₃PO₄ + 3 H₂O Al₂O₃ + 6 HCl → 2 AlCl₃ + 3 H₂O CrO + H₂S –/→ |
 |
соль (кислая или средняя) и вода |
Химические свойства кислотных оксидов.
1. Взаимодействие с водой.
 |
кислотный оксид должен образовать растворимую кислоту |
Примеры реакций: SO₃ + H₂O → H₂SO₄ CO₂ + H₂O ⇄ H₂CO₃ SiO₂ + H₂O –/→ |
 |
растворимая кислота |
2. Взаимодействие с основным или амфотерным оксидом.
 |
хотя бы один из реагирующих оксидов должен быть “сильным” (образует сильное основание или кислоту) |
Примеры реакций: CO₂ + Na₂O Al₂O₃ + P₂O₅ CuO + SO₂ –/→ |
 |
средняя соль |
3. Взаимодействие с основанием.
 |
хотя бы один из реагентов должен быть “сильным” (образует сильное основание или кислоту) |
Примеры реакций: SO₂ + 2 NaOH → Na₂SO₃ + H₂O CO₂ + Ca(OH)₂ → CaCO₃ + H₂O ! CO₂(изб) + NaOH → NaHCO₃ Fe(OH)₂ + CO₂ –/→ |
 |
соль (кислая или средняя) и вода |
Химические свойства амфотерных оксидов.
1. Взаимодействие с кислотным и основным оксидом при нагревании (см. пункт I.2 и II.2)
2. Взаимодействие с кислотой.
 |
сильная кислота |
Примеры реакций: BeO + H₂SO₄ → BeSO₄ + H₂O Fe₂O₃ + 6 HCl → 2 FeCl₃ + 3H₂O ZnO + HNO₂ –/→ |
 |
соль (кислая или средняя) и вода |
3. Взаимодействие с основанием.
 |
сильное основание (щелочь) |
Примеры реакций: ZnO + 2 NaOH + H₂O → Na₂[Zn(OH)₄] ZnO + 2 NaOH Al₂O₃ + 2 KOH + 3 H₂O → 2 K[Al(OH)₄] Al₂O₃ + 2 KOH |
 |
· если реакция в растворе – комплексная соль |
Химические свойства несолеобразующих оксидов.
Несолеобразующие оксиды не образуют кислот, оснований и солей. Однако они могут проявлять окислительные и восстановительные свойства, так как атом неметалла, связанный с кислородом, находится в промежуточной степени окисления.
1. Восстановительные свойства:
2. Окислительные свойства:
(получение метанола из синтез-газа)
Особые свойства оксидов.
1. Разложение при нагревании некоторых оксидов:
2 HgO 2 Hg + O₂
2 Au₂O 4 Au + O₂
2 Ag₂O 4 Ag + O₂
2. Взаимодействие некоторых оксидов с солью:
 |
вытеснение нелетучим оксидом летучего из его соли |
Примеры реакций: SiO₂ + Na₂CO₃ –t→ Na₂SiO₃ + CO₂ ↑ ZnO + K₂CO₃ –t→ K₂ZnO₂ + CO₂ ↑ |
 |
образование летучего оксида (CO₂) |
P.S.: как правило, это реакции оксида кремния(IV) или амфотерного оксида с карбонатом.
3. Взаимодействие оксидов металлов, стоящих после алюминия, с восстановителями.
Восстановители: H₂, C, CO, Al, Mg, NH₃ (аммиак способен восстановить из оксидов металлы, стоящие только после водорода).
CuO + H₂ Cu + H₂O
FeO + C Fe + CO
MgO + CO Mg + CO₂
Cr₂O₃ + 2 Al 2 Cr + Al₂O₃
3 CuO + 2 NH₃ N₂ + 3 Cu + 3 H₂O
4. Диспропорционирование – окислительно-восстановительная реакция, в которой одно и тоже вещество является как окислителем, так и восстановителем.
NO2 – это единственный кислотный оксид, у которого нет кислоты, поэтому при взаимодействии с водой он диспропорционирует (образует как азотистую, так и азотную кислоту):
5. Сопропорционирование – окислительно-восстановительная реакция, в которой окислителем и восстановителем является один и тот же элемент, но в разных степенях окисления, а продуктом реакции является вещество, содержащее этот элемент в промежуточной степени окисления.
Необходимо запомнить всего лишь три реакции сопропорционирования:
CO₂ + C → CO
Fe₂O₃ + Fe → FeO
CuO + Cu → Cu₂O
6. Взаимодействие двойных оксидов с кислотой с образованием двух солей и воды:
Fe₃O₄ + 4 H₂SO₄ → FeSO₄ + Fe₂(SO₄)₃ + 4 H₂O
Задания:
1. Осуществи цепочку превращений:
C → CO₂ → Na₂CO₃ → CO₂ → CO → CH₃OH
Ответ:
С + O₂ → CO₂
CO₂ + 2 NaOH → Na₂CO₃ + H₂O (возможна реакция с Na₂O)
Na₂CO₃ + SiO₂ Na₂SiO₃ + CO2
CO₂ + C → 2 CO
CO + 2 H₂ CH₃OH
2. Среди предложенных реакций выбери те, которые протекают, и продолжи их:
а) K₂O + SO₃ →
б) Al₂O₃ + Na₂O →
в) Al₂O₃ + ZnO + H₂O →
г) CO + MgO →
д) BaO + KOH →
Ответ:
а) K₂O + SO₃ → K₂SO₄
б) Al₂O₃ + Na₂O → 2 NaAlO₂
в) Al₂O₃ + ZnO + H₂O –/→ (амфотерные оксиды не реагируют друг с другом)
г) CO + MgO → Mg + CO₂
д) BaO + KOH –/→ (основный оксид не реагирует с основанием)
Основные способы получения оксидов
Основные способы получения оксидов
В прошлой статье мы рассмотрели свойства оксидов, но как их получить? Я расскажу вам о двух методах: реакции окисления и реакции разложения. Но обо всем по порядку.
Реакции окисления
1. Окисление кислородом неметаллов с получением кислотных и несолеобразующих оксидов.
При взаимодействии неметалла с избытком кислорода образуется оксид в высшей степени окисления неметалла, а в случае недостатка кислорода степень окисления будет промежуточной. Например:
Однако сера всегда окисляется до промежуточной степени окисления (+4).
S + O₂ → SO₂
Для дальнейшего окисления требуется катализатор (V₂O₅) и нагревание:
2SO₂ + O₂ → 2 SO₃
В случае азота протекает обратимый процесс образования оксида азота (II) при нагревании до 3000 °C.
N₂ + O₂ 2 NO
Но помните, что таким способом нельзя получить оксиды галогенов.
2. Окисление кислородом металлов с получением основных и амфотерных оксидов.
С кислородом не образуют оксид: натрий (образует пероксид) и калий, рубидий, цезий, франций (образуют надпероксид). Никогда не реагируют с кислородом золото, платина и палладий.
2 Cu + O₂ 2 CuO
2 Al + 3 O₂ → 2 Al₂O₃
3 Fe + 2 O₂ → Fe₃O₄
3. Окисление кислородом сложных веществ.
Летучие водородные соединения неметаллов сгорают в кислороде с образованием оксида и воды:
2 H₂S + 3 O₂(изб) → 2 SO₂ + 2 H₂O
2 PH₃ + 4 O₂ → P₂O₅ + 3 H₂O
4 NH₃ + 3 O₂ → 2 N₂ + 6 H₂O, однако в присутствии катализатора реакция протекает с образованием других продуктов: 4 NH₃ + 5O₂ 4 NO + 6 H₂O
Большинство сульфидов окисляются кислородом с образованием двух оксидов:
2 ZnS + 2 O₂ 2 ZnO + SO₂
4FeS₂ + 11O₂ 2Fe₂O₃ + 8SO₂
Сильные кислоты-оксилители в реакциях с металлами и неметаллами образуют оксиды:
S + 6 HNO₃(конц) → 6 NO₂ + H₂SO₄ + 2 H₂O
Cu + 4 HNO₃(конц) → Cu(NO₃)₂ + 2 NO₂ + 2 H₂O
Cu + 2 H₂SO₄(конц) → CuSO₄ + SO₂ + 2 H₂O
Реакции образования малодиссоциирующих веществ также приводят к получению газообразного оксида.
Na₂CO₃ + 2 HCl → 2 NaCl + CO₂ + H₂O
K₂SO₃ + 2 HCl → 2 KCl + SO₂ + H₂O
4. Окисление озоном простых и сложных веществ.
Озон является более сильным окислителем, чем кислород. В связи с этим он способен окислять многие вещества и без нагревания.
4 Cu + 2 O₃ → 4 CuO + O₂
4P + 4 O₃ → 2 P₂O₅ + O₂
N₂ + O₃ → N₂O + O₂
H₂S + O₃ → SO₂ + H₂O
Реакции разложения
1. Разложение оснований
Большинство нерастворимых оснований при нагревании разлагаются на оксид и на воду.
2Fe(OH)₃ Fe₂O₃ + 3H₂O
Однако самопроизвольно разлагаются:
2AgOH → Ag₂O + H₂O
2CuOH → Cu₂O + H₂O
2. Разложение солей при нагревании
При нагревании солей происходит их разложение на оксиды без изменения степеней окисления.
(NH₄)₂CO₃ 2 NH₃ + CO₂ + H₂O
CaCO₃ CaO + CO₂
Однако в случае солей, которые образованы сильными кислотами, протекает окислительно-восстановительная реакция.
2 CuSO₄ 2 CuO + 2 SO₂ + O₂
Hg(NO₃)2 → Hg + O₂ + 2 NO₂
Угольная и сернистая кислоты разлагаются самопроизвольно.
H₂CO₃ → CO₂ + H₂O
H₂SO₃ → SO₂ + H₂O
Поэтому в продуктах реакции мы их никогда не пишем, а сразу записываем продукты их разложения. Например:
H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂
Азотная кислота при нагревании образует бурый газ:
4HNO₃ 2 H₂O + 4 NO₂ + O₂
Задания:
1. Вычеркни оксиды, которые нельзя получить взаимодействием простого вещества с кислородом: MgO, ZnO, SO₃, NO, P₂O₅, Cr₂O₃, CO, Au₂O, SO₂, K₂O, CuO, Na₂O.
Ответ: SO₃ – образуется только при каталитическом окислении SO₂.
Au₂O – золото не реагирует с кислородом.
K₂O – при взаимодействии калия с кислородом образуется надпероксид (KO₂).
Na₂O – при взаимодействии натрия с кислородом образуется пероксид (Na₂O₂).
2. Выбери вещества, разложением которых можно получить бурый газ:
а) Mg(NO₃)₂
б) КNO₃
в) Zn(NO₃)₂
г) AgNO₃
д) NH₄NO₃
е) Mn(NO₃)₂
Ответ: авге
а) 2 Mg(NO₃)₂ 2 MgO + 4 NO₂ + O₂
б) 2 КNO₃ 2 KNO₂ + O₂
в) 2 Zn(NO₃)₂ 2 ZnO + 4 NO₂ + O₂
г) 2 AgNO₃ 2 Ag + 2 NO₂ + O₂
д) NH₄NO₃ N₂O + 2 H₂O
е) Mn(NO₃)₂ MnO₂ + 2 NO2
Составление формул веществ. Степень окисления. Электроотрицательность.
Периодическая система элементов
Задание 41.
Исходя из положения германия и технеция в периодической системе, составьте формулы мета- и ортогерманиевой кислот, и оксида технеция, отвечающие высшей степени окисления. Изобразите формулы этих соединений, графически.
Решение:
Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д. И. Менделеева, в которой он находится. Германий и технеций находятся соответственно в IV и VII. Структура внешнего энергетического уровня германия 4s24p2, технеция 4d55s2, поэтому их оксиды с высшей степенью окисления соответственно имеют формулы GeO2, Te2O7.
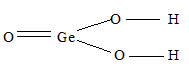
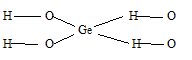
а) GeO2 – оксид германия (IV) является ангидридом ряда германиевых кислот, состав которых можно выразить общей формулой хGeO2 . yH2O, где х и у – целые числа:
1) х = 1, у = 1: GeO2 . Н2О или Н2GeO3 – метагерманиевая кислота, структурную формулу которой можно представить так:
2) х = 1, у = 2: GeO2. 2Н2О или Н4GeO4 – ортогерманиевая кислота, структурную формулу которой можно представить так:
б) Формула оксида технеция (VII) имеет вид: Te2O7. Структурная формула Te2O7:
Задание 42.
Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и р-элементов в группах периодической системы с увеличением порядкового номера? Почему?
Решение:
Энергия ионизации (I) – это энергия, необходимая для отрыва электрона от атома. Она измеряется в кДж/моль.
Поскольку при движении вниз по группам размеры атомов увеличиваются, внешние электроны находятся дальше от ядра, и энергия ионизации уменьшается, т. е. электроны будут легче отрываться (теряться) и, поэтому с увеличением порядкового номера s- и р-элементов в группах периодической системы восстановительные свойства будут увеличиваться. Все s-элементы – металлы, которые являются восстановителями, т. е. они всегда отдают электроны. Высокая их восстановительная способность проявляется в реакции их с водой, это касается металлов. У р-элементов с увеличением порядкового номера в группах периодической системы закономерно увеличиваются радиусы атомов, что приводит к закономерному увеличению восстановительных свойств. Например, эле-менты VII группы: F, Cl, Br, I. Электроотрицательность их закономерно уменьшается сверху вниз, т. е. наименьшей способностью отдавать электроны обладает фтор, наименьшей – йод. Так же закономерно уменьшаются стандартные электродные потенциалы.
Таким образом, у s- и р-элементов в группах восстановительная способность, т. е. способность элементов отдавать электроны закономерно увеличивается, а присоединять – уменьшается с возрастанием порядкового номера элемента. Связано это с увеличением заряда ядра атома и его радиуса.
Задание 43.
Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
Решение:
Электроотрицательность – это способность атома притягивать к себе электроны других атомов. Электроотрицательность не может быть выражена, измерена в единицах каких-либо физических единиц, поэтому для количественного определения электроотрицательности (ЭО) предложена шкала Полинга, по которой ЭО фтора принята равной 4,0.
Шкала ЭО Полинга в общих чертах напоминает периодическую систему Менделеева. Электроотрицательность р-элементов в периодах с увеличением порядкового номера элемента закономерно увеличивается, например от В к F соответственно 2,0 (В) и 4,0 (F). Объясняется это тем, что с ростом порядкового номера увеличивается заряд ядра атома, возрастает число электронов, всё это приводит к увеличению электростатического взаимодействия ядра и электронов, которое приводит к уменьшению размеров внешних орбиталей. В группах электроотрицательность элементов уменьшается сверху вниз. Объясняется это тем, что радиусы атомов с ростом порядкового номера элемента в подгруппе всегда увеличиваются из-за того, что с ростом номера элемента в подгруппе всегда увеличивается число экранирующих подуровней остова атома.
Задача 44.
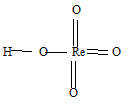
Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
Решение:
Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д. И. Менделеева, в которой он находится.
Германий, молибден и рений находятся соответственно в IVА-, VIВ- и VIIВ группах и имеют структуру внешнего энергетического уровня 4s24p2; 4d55s4 и 5d56s2. Высшая валентность германия равна 4, поэтому формула водородного соединения имеет вид: GeH4, а структурная формула будет иметь вид:
Высшая валентность молибдена равна 6. Формула оксида молибдена (VI) имеет вид: МоО3, структурная формула будет иметь вид:
Высшая валентность рения равна 7. Формула рениевой кислоты имеет вид: НReO4. Структурная формула имеет вид:
Задание 45.
Что такое сродство к электрону? В каких единицах оно измеряется? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
Решение:
Сродство к электрону – это энтальпия, поглощаемая 1 моль электронов для появления ионов данного элемента. Сродство к электрону измеряется в кДж/моль. Окислительная активность неметаллов (способность принимать электроны) в группе с увеличением по-рядкового номера элементов уменьшается, потому что с ростом заряда элемента растёт и радиус атома. Всё это приводит к уменьшению сродства к электрону у атомов элементов данной группы. Например, атомы фтора и хлора соответственно имеют следующие электронные конфигурации (Не)2s22p5 (r = 0,072нм) и (Ne)3s23p5 (r = 0,099нм). Атому фтора будет легче присоединять электрон, чем атому хлора.
В периодах окислительная активность неметаллов будет увеличиваться с увеличением порядкового номера элемента, так как будет уменьшаться радиус атомов с увеличением заряда ядра. Например, атом серы и хлора имеет следующие электронные конфигурации (Ne)3s23p4; (Ne)3s23p5. Имея семь электронов на внешнем энергетическом уровне, больше на один, чем атом серы и, соответственно больший радиус заряд ядра, чем у атома серы. Поэтому атом хлора будет иметь меньший размер атома (r = 0,099нм), чем атом серы (r = 0,104нм). Исходя из этого, атом хлора будет легче присоединять электроны, чем атом серы, т. е. хлор будет проявлять окислительные способности, чем сера.
Задание 46.
Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основный характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
Решение:
Формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления имеют вид:
N2O – оксид натрия; NaOH – гидроксид натрия;
MgO – оксид магния; Mg(OH)2 – гидроксид магния;
Al2O3 – оксид алюминия; Al(OH)3 – гидроксид алюминия;
SiO2 –оксид кремния (IV); H2SiO3 – кремневая кислота;
P2O5 – оксид фосфора (V); H3PO4 – ортофосфорная кислота;
SO3 – оксид серы (VI); H2SO4 – серная кислота;
Cl2O7 – оксид хлора (VII); HClO4 – хлорная кислота.
Основные свойства гидроксидов при переходе от натрия к хлору ослабевают, а кислотные – усиливаются. Это связано с тем, что в периоде с увеличением порядкового номера радиусы атомов элементов и их ионов закономерно уменьшаются, наблюдается увеличение эффективного заряда атома, увеличение электроотрицательности элемента.
Гидроксид алюминия проявляет как и сам элемент, амфотерные свойства, т. е. он способен реагировать как с кислотами, так и с основаниями:
Формула оксидов.
Формула оксидов необходима для возможности решения задач и понимания возможных вариантов соединений химических элементов. Общая формула оксидов — ЭхОу. Кислород находится на втором месте после фтора по величине значение электроотрицательности, что является причиной того, что большинство соединений химических элементов с кислородом являются оксидами.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
- Основный оксид + сильная кислота → соль + вода: CuO + H2SO4 → CuSO4 + H2O
- Сильноосновный оксид + вода → гидроксид: CaO + H2O → Ca(OH)2
- Сильноосновный оксид + кислотный оксид → соль: CaO + Mn2O7 → Ca(MnO4)2
- Основный оксид + водород → металл + вода: CuO + H2 → Cu + H2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды – оксиды неметаллов и металлов в степени окисления +5 — +7. Могут реагировать с водой, щелочами, основными оксидами, амфотерными оксидами. Элемент кислотного оксида входит в состав аниона образующейся соли. Mn2O7, CrO3, SO3, N2O5.
- Кислотный оксид + вода → кислота: SO3 + H2O → H2SO4. Некоторые оксиды, к примеру SiO2, не могут вступать в реакцию с водой, поэтому их кислоты получают не прямым путём.
- Кислотный оксид + основный оксид → соль: CO2 + CaO → CaCO3
- Кислотный оксид + основание → соль + вода: SO2 + 2NaOH → Na2SO3 + H2O. Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей: Ca(OH)2 + CO2 → CaCO3 ↓ + H2O, CaCO3 + H2O + CO2 → Ca(HCO3)2
- Нелетучий оксид + соль 1 → соль 2 + летучий оксид: SiO2 + Na2CO3 → Na2SiO3 + CO2
- Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1: 2P2O5 + 4HClO4 → 4HPO3 + 2Cl2O7
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
- Na2O – оксид динатрия;
- CO – монооксид углерода;
- СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
Источник статьи: http://www.calc.ru/Formula-Oksidov.html
Высшие оксиды: классификация, формулы и их свойства
Каждый школьник встречался с понятием «оксид» на уроках химии. От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.
Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой. Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).
- С кислотами: CaO (окисел кальция) + H2SO4 (серная кислота) = CaSO4 (сульфат кальция или гипс) + H2O .
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.
Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Источник статьи: http://fb.ru/article/409697/vyisshie-oksidyi-klassifikatsiya-formulyi-i-ih-svoystva
Как написать формулу высшего оксида
Порядок составления формул оксидов
Формулы оксидов можно составлять по правилу креста:

Далее необходимо:
1. расставить степени окисления (с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2 (минус два) .
2 . Для того чтобы правильно определить степень окисления. второго элемента необходимо познакомится с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
Возможные степени окисления N (азот) -3, 0, +1, +2, +3, +4,+5. P (фосфор) -3, 0, +3, +5. S (сера) -2, 0, +4, +6. C (углерод) -4, 0, +2, +4.
Степень окисления «0» — ноль имеют:
1. Простые вещества: Н2, Са, О2 …
2. Сложные в-ва (в сумме): Са +2 О -2 (+2 – 2 =0)
Степень окисления со знаком + характерна для элементов которые отдают свои электроны в соединениях другим атомам или от которых оттянуты общие электронные пары, т.е.атомы менее электроотрицательных элементов. например металлы всегда имеют положительную степени окисления.
Подсказка : Узнать степени окисления для металлов можно в таблице «растворимости. » . В ней представлены заряды ионов металлов они обычно совпадают со степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее электроотрицательный, чем сам кислород см. таблицу электроотрицательности.

Составим формулу оксида натрия :
По таблице растворимости заряд иона натрия + , соответственно степень окисления натрия имеет значение +1 ( Na +1 ), с.о. кислорода в оксидах всегда -2.
Натрий имеет положительный заряд, значит, его ставим первым, а вторым ставим кислород и по правилу креста получим: Na 2 +1 O -2 или Na2O .
Правило наименьшего общего кратного это способ наиболее универсальный для составления формул. Как им пользоваться рассмотрим на примере.
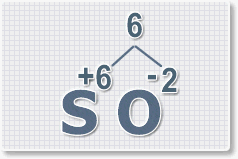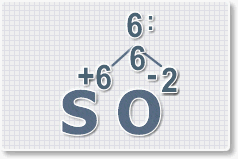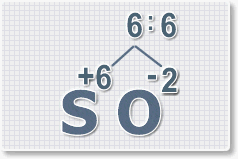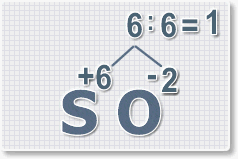
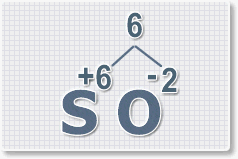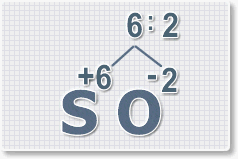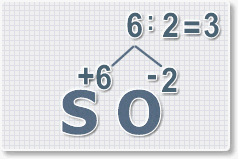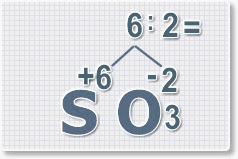
Составить формулу оксида серы (VI) .
1. У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а первым элементом будет сера ее с.о. указана в названии оксида VI, т. е +6. S +6 O -2 .
2. Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3. Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
6 : 6 = 1 это индекс для серы. Индексы со значением 1 в формулах не ставятся.
6 : 2 = 3 это индекс для кислорода
В результате получим формулу оксида серы (VI):
Источник статьи: http://osievskaja.narod.ru/klass/oksid/oksid_formula.html
Лабораторный опыт №2. Моделирование построения Периодической системы Д. И. Менделеева.
Смоделируйте построение Периодической системы Д. И. Менделеева. Для этого подготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20-й. На каждой карточке укажите следующие сведения об элементе: химический символ, название, относительную атомную массу, формулу высшего оксида, гидроксида (в скобках укажите их характер – основный, кислотный или амфотерный), формулу летучего водородного соединения (для неметаллов).
Перемешайте карточки, а затем расположите их в ряд по возрастанию относительных атомных масс элементов. Сходные элементы с 1-го по 18-й расположите друг под другом: водород над литием и калий под натрием, соответственно, кальций под магнием, гелий под неоном. Сформулируйте выявленную вами закономерность в виде закона. Обратите внимание на несоответствие относительных атомных масс аргона и калия их расположению по общности свойств элементов. Объясните причину этого явления.
| Химический символ | Название | Относительная атомная масса | Формула высшего оксида | Формула высшего гидроксида | Формула летучего водородного соединения |
|---|---|---|---|---|---|
| H | Водород | 1 | H2O | H2O | |
| He | Гелий | 4 | |||
| Li | Литий | 7 | Li2O (основный) |
LiOH (основный) |
|
| Be | Бериллий | 9 | BeO (амфотерный) |
Be(OH)2 (амфотерный) |
|
| B | Бор | 11 | B2O3 (кислотный) |
H3BO3 (кислотный) |
BH3 |
| C | Углерод | 12 | CO2 (кислотный) |
H2CO3 (кислотный) |
CH4 |
| N | Азот | 14 | N2O5 (кислотный) |
HNO3 (кислотный) |
NH3 |
| O | Кислород | 16 | H2O | ||
| F | Фтор | 19 | HF | ||
| Ne | Неон | 20 | |||
| Na | Натрий | 23 | Na2O (основный) |
NaOH (основный) |
|
| Mg | Магний | 24 | MgO (основный) |
Mg(OH)2 (основный) |
|
| Al | Алюминий | 27 | Al2O3 (амфотерный) |
Al(OH)3 (амфотерный) |
|
| Si | Кремний | 28 | SiO2 (кислотный) |
H2SiO3 (кислотный) |
SiH4 |
| P | Фосфор | 31 | P2O5 (кислотный) |
H3PO4 (кислотный) |
PH3 |
| S | Сера | 32 | SO3 (кислотный) |
H2SO4 (кислотный) |
H2S |
| Cl | Хлор | 35.5 | Cl2O7 (кислотный) |
HClO4 (кислотный) |
HCl |
| Ar | Аргон | 40 | |||
| K | Калий | 39 | K2O (основный) |
KOH (основный) |
|
| Ca | Кальций | 40 | CaO (основный) |
Ca(OH)2 (основный) |
Объяснение несоответствия относительных атомных масс аргона и калия.
Относительные атомные массы химических элементов это средние значения атомных масс изотопов элемента с учетом их долей содержания в природе.
Содержание в природе изотопа 39 K значительно больше, чем изотопа 40 K, поэтому среднее значение относительной атомной массы калия приближается к 39.
Содержание в природе изотопа 40 Ar значительно больше, чем изотопа 39 Ar, поэтому среднее значение относительной атомной массы аргона приближается к 40.
Калий является щелочным металлом, а аргон – инертным газом, поэтому аргон был расположен перед калием, т. е. в VIIIА группе, а калий – в IА группе.
Источник статьи: http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/lab/2.html
.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1

формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» –
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице “растворимости…“.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.
рис.2

окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
Рис.3
6 : 2 = 3
это индекс для кислорода
Рис.4
В результате получим
формулу оксида серы (VI):
* * *