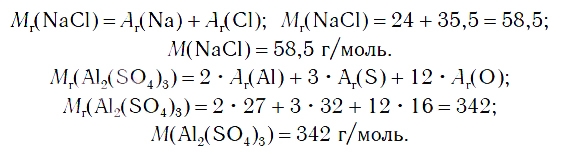Правила
составления формул основных солей по
названию.
Пример
1.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксохлорид
железа
(III)FeOHCl
Приставка
ГИДРОКСО означает, что соль основная,поэтому,
в составе – одна ОН группаНазвание
ХЛОРИД означает, что это соль солянойкислоты,
поэтому, в составе кислотного остатка
Cl
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( – 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксохлорид
железа
(III)+3
-1 -1FeOHCl
Валентность
железа равна III ( указано в названии
),поэтому,
заряд атома железа равен ( + 3 )Валентность
кислотного остатка Cl
равна
I , т.к. в НCl один атом водорода, поэтому,
заряд хлора равен ( – 1 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть – металл с ОН группой;
вторая часть – кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группа+3
-1(
FeOH )Заряд
первой части равен:+3
+ (-1) = +2+3
-1 -1FeOHCl
+2
-1Вторая
часть: кислотный остаток(
Cl )Заряд
второй части равен: -1
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа(
FeOH )Заряд
первой части равен:+3
+ (-1) = +2У
группы FeOH индекс1
не пишем+3
-1 -1FeOHCl2
+2
+ (-2) = 0Вторая
часть: кислотный остаток ( Cl )Для
равенства зарядов у кислотногоостатка
Cl пишем индекс: 2Заряд
второй части равен:-1
•
2 = – 2
¾
12 ¾
Пример
2.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидроксохлорид
железа
(III)Fe(OH)2Cl
Приставка
ДИГИДРОКСО означает, что соль
основная,и
в её составе – две ОН группы“ДИ”
означает ДВЕ ( две ОН группы )Название
ХЛОРИД означает, что это соль солянойкислоты,
поэтому, в составе кислотного остатка
группа Cl
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( – 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидроксохлорид
железа
(III)+3
-1 -1Fe(OH)2Cl
Валентность
железа равна III ( указано в названии
),поэтому,
заряд атома железа равен ( + 3 )Валентность
кислотного остатка Cl
равна
I , т.к. в НCl один атом водорода, поэтому,
заряд хлора равен ( – 1 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть – металл с ОН группой;
вторая часть – кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группы+3
-1(
Fe(OH)2
)Заряд
первой части равен:+3
+ ( -1 •
2
) = +1+3
-1 -1Fe(OH)2Cl
+1
-1Вторая
часть: кислотный остаток(
Cl )Заряд
второй части равен: -1
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа+3
-1(
Fe(OH)2
)Заряд
первой части равен:+3
+ ( -1 •
2
) = +1+3
-1 -1Fe(OH)2Cl
+1
+ ( -1 ) = 0Вторая
часть: кислотный остаток ( Cl )Заряд
второй части равен:-1
•
1 = – 1Заряды
частей равны, поэтому, индексы ставить
не надо, т.к. формула составлена.
¾
13 ¾
Пример
3.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксокарбонат
меди
(II)СuOHCO3
Приставка
ГИДРОКСО означает, что соль основная,поэтому,
в составе – одна ОН группаНазвание
КАРБОНАТ означает, что это соль
угольнойкислоты,
поэтому, в составе кислотного остатка
группа CО3
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( – 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксокарбонат
меди
(II)+2
-1 -2СuOHCO3
Валентность
меди равна II ( указано в названии ),поэтому,
заряд атома меди равен ( + 2 )Валентность
кислотного остатка CО3
равна
II , т.к.в
Н2CО3
два атома водорода, поэтому, заряд
CО3равен
( – 2 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть – металл с ОН группой;
вторая часть – кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группа+2
-1(
СuOH )Заряд
первой части равен:+2
+ (-1) = +1+2
-1 -2CuOHCO3
+1
-2Вторая
часть: кислотный остаток(
CO3
)Заряд
второй части равен: -2
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа(
CuOH )Заряд
первой части равен:+2
+ (-1) = +1У
группы CuOH запишите индекс 2+2
-1 -2(СuOH)2CO3
+1
+ (-2) = -1Вторая
часть: кислотный остаток ( Cl )Заряд
второй части равен:-1
•
2 = – 2У
кислотного остатка CO3индекс
1 не пишем
¾
14 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» – краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
–
HCl соляная
кислота Cl хлорид
–
HF фтороводородная
кислота F фторид
–
HBr бромоводородная
кислота Br бромид
–
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
–
HNO3
азотная кислота NO3 нитрат
–
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
–
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты H3PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте H2CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в H2CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в H2CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Кислые соли. Номенклатура
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты H2SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, поэтому добавляем «гидро»),
NaH2PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль. Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных – частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. Номенклатура
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты H2SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
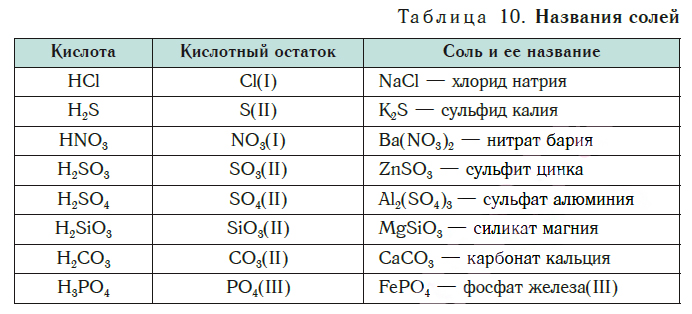
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.