Определение валентности химического элемента по формуле его соединения
Суммы единиц валентности каждого элемента в формуле бинарного соединения равны.
Пример:
определим валентность хлора в его соединении с кислородом —
Cl2O7
.
1. Записываем известную валентность кислорода над формулой. Неизвестную валентность обозначаем буквой (x):
2. Находим сумму единиц валентности каждого элемента. Для этого его валентность умножаем на число атомов:
3. Вычисляем (x):
2x=14,x=14:2=7.
Валентность хлора равна
VII
:
Составление формулы бинарного соединения по валентностям химических элементов
Если известны валентности двух элементов, то можно составить формулу их соединения.
Пример:
составим формулу соединения алюминия с углеродом, валентность которого равна
IV
.
1. Записываем символы химических элементов рядом. Указываем над ними валентности. Валентность алюминия постоянная и равна
III
.
2. Находим наименьшее общее кратное валентностей, записываем его над формулой.
Наименьшее общее кратное равно
3⋅4=12
.
3. Делим НОК на валентность каждого элемента:
12:3=4,12:4=3.
Получаем индексы в формуле соединения:
Вы знаете, чем простые вещества отличаются от сложных? Напомню, что молекулы простых веществ состоят из атомов одного вида (сера S, золото Au, кислород O2), а сложные – из атомов разных видов (вода Н2О, фосфорная кислота Н3РО4, этиловый спирт С2Н5ОН). Тут резонно задать вопросом, а почему атомы не соединятся один с одним, ведь так всё будет гораздо проще, мы получим вещества с формулами вида НО, HS, CaOH и так далее. Но это решительно невозможно потому, что в дело вступает валентность.
Напомню, что валентность – это способность атома образовывать химическую связь. Вот представьте, что атом водорода хочет соединиться с атомом кислорода (это будет вода). И тут проблема:
водород всегда имеет валентность I, а кислород всегда имеет валентность II.
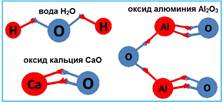
Это означает, что один атом водорода может образовать только одну связь и не больше. А атому кислорода подавай две и не меньше! Как же быть? А давайте-ка одному предложим соединиться с двумя атомами водорода. Это будет выглядеть так: Н-О-Н. Здесь тире означает ту самую химическую связь. И, как видно из этой простой схемы, все счастливы: каждый атом водорода получил одну связь, а единственный атом кислорода радостно образовал две. Таким образом, формула воды Н2О.
Перед тем, как мы начнём тренироваться, нужно запомнить две принципиально важные вещи. Мы их рассмотрим на примере оксида алюминия:
1. Валентность пишется над знаком элемента и всегда римскими цифрами. Валентность никогда не может быть дробной, это всегда целое число. Просто потому, что атома связаны одной, двумя, тремя связями. Атомы не могут быть связаны полутора, двумя с половиной или тремя четвертями связей.
2. Рядом со знаком элемента внизу справа находится индекс. Это важно запомнить! Индекс (он пишется привычной арабской цифрой) показывает, сколько атомов данного вида входит в молекулу. В нашем примере мы видим, что в молекуле оксида алюминия имеется два атома алюминия (справа внизу от знака алюминия цифра 2) и три атома кислорода (справа внизу от знака кислорода цифра 3). Индекс всегда целое число! Потому что в молекулу не может входит половина атома или полтора атома. Представьте для наглядности, что молекула – это семья, где есть родственники. В семье же не может быть две с половиной бабушки или полтора брата. По крайней мере, я таких не видела.
А теперь тренировка
Учитель химии просит
составить формулу вещества, при этом валентность атомов известна.
Напомню, что некоторые атомы, склонные к постоянству, всегда имеют одинаковую валентность. Она определяется группой, в которой атом стоит в таблице Менделеева. Так, металлы основной подгруппы первой группы всегда имеют валентность I, второй – II, третьей – III. Элементы основной подгруппы седьмой группы имеют валентность I (пока просто запомните это). Итак, нам нужно составить формулу оксида натрия. Сразу понимаем, что молекула состоит из атомов натрия и кислорода. Записываем это: NaO. Теперь вспоминаем про валентность (без неё никак): натрий – элемент основной подгруппы первой группы, имеющий валентность I, кислород тоже постоянен в привычках и имеет валентность II. Записываем и это:
Обратите внимание, что пока индексы обозначены X и Y, ведь мы же их не знаем. Репетитор по химии расскажет, что нужно найти наименьшее кратное и будет говорить всякие другие страшные слова, но мы будем действовать проще. Поставьте валентность по диагонали, превратив их в арабские цифры:
Смотрите, что произошло. Валентность кислорода II. Мы превращаем её в арабскую 2 и переносим по диагонали к натрию. Валентность натрия I. Мы превращаем её в арабскую 1 и переносим к кислороду. Вы скажете, что справа внизу от кислорода нет никаких единиц, в чём дело? А дело в том, что если в молекуле уже есть атом, то понятно, что он есть и он один. Мы же в формуле указали, что кислород присутствует, значит, он и есть в единственном числе. Таким образом формула оксида натрия Na2О.
Другой случай. Нам нужна формула оксида цинка. Кислород с валентностью II встречается с цинком, который тоже всегда имеет валентность II. Это идеальная пара, смотрите:
Цинк образует две связи и кислород образует две связи, значит, им больше ничего не нужно, эти два атома свяжутся друг с другом с помощью двух связей. Не надо ничего переносить по диагонали, достаточно понять, что если валентности равны, то атомы соединяются один к одному, то есть формула оксида цинка ZnO.
Теперь разберём пример посложнее. В учебнике химии задание: составить формулу оксида железа (III). Обратите внимание, что тут указана валентность железа. Так пишут в случае, когда элемент может обладать разной валентность. Например, желез может быть двухвалентным или трёхвалентным. Чтобы было понятно, о каком именно идёт речь, валентность указывают в скобках. Итак, действуем привычным способом:
Что мы видим? Валентности, увы, разные, следовательно атомы не соединяются один к одному. Тогда без колебаний действуем как в первом примере: используем перенос по диагонали. Валентность железа III превращаем в арабскую 3 и приписываем справа внизу к кислороду. Валентность кислорода II превращаем в арабскую 2 и приписываем внизу справа к железу. Вуаля!
Вот так симпатично и выглядит оксид железа (III) Fe2О3!
Продолжаем. Хотите узнать формулу оксида серы (VI)? Это просто. Давайте сразу запишем:
Тут придётся слегка напрячься. По идее мы можем сделать перенос по диагонали и получить формулу S2О6. Но это неверно, будьте внимательны! Дело в том, что в такой куче получается слишком много атомов, а ведь их можно просто уменьшить в два раза, получив более простую (и правильную!) формулу SО3.
Ну и в заключение ещё один пример, который может встретиться в контрольной по химии. Как выглядит оксид азота (V)? Азот, кстати, тоже любит хулиганить и выступать с разной валентностью. Конкретно в этом случае у него валентность V. Думаю, теперь уже без заумных пояснений понятно, что формула будет такой:
Ура!
Но спешу вас немного огорчить: пока мы натренировались составлять формулы, если известна валентность. В следующий раз мы будет решать обратную задачу: зная формулу, будем определять валентность. Это уже гораздо проще, так что готовьте чай и печеньки.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Урок №13. Составление химических формул по валентности
Cоставление
бинарных формул
по валентностям химических элементов
|
Бинарная |
||
|
ОКСИДЫ |
СУЛЬФИДЫ |
ХЛОРИДЫ |
|
Оксид – это сложное вещество, в состав которого входят два вида K2О |
Сульфид – это сложное вещество, в состав которого входят два вида Na2S |
Хлорид – это сложное вещество, в состав которого входят два вида FeCl3 |
|
Общая формула где Э – элемент; Х – валентность элемента |
Общая формула где Э – элемент; Х – валентность элемента |
Общая формула где Э – элемент; Х – валентность элемента |
Пример -анимация
Задание – Алгоритм
Составьте бинарные формулы соединений по их названиям: Оксид калия, сульфид алюминия, хлорид меди (II)
Решение:
|
Действие |
Примеры |
||
|
1.Записать символы |
Оксид натрия NaO |
Сульфид алюминия AlS |
Хлорид железа (II) FeCl |
|
2. Проставить значения валентностей над элементами |
I II Na O |
III II Al S |
II I Fe Cl |
|
3. Найти наименьшее кратное для валентностей элементов |
1·2=2 |
3·2=6 |
2·1=2 |
|
4. Путём деления кратного на значения валентностей, находим индексы элементов |
2 : 2 : Na2O |
6 : 6 : Al2S3 |
2 : 2 : Fe Cl2 |
Запомните!
Особенности составления химических формул соединений.
1) Низшую
валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева
правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в
соединении с кислородом сера проявляет высшую валентность VI, а кислород –
низшую II. Таким образом, формула оксида серы будет SO3.
В соединении
кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую
IV. Значит, формула – SiC. Это
карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом
металла стоит в формуле на первое место.
2) В
формулах соединений атом неметалла, проявляющий низшую валентность, всегда
стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl
– хлорид натрия, PbS – сульфид свинца.
Теперь вы
сами можете написать формулы любых соединений металлов с неметаллами.
3) Атом металла ставится в формуле на первое место.
Задания для закрепления
Тренажер 1
Тренажер 2
№1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III IV III II I III
Li O Ca O P O PbO N H MnO Fe O H S N O Cr Cl
№2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) меди и хлора,
3) натрия и брома,
4) калия и серы.
№3.
Составьте бинарные формулы :
А) азот и кислород;
Б) железо и хлор;
В) литий и сера.
№4.
Составьте формулы веществ по их названиям:
оксид серы (IV) , хлорид железа (II), сульфид углерода, оксид азота (III), оксид азота (IV), х
лорид серы (IV), сульфид углерода
№5.
Вычислите относительные молекулярные массы веществ
Al2S3, Fe Cl2 по их химическим формулам.
Содержание:
- § 1 Валентность химических элементов
- § 2 Определение валентности по формулам соединений
- § 3 Составление химических формул по валентности
- § 4 Определение названия вещества по химической формуле
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
Если сравнить между собой формулы таких веществ, как вода H2O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia – «сила») – свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей – валентных возможностей.
Например, водород – одну, кислород и кальций – по две, алюминий – три, углерод – четыре, фосфор – пять, сера – шесть, хлор – семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.
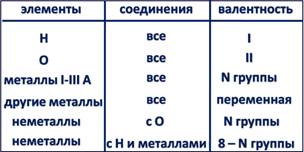
Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая – разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная – 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая – в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую – соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.
Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента – фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
2. 2×3=6;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества – оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента – низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.
Определим формулу оксида серы:
1. записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях – два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
Путешествие в
страну Неорганию
Тема: Составление
химических формул соединений по валентности элемента
Цель урока: научить школьников составлять формулы бинарных соединений по
валентности.
Задачи:
Образовательные:
- опираясь на знания учащихся, повторить понятия «тело», «вещества»,
«чистое вещество, смеси», «атом», «молекула», «простое и сложное
вещество», «химическая формула”, «валентность»; - способствовать формированию у учащихся умения составлять химические
формулы по валентности элемента; - акцентировать внимание школьников на возможности интеграции курсов
химии, математики.
Развивающие:
- продолжить формирование умений формулировать определения;
- разъяснять смысл изученных понятий, объяснять последовательность
действий при определении валентности по формулам веществ и составлении
химических формул соединений по валентности элемента; - способствовать обогащению словарного запаса, развитию эмоций,
творческих способностей; - развивать умение выделять главное, существенное, сравнивать,
обобщать, развивать дикцию, речь.
Воспитательные:
·
воспитывать чувство
товарищества, умение работать коллективно;
·
повысить уровень
эстетического воспитания учащихся;
·
ориентировать учащихся на
здоровый образ жизни.
Планируемые результаты обучения:
- Учащиеся должны уметь составлять химические формулы по валентности
элементов в бинарных соединениях; - Уметь разъяснять последовательность действий при составлении
химических формул по валентности элементов.
Организационные формы: беседа, индивидуальные задания, самостоятельная
работа.
Средства обучения: алгоритм определения валентности по формулам веществ
и составления химических формул соединений по валентности элемента
Демонстрационное оборудование: презентация
Оборудование для учащихся: на каждом столе «Алгоритм определения валентности», «Алгоритм
составления химических формул по валентности».
Ход урока
I.
Ориентировочно-мотивационный этап.
Слайд
1. Психологическая разминка
Учитель.
Добрый
день,
юные мыслители! Я рада видеть ваши умные и добрые лица! Нам предстоит очень
необычная работа. И я даже слегка волнуюсь: а все ли задуманное
осуществится. Для этого мне понадобиться ваша помощь. Я готова начать
работу и надеюсь на ваше сотрудничество и творческий подход к делу. Вы готовы? На внутренней
стороне обложки тетради у вас приклеена табличка с шестью лицами – определите
своё эмоциональное состояние. Было бы замечательно, если бы к концу урока
каждому удалось переместить галочку хотя бы на одну клеточку влево. Для этого
нужно задуматься над вопросами: может ли человек полюбить не очень интересный
ему учебный предмет? Что для этого нужно сделать? Девиз урока: «Спрашивайте
и отвечайте – это девиз познания и учения».
|
|
Рис. Определи свое эмоциональное состояние |
Слайд
2.Учитель. Сегодня урок
пройдет в виде теоретического похода, из которого вам необходимо принести как можно
больше трофеев (оценок). Страну Неорганию населяет более 100 тысяч
жителей – неорганических соединений. На вашем пути встретятся и реки, и густые
леса, и горы. Поэтому путешествие будет тяжелым, необходимо использовать всю
вашу сноровку, умственные способности, знания, полученные на предыдущих уроках.
Но я думаю, что все вы не растеряетесь и благополучно вернетесь из похода не с
пустыми рюкзаками. Прежде чем отправиться в путь, мы должны
сделать разминку, ведь путь очень долгий.
Химическая
разминка
·
Разноуровневые задания
по пройденным темам
Слайд
3.1.Игра
«Крестики и нолики» Выигрышный путь составляют атомы:
|
Na |
CaO |
CuO |
|
FeO |
AgCl |
Si |
|
S |
Ca |
K |
Слайд 4.2.Найдите «лишнее вещество», т.е. такое,
которое не образует с остальными однородную группу: N2 SO2 Ba O2 P2O5 N2O5 ( Ва – атом
среди молекул)
Слайд
5.3.Найдите
«лишнее вещество», т.е. такое, которое не образует с остальными однородную
группу: O2 Н2
СО К Li Ca (CО – сложное
вещество, среди простых)
Учитель. Ну а теперь нам необходимо проверить вашу готовность к путешествию и
собрать вещи. Кто быстрее соберет рюкзак?
Слайд
6.4.Выбери
названия тел: алюминий, пластмасса, стакан, стекло, тетрадь,
книга, ручка, дерево, линейка.
Слайд
7.5.
Выбери чистые вещества: воздух, серебро, морская вода, сахар,
золото, кислород, нефть, медь, туман.
Слайд
8.Учитель: Итак, в путь.
На нашем пути – речка. Чтобы перебраться через нее, необходимо
построить мост из досточек, которые образуются из соотношения
химического символа элемента, его произношения и названия. Главное –
не промочить ноги.
Слайд
9. 6.
Установи соответствие между химическим символом элемента, его произношением и
названием элемента
|
Cu |
Феррум |
Серебро |
|
Pb |
Силициум |
Золото |
|
Hg |
Плюмбум |
Медь |
|
Fe |
Аурум |
Кремний |
|
Au |
Аргентум |
Железо |
|
Si |
Цэ |
Ртуть |
|
Ag |
Гидраргирум |
Свинец |
|
C |
Купрум |
Углерод |
Слайд 10.Учитель. Через речку мы перебрались, а дальше густой лес. Чтобы
найти тропинку необходимо произнести волшебные слова – прочитать
формулы веществ.
Слайд
11.7.
Как произносятся формулы следующих веществ? CuO, ZnO, P2O5,
NO2 , SO3 , Al2O3, Н2О, SO2.
Слайд
12.Учитель. Молодцы, тропинку
мы нашли. Осталось только пройти через лес, а для этого необходимо произвести
расчёты, чтобы не заблудиться.
II. Индивидуальная работа по карточкам двух учащихся по теме
“Относительная молекулярная масса” (Выполняют решение на доске, остальные в
тетради). Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных
веществ: NaCl, K2O.
Справочные данные:
- Аr (Na) = 23
- Аr (Cl) = 35,5
- Аr (K) = 39
- Аr (O) = 16
Карточка № 2. Рассчитайте относительную молекулярную массу данных
веществ: CuO, SO2.
Справочные данные:
- Аr (Cu) = 64
- Аr (O) = 16
- Аr (S) =3 2
Учитель. Если вы
легко смогли выполнить все задания, скажите себе: «Я – молодец!»
Физминутка
А теперь все тихо встали,
Дружно руки вверх
подняли,
В стороны, вперед,
назад,
Повернулись
вправо, влево,
Тихо сели, вновь
за дело.
II. Операционно-исполнительный этап.
Актуализация опорных знаний
Слайд 13.Учитель. Осталось нам преодолеть гору. Перед началом подъема вспомните, что до сих пор мы пользовались готовыми химическими
формулами. Какие закономерности учитываются при составлении химических формул,
которым подчиняются элементы, соединяясь между собой? Как называется эта
закономерность? (валентность).
Учитель. Дайте
определение валентности.
Валентность – это свойство атомов удерживать
определённое число других атомов в соединении.
Учитель. Как обозначается валентность? (Валентность обозначается римскими цифрами)
Учитель. Какие виды валентности вы знаете? (постоянная и переменная)
Учитель. Чему равна валентность водорода? кислорода? ( I, II)
Учитель. Какое
правило вы должны знать при определении валентности атомов элементов в
соединениях? (Правило определения валентности: число единиц
валентностей всех атомов одного элемента равно числу единиц валентности всех
атомов другого элемента).
Слайд 14.Учитель. Перед трудным подъёмом в гору, давайте сделаем ещё одну разминку.
Упражнение: определить валентность элементов в
веществах (тренажёр: ученики цепочкой выходят к доске). SiH4, CrO3, H2S, CO2,
SO3, Fe2O3.
Слайд
15.Учитель. Как вы
думаете, зачем нам необходимо знать валентность элементов? (чтобы составлять
химические формулы соединений). Запишем тему урока в тетрадь. Какую цель мы
поставим перед собой?
Слайд
16-19.Учитель. Чтобы
преодолеть нашу гору без травм, вы должны пройти инструктаж, как составлять
химические формулы по валентности элемента. Для этого удобно воспользоваться
следующей таблицей.
Объяснение
учителя.
Алгоритм составления химической формулы по
валентности элемента.
|
Алгоритм составления формулы по валентности |
Пример |
||
|
1. Запиши рядом знаки химических элементов, |
В О |
||
|
2. Над знаками химических элементов поставь |
III II В О |
||
|
3. Определи Н.О.К (наименьшее общее кратное |
6 III II В О |
||
|
4. Раздели Н.О.К. на валентность каждого |
6 III II В О 6: III= 2 6:II=3 6 III II В2 О3 |
||
|
5. Сделайте проверку, то есть подсчитайте |
6 III II В2 О3 ( 6=6) |
||
Слайд 20.Учитель. А теперь начинаем наше восхождение. Если у вас возникнут трудности, то у вас есть подсказка ( алгоритм).
Упражнение: составить химические формулы по
валентности элементов (тренажёр: ученики цепочкой выходят к доске).
Задание в рабочей тетради ( стр. 16 – 17. Упражнение № 49,50 б )
III. Оценочно-рефлексивный этап.
Слайд 21. Учитель. Молодцы. Мы благополучно добрались до места назначения. А
теперь привал. Нам
необходимо подкрепиться, каждый вправе выбрать блюдо на свой вкус.
ü
Слайд 22.Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по
выбору. Выбирайте только то задание, с которым вы справитесь.
Репродуктивный уровень (“3”). Составьте химические формулы по
валентности элементов: N
H (III), AlO (III), CH (IV), CuO (II).
Прикладной уровень (“4”). Составьте формулы оксидов: Mn (
VII), Fe
(III) , Cr (VI), Cu (I), К (I).
Творческий уровень (“5”). Исправьте ошибки, допущенные в
некоторых формулах:
AlO3, BO3, NaO, КО.
ü
Слайд 23.Работа над ошибками. Ответы
Репродуктивный уровень (“3”).
NH3, AL2O3, CH4, CuO.
Прикладной уровень (“4”).
Mn2O7, Fe2O3 , CrO3, Cu2O,
K2O.
Творческий уровень (“5”).
Al2O3, B2O3, Na2O, К2О.
IV.
Подведение
итогов урока
Учитель. Все путешественники собрали хорошие знания в свои рюкзаки и
заслуживают отличных оценок и наград. Оцените своё эмоциональное состояние в конце урока.
Объявить
оценки за урок отвечавшим ученикам, поблагодарить всех за работу на уроке.
Провести оценку эмоционального состояния по шкале (см. рис.). Учитель еще раз
напоминает вопросы, над которыми необходимо подумать для эффективной работы на
следующем уроке.
- Что нужно знать, чтобы составить химическую формулу вещества?
- Как можно найти число атомов в биэлементных соединениях, если
валентности элементов известны? - Как проверить правильность составленной формулы биэлементных
соединений?
Слайд
24.Учитель: Во время
путешествия к вашим рюкзакам прицепились паразиты. Необходимо будет
от них избавиться, выполнив домашнее задание.
Домашнее задание: § 12. РТ стр. 16-17 ( упр. 50а, 51,52)
Учитель. Благодарю за урок. До свидания.
3. Самостоятельная работа учащихся в
тетрадях.
Задача информационно-вычислительного
характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике
кариеса можно сравнить по содержанию в них активного фтора, способного
взаимодействовать с зубной эмалью. Зубная паста “Crest” (производство США)
содержит, как указано на упаковке, SnF2, а зубная паста “FM extra
DENT” (производство Болгария) содержит NaF. Вычислите, какая из этих двух паст
более сильнодействующее средство для профилактики кариеса.
Проверка: один учащийся
устно читает решение.
Валентность.
Составление химических формул
по валентности
8 класс
Тип урока. Комбинированный.
Методы обучения. Частично
поисковый, репродуктивный, программированный опрос, беседа с элементами лекции.
Эпиграф к уроку. «Всякое вещество
– от самого простого до самого сложного – имеет три различные, но взаимосвязанные
стороны: свойства, состав, строение…» (Б.М.Кедров).
Цели. Дидактическая: рассмотреть
понятие «валентность» как атомность элемента, познакомить учащихся с различными
видами валентности (высшей и низшей, переменной и постоянной).
Психологическая: вызвать интерес к предмету, выработать умение
логически рассуждать, грамотно выражать свои мысли.
Воспитательная: развивать умение работать коллективно,
оценивать ответы своих товарищей.
Оборудование. Модели молекул воды,
углекислого газа, наборы для построения моделей молекул различных веществ,
индивидуальные карточки для проверки домашнего задания и самостоятельной работы
учащихся в группе, таблички-анаграммы для химической разминки, шкала для
определения эмоционального состояния ученика.
ХОД УРОКА
Ориентировочно-мотивационный
этап
Психологическая
разминка
Цель разминки – определить эмоциональное состояние учащихся. У
каждого ученика на внутренней стороне обложки тетради приклеена табличка с
шестью лицами – шкала для определения эмоционального состояния (рис.). Каждый
ученик ставит галочку под той рожицей, чье выражение отражает его настроение.
|
|
Рис. Определи свое эмоциональное
|
Учитель. Было бы
замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы
на одну клеточку влево.
Для этого нужно задуматься над вопросами: может ли человек
полюбить не очень интересный ему учебный предмет? Что для этого нужно сделать?
Химическая
разминка
Разминку готовят и проводят ученики.
Ученик. Анаграммы –
это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из
химических анаграмм. Переставьте буквы в каждом слове и получите название
химического элемента. Обратите внимание на подсказку.
«Одоврод» – у этого элемента самая маленькая относительная
атомная масса.
«Маилинюй» – этот элемент называют «крылатым» металлом.
«Тьурт» – содержится в медицинском градуснике.
«Цалький» – без него наши кости были бы непрочными и
хрупкими.
«Росфоф» – веществом, состоящим из атомов этого элемента,
была намазана шерсть собаки Баскервилей.
Учитель. Если вы
легко разгадали слова-анаграммы, скажите себе: «Я – молодец!»
Химические знаки
и химические формулы
(Проверка домашнего задания)
Индивидуальная работа у
доски по карточкам.
К а р т о ч к а
1
(примерные
задания для карточек)
Задание 1. Разгадай загадку:
«И графит я, и алмаз,
В организме есть у вас,
Хоть в печах меня и жгут –
Черным золотом зовут!»
Задание 2. Ответь на вопросы.
1. Какой химический знак имеет этот
элемент?
2. К металлам или неметаллам он
относится?
3. Какова его относительная атомная
масса?
4. Рассчитай массовую долю этого
элемента в соединении ЭО2.
Цифровой
диктант
Контроль за выполнением диктанта учащиеся осуществляют методом
взаимопроверки.
Задание. Напротив
правильных утверждений поставьте цифру 1, напротив неверных – 0.
1. Химический элемент – это определенный вид атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо обозначения
и названия элемента, записаны два числа: верхнее – относительная атомная масса
элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в честь Франции.
4. В таблице Д.И.Менделеева элементы располагаются, как
правило, в порядке убывания их атомных масс.
5. Значения относительной атомной массы и массы атома,
выраженной в а. е. м., никогда не совпадают численно.
6. Простыми называют вещества, состоящие из атомов одного
элемента.
7. Индекс – это число, показывающее количество взятых частиц
(атомов или молекул) вещества.
8. Массовая доля элемента показывает, какую часть (долю)
составляет масса данного элемента от всей массы вещества.
9. Относительная молекулярная масса воды Н2О равна
20.
10. Массовая доля кальция в оксиде кальция СаО составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4
– 0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
Операционно-исполнительный
этап
Учитель. Вы
знаете, что химические формулы веществ показывают количественные соотношения, в
которых атомы соединяются между собой, вы также научились рассчитывать массовую
долю элемента по химической формуле вещества. Например, в воде Н2О на один атом кислорода приходится два атома
водорода, или 11% Н и 89% О. В углекислом газе СО2
на один атом углерода приходится два атома кислорода. (демонстрация
моделей молекул данных веществ.)
Валентность
Учитель. Валентность
– это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один
атом другого одновалентного элемента (HF, NaCl). С
атомом двухвалентного элемента соединяются два атома одновалентного (H2O)
или один атом двухвалентного (CaO). Значит, валентность элемента можно
представить как число, которое показывает, со сколькими атомами одновалентного
элемента может соединяться атом данного элемента.
Правила
определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с
формулой воды Н2О к одному атому кислорода присоединено два атома
водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому
углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Учитель. Как
определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна
номеру группы.
У неметаллов в основном проявляются две валентности: высшая
и низшая (схема).
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в
таблице) и номером группы, в которой находится данный элемент.
Учитель. Например:
сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет
валентности V и III.
Валентность может быть постоянной (у элементов главных
подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп
в таблице), но с этим явлением вы познакомитесь чуть позже, а если
интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять
химические формулы соединений. Для этого удобно воспользоваться следующей
таблицей.
Таблица
Алгоритм составления
формулы соединения Р и О
|
Последовательность |
Составление формулы |
|
1. Написать символы элементов |
Р О |
|
2. Определить валентности элементов |
V II |
|
3. Найти наименьшее общее кратное численных значений |
5•2 = 10 |
|
4. Найти соотношения между атомами элементов путем деления |
10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
|
5. Записать индексы при символах элементов |
Р2 О5 |
|
6. Формула соединения (оксида) |
Р2О5 |
Учитель. Запомните
еще два правила для составления химических формул соединений неметаллов между
собой.
1) Низшую валентность проявляет тот элемент, который
находится в таблице Д.И.Менделеева правее и выше, а высшую валентность –
элемент, расположенный левее и ниже. (Демонстрация
таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую
валентность VI, а кислород – низшую II. Таким образом, формула оксида серы
будет SO3.
В соединении кремния с углеродом первый проявляет высшую
валентность IV, а второй – низшую IV. Значит, формула
– SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую
валентность, всегда стоит на втором месте, а название такого соединения
оканчивается на «ид».
Например, СаО – оксид кальция, NaCl
– хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений
металлов с неметаллами.
Самостоятельная
работа
Текст работы заранее написан на доске. Двое учащихся решают
задание на обратной стороне доски, остальные в тетрадях.
Задание 1. Проверьте,
правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3,
Mg3N2, MgO.
Задание 2. Напишите формулы
соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором,
натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями,
происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради,
похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего
ошибок.
Закрепление
изученного материала
Беседа с
учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными
значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле их соединения
занимает 1-е место, а какой –
2-е? Поясните на примере оксида NO2, используя таблицу
Д.И.Менделеева.
Творческая работа
в группах
Задание. Используя наборы
для составления моделей молекул различных веществ, составьте формулы и модели
молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о
выполненном задании и вместе с классом приводит анализ ошибок.
Задание на дом. По учебнику
«Химия-8» Л.С.Гузея: § 3.1, задания № 3, 4, 5, с. 51. Желающие могут
подготовить сообщения о французском ученом Ж.Л.Прусте и английском ученом
Дж.Дальтоне.
Рефлексивно-оценочный
этап и подведение итогов урока
Объявить оценки за урок отвечавшим ученикам, поблагодарить
всех за работу на уроке. Провести оценку эмоционального состояния по шкале (см.
рис.). Учитель еще раз напоминает вопросы, над которыми необходимо подумать для
эффективной работы на следующем уроке.
Л и т е р а т у р а
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия-8, М.: Дрофа, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем
химию. М.: Просвещение, 1988; Букреева Р.В., Быканова Т.А. Уроки новых
технологий по химии. Воронеж, 1997.