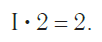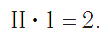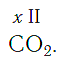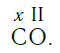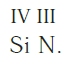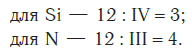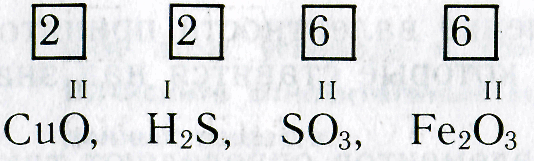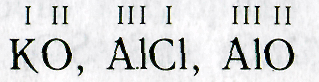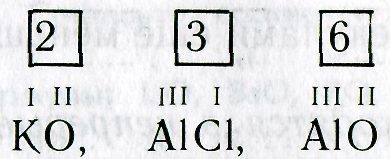В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
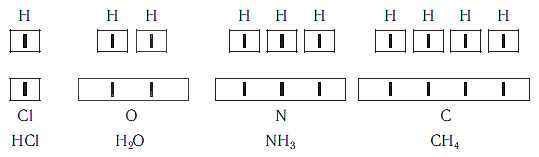
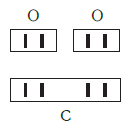
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Содержание
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
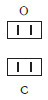
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
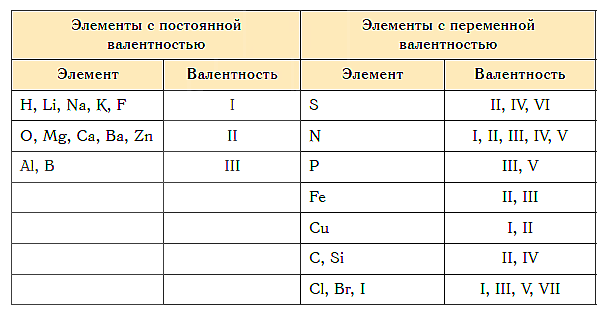
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
План урока:
Валентность
Причины постоянной и переменной валентности
Правила определения степени окисления
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Рассмотрим металлы, расположенные в I группе. Их объединили в одно семейство щелочных металлов, поскольку реагируя с водою, они все образуют щёлочи, состава МеОН. Формула внешнего уровня имеет вид ns1. Если провести параллель с элементами конструктора, то они будут выглядеть следующим образом.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
Вспоминаем, что элементы этой группы имеют формулу ns2, приходим к тому, что валентность атомов численно равна II.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Источник
Поиграем с Вами в старую добрую игру «Найди … отличий». Несмотря на то, что они находятся в одной группе, имеют общую формулу внешнего слоя ns2np5, валентность их будет отличаться. Атомы хлора выигрывают за счёт свободного 3d уровня, на который при определённых условиях могут мигрировать электроны с наружного слоя, образуя при этом 3 возбуждённых состояния. Атом фтора в этом плане бедный, в распоряжении его электронов нет d-орбитали, его электронам некуда мигрировать.Поэтому имея только 1 неспаренный электрон, может образовать только единственную связь.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Источник
Определение валентности элементов по формулам
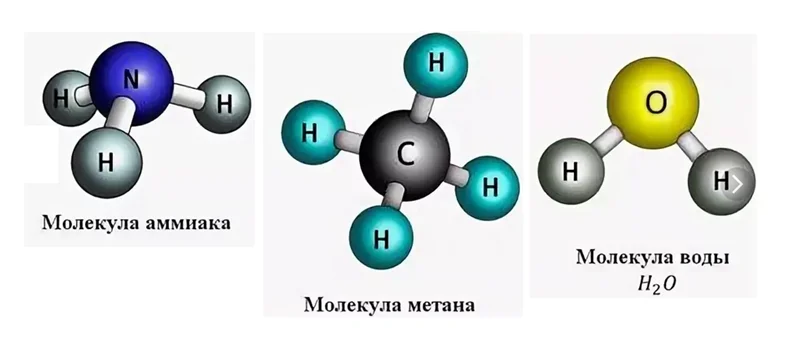
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
В противовес металлам существует один-единственный элемент, который абсолютно ни с кем не хочет делиться своими электронами.Ни при каких условиях он не отдаст их, это фтор, который всегда отрицателен F−.
Такой элемент, как кислород, обычно имеет отрицательный заряд, это -2. И только с фтором, он будет положительным +2.
Аналогичная ситуация с водородом, характерная СО (степень окисления) +1, однако исключения составляют соединения с металлами, где его степень окисления будет отрицательная и равняется -1.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
Источник
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
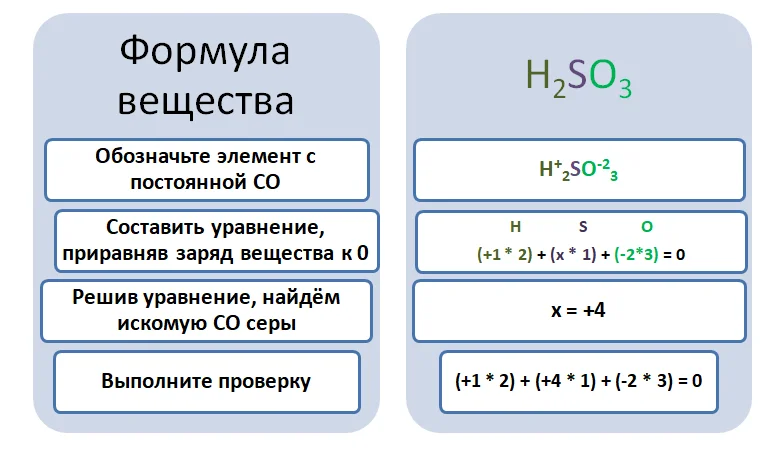
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Как правило, валентность и степень окисления совпадают по абсолютной величине. Но исключения составляют простые вещества, например, в простом веществе азот, формула которого N2, степень окисления равняется 0, в тоже время, валентность атомов азота равна III. N0 ≡ N0.
Либо в катионе аммония NH4+. Азот имеет СО -3, а валентность IV.
Вы знаете, чем простые вещества отличаются от сложных? Напомню, что молекулы простых веществ состоят из атомов одного вида (сера S, золото Au, кислород O2), а сложные – из атомов разных видов (вода Н2О, фосфорная кислота Н3РО4, этиловый спирт С2Н5ОН). Тут резонно задать вопросом, а почему атомы не соединятся один с одним, ведь так всё будет гораздо проще, мы получим вещества с формулами вида НО, HS, CaOH и так далее. Но это решительно невозможно потому, что в дело вступает валентность.
Напомню, что валентность – это способность атома образовывать химическую связь. Вот представьте, что атом водорода хочет соединиться с атомом кислорода (это будет вода). И тут проблема:
водород всегда имеет валентность I, а кислород всегда имеет валентность II.
Это означает, что один атом водорода может образовать только одну связь и не больше. А атому кислорода подавай две и не меньше! Как же быть? А давайте-ка одному предложим соединиться с двумя атомами водорода. Это будет выглядеть так: Н-О-Н. Здесь тире означает ту самую химическую связь. И, как видно из этой простой схемы, все счастливы: каждый атом водорода получил одну связь, а единственный атом кислорода радостно образовал две. Таким образом, формула воды Н2О.
Перед тем, как мы начнём тренироваться, нужно запомнить две принципиально важные вещи. Мы их рассмотрим на примере оксида алюминия:
1. Валентность пишется над знаком элемента и всегда римскими цифрами. Валентность никогда не может быть дробной, это всегда целое число. Просто потому, что атома связаны одной, двумя, тремя связями. Атомы не могут быть связаны полутора, двумя с половиной или тремя четвертями связей.
2. Рядом со знаком элемента внизу справа находится индекс. Это важно запомнить! Индекс (он пишется привычной арабской цифрой) показывает, сколько атомов данного вида входит в молекулу. В нашем примере мы видим, что в молекуле оксида алюминия имеется два атома алюминия (справа внизу от знака алюминия цифра 2) и три атома кислорода (справа внизу от знака кислорода цифра 3). Индекс всегда целое число! Потому что в молекулу не может входит половина атома или полтора атома. Представьте для наглядности, что молекула – это семья, где есть родственники. В семье же не может быть две с половиной бабушки или полтора брата. По крайней мере, я таких не видела.
А теперь тренировка
Учитель химии просит
составить формулу вещества, при этом валентность атомов известна.
Напомню, что некоторые атомы, склонные к постоянству, всегда имеют одинаковую валентность. Она определяется группой, в которой атом стоит в таблице Менделеева. Так, металлы основной подгруппы первой группы всегда имеют валентность I, второй – II, третьей – III. Элементы основной подгруппы седьмой группы имеют валентность I (пока просто запомните это). Итак, нам нужно составить формулу оксида натрия. Сразу понимаем, что молекула состоит из атомов натрия и кислорода. Записываем это: NaO. Теперь вспоминаем про валентность (без неё никак): натрий – элемент основной подгруппы первой группы, имеющий валентность I, кислород тоже постоянен в привычках и имеет валентность II. Записываем и это:
Обратите внимание, что пока индексы обозначены X и Y, ведь мы же их не знаем. Репетитор по химии расскажет, что нужно найти наименьшее кратное и будет говорить всякие другие страшные слова, но мы будем действовать проще. Поставьте валентность по диагонали, превратив их в арабские цифры:
Смотрите, что произошло. Валентность кислорода II. Мы превращаем её в арабскую 2 и переносим по диагонали к натрию. Валентность натрия I. Мы превращаем её в арабскую 1 и переносим к кислороду. Вы скажете, что справа внизу от кислорода нет никаких единиц, в чём дело? А дело в том, что если в молекуле уже есть атом, то понятно, что он есть и он один. Мы же в формуле указали, что кислород присутствует, значит, он и есть в единственном числе. Таким образом формула оксида натрия Na2О.
Другой случай. Нам нужна формула оксида цинка. Кислород с валентностью II встречается с цинком, который тоже всегда имеет валентность II. Это идеальная пара, смотрите:
Цинк образует две связи и кислород образует две связи, значит, им больше ничего не нужно, эти два атома свяжутся друг с другом с помощью двух связей. Не надо ничего переносить по диагонали, достаточно понять, что если валентности равны, то атомы соединяются один к одному, то есть формула оксида цинка ZnO.
Теперь разберём пример посложнее. В учебнике химии задание: составить формулу оксида железа (III). Обратите внимание, что тут указана валентность железа. Так пишут в случае, когда элемент может обладать разной валентность. Например, желез может быть двухвалентным или трёхвалентным. Чтобы было понятно, о каком именно идёт речь, валентность указывают в скобках. Итак, действуем привычным способом:
Что мы видим? Валентности, увы, разные, следовательно атомы не соединяются один к одному. Тогда без колебаний действуем как в первом примере: используем перенос по диагонали. Валентность железа III превращаем в арабскую 3 и приписываем справа внизу к кислороду. Валентность кислорода II превращаем в арабскую 2 и приписываем внизу справа к железу. Вуаля!
Вот так симпатично и выглядит оксид железа (III) Fe2О3!
Продолжаем. Хотите узнать формулу оксида серы (VI)? Это просто. Давайте сразу запишем:
Тут придётся слегка напрячься. По идее мы можем сделать перенос по диагонали и получить формулу S2О6. Но это неверно, будьте внимательны! Дело в том, что в такой куче получается слишком много атомов, а ведь их можно просто уменьшить в два раза, получив более простую (и правильную!) формулу SО3.
Ну и в заключение ещё один пример, который может встретиться в контрольной по химии. Как выглядит оксид азота (V)? Азот, кстати, тоже любит хулиганить и выступать с разной валентностью. Конкретно в этом случае у него валентность V. Думаю, теперь уже без заумных пояснений понятно, что формула будет такой:
Ура!
Но спешу вас немного огорчить: пока мы натренировались составлять формулы, если известна валентность. В следующий раз мы будет решать обратную задачу: зная формулу, будем определять валентность. Это уже гораздо проще, так что готовьте чай и печеньки.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Валентность
– число, которое показывает, со сколькими одновалентными атомами может сочетаться атом данного элемента или соединения; сколько таких атомов он может заместить. Валентность характеризует способность атома образовывать определенное количество химических связей , которая может быть связана со способностью атомов отдавать или присоединять определенное число электронов .
Степени валентности элемента является количество атомов водорода (или другого одновалентного элемента), которую атом данного элемента может присоединить или заместить. Так, в соединениях HCl, H 2 O
и хлор является одновалентным, кислород – двухвалентным, а азот – трехвалентным, ибо они соединены соответственно с одним, двумя и тремя атомами водорода.
Валентность химического элемента можно определять не только по формуле его соединения с водородом, но и с другими элементами, валентность которых известна. Например, в соединениях NaCl, MgCl 2 и AlCl 3 натрий является одновалентным, магний – двухвалентным, а алюминий – трехвалентным, ибо они соединены соответственно с одним, двумя и тремя атомами одновалентного хлора.
Некоторые элементы имеют постоянную валентность, а некоторые – переменную. Например, Водород , Натрий и Калий в своих соединениях бывают только одновалентные, Кальций , Барий , Магний , Цинк и Кислород – только двухвалентные, а Бор и Алюминий – только трехвалентный. Большинство химических элементов имеют переменную валентность. Так, медь может быть одновалентная (CuCl) и двухвалентного (CuCl 2), железо – двухвалентное (FeCl 2) и трехвалентное (FeCl 3), углерод – двухвалентный (CO) и четырехвалентный (CO 2), сера – четырехвалентный (SO 2) и шестивалентного (SO 3) и т. д.
Что касается природы валентности, то есть природы тех сил, которые обусловливают собой химическую связь атомов в молекулах, то она долгое время оставалась неизвестной. Только когда стала известна строение атомов, появились теории, которые объясняли причину различной валентности химических элементов и природу химической связи их атомов. Важнейшими из этих теорий является теория о електровалентний, или ионный химическая связь и теория о ковалентная , или атомный, химическая связь.
1. Постоянная валентность
o H, F, Li, Na, K, Rb, Cs, Fr, Ag, I, Cl, Br – 1
o Be, Mg, Ca, Ba, Zn, Ra, Cd, Sr, В – 2
o С, Si – 4. Al, Cr, Bi – 3
2. Переменная валентность
o Fe, Co, Ni – 2 и 3
o Sn, Pb – 2 и 4
o Mn – 2, 3, 4, 5 и 7
o N – 2, 3, 4, 5
1
§ 11. Валентность химических элементов
Понятие о валентности.
Химические формулы можно вывести на основании данных о составе веществ. Однако
чаще всего при составлении химических формул учитываются закономерности, которым подчиняются химические элементы , соединяясь между собой. Чтобы понять сущность этих закономерностей, следует ознакомиться со свойством атомов, которое называется валентностью.
Рассмотрим химические формулы соединений некоторых элементов с водородом:
НС1 Н 2 О NH 3 СН 4
Хлороводород вода аммиак метан
Как видно из приведенных примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определенное число атомов водорода. Таким же свойством обладают и другие элементы в различных соединениях. Понятию «валентность» можно дать следующее определение:
Валентность – это свойство атомов химического элемента присоединять определенное число атомов других химических элементов.
Атомы водорода не могут присоединять более одного атома другого химического элемента, поэтому валентность водорода принята за единицу. Валентность же других элементов можно выразить числом , показывающим, сколько атомов водорода может присоединить к себе атом данного элемента. Например, в молекуле хлороводорода атом хлора присоединяет один атом водорода, следовательно, хлор одновалентен. Валентность кислорода равна двум, ибо его один атом присоединяет два атома водорода. Азот в молекуле аммиака трехвалентен, а углерод четырехвалентен. Это можно записать следующим образом:
(Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.)
Валентность элементов определяют также по кислороду, который обычно двухвалентен. Например, ртуть Hg и медь Сu образуют оксиды HgO и СuО. Так как кислород двухвалентен и в этих оксидах на один атом элемента приходится по одному атому кислорода , то ртуть и медь в этих соединениях двухвалентны.
Ответьте на вопросы 1-3 (с. 32).
§12. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Определение валентности элементов по формулам их соединений.
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Например, если дана формула оксида меди СuО, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится один атом меди. Следовательно, валентность меди тоже равна двум.
Несколько сложнее определить валентность по формулам соединений, образованных не одним, а несколькими атомами химических элементов. Например, чтобы определить валентность железа в оксиде железа Fe 2 O 3 , рассуждают так. Валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равно шести (2-3). Следовательно, шесть валентностей приходятся на два атома железа , а на один атом железа приходятся три единицы валентности (6:2).
При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
Итак, валентность элементов по формулам можно определить следующим образом:
1
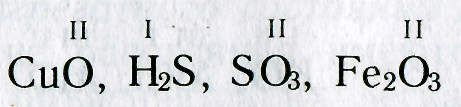
2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента:
3
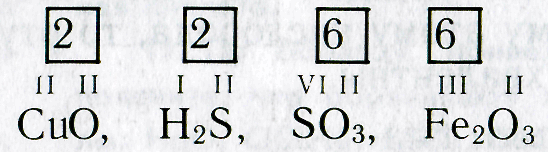
Составление химических формул по валентности.
Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице 3.
Таблица 3. Валентность некоторых элементов в химических соединени
| Валентность | Химические элементы | Примеры формул соединений |
| С постоянной валентностью |
||
| I | Н, Na, К, Li | Н 2 О, Na 2 O |
| II | О, Be, Mg, Ca, Ba, Zn | MgO, CaO |
| III | А1, В | А1 2 Оз |
| С переменной валентностью |
||
| Си | Cu 2 O, CuO | |
| II и III | Fe, Co, Ni | FeO, Fe 2 O 3 |
| II и IV | Sn, Pb | SnO, SnO 2 |
| III и V | Р | PH 3 , P 2 O 5 |
| II, III и VI | Cr | CrO, Сг 2 О 3 , СгОз |
| II, IV и VI | S | H 2 S, SO 2 , SO 3 |
При составлении химических формул можно соблюдать следующий порядок действий:
1. Пишут рядом химические знаки элементов, которые входят в состав соединения:
КО, А1С1, А1О
2. Над знаками химических элементов проставляют валентность:
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов:
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс «1» не пишут):
В названии веществ, образованных элементами с переменной валентностью , пишут в скобках цифру, показывающую валентность данного элемента в этом соединении. Например, СuО – оксид меди (II), Сu 2 О – оксид меди (I), и FeCl 2 – хлорид железа (II), FeCl 3 – хлорид железа (III).
Выполните упражнения 4-7 (с. 32-33). Решите задачи 1, 2 (с. 33).
§13. Атомно-молекулярное учение
Мы уже знаем, что многие вещества состоят из молекул, а молекулы – из атомов (с. 13-14). Сведения об атомах и молекулах объединяются в атомно-молекулярное учение. Вам известно, что основные положения этого учения были разработаны великим русским ученым М. В. Ломоносовым. С тех пор прошло более двухсот лет, учение об атомах и молекулах получило дальнейшее развитие. Так, например, теперь известно , что не все вещества состоят из молекул. Большинство твердых веществ, с которыми мы встретимся в курсе неорганической химии, имеют немолекулярное строение.
Однако
относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно.
Основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении.
Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
4. Между молекулами существуют силы взаимного притяжения и отталкивания.
В наибольшей степени эти силы выражены в твердых веществах , в наименьшей – в газах.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
8. У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток
(с. 14) находятся молекулы.
Связи между молекулами, расположенными в узлах кристаллической решетки , слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие ча
c
тицы
(с. 14). Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения.
Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии, знакомый вам из курса физики, объясняется способностью молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому , что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Ответьте на вопросы 8-12 (с. 33).
1. Что такое валентность химических эле ментов? Поясните это на конкретных примерах.
2. Почему валентность водорода принята за единицу?
3. В реакции железа с соляной кислотой один
атом металла вытесняет два атома водорода. Как это можно объяснить, пользуясь понятием о валентности?
4. Определите валентность элементов по формулам: HgO, K 2 S, B 2 O 3 , ZnO, МnО 2 , NiO, Сu 2 О, SnО 2 , Ni 2 O 3 , SO 3 , As 2 O 5 , CI 2 O 7 .
5. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы:
I II V IV I III VII II III II IV III I
LiO, ВаО, РО, SnO, КО, РН, MnO, FeO, BO, HS, NO, CrCI.
6. Пользуясь данными таблицы 3 (с. 30), составьте химические формулы соединений с кислородом следующих химических элементов: Zn, В, Be, Co, РЬ, Ni. Назовите их.
7. Составьте формулы оксидов: меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
8. Изложите сущность основных положений атомно-молекулярного учения.
9. Какие явления подтверждают: а) движение молекул; 6) наличие между молекулами промежутков?
10. Чем отличается движение молекул в газах, жидкостях, твердых веществах?
11. Чем отличаются по своим физическим свойствам твердые вещества с молекулярным и немолекулярным строением?
12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
1. Вычислите относительные молекулярные массы: а) оксида железа (III); б) оксида фосфора (V); в) оксида марганца (VII).
2. Определите массовые доли элементов в оксиде меди (I) и в оксиде меди (II). Найденные массовые доли выразите в процентах.
1. Что такое валентность химических эле- рода. Как это можно объяснить, пользуясь ментов? Поясните это на конкретных примерах. понятием о валентности?
2. Почему валентность водорода принята 4. Определите валентность элементов по за единицу? формулам: HgO, K 2 S, B2O3, ZnO, МпОг, NiO,
3. В реакции железа с соляной кислотой СигО, БпОг, N12O3, SO 3 , AS2O5, CI2O7.
один
атом металла вытесняет два атома водо- 5. Даны химические символы элементов и
Валентность
I
Вале́нтность (от лат. valentia – сила)
способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. – одно из фундаментальных понятий теории химического строения (см. Химического строения теория). Оно формировалось вместе с понятием химической связи, параллельно с развитием синтетической химии и методов исследования строения и свойств веществ, и его содержание неоднократно расширялось и изменялось по мере того, как экспериментальная химия находила всё новые и новые классы соединений с неизвестными ранее типами взаимодействия атомов в молекуле, а в последние 30-40 лет – с развитием квантовой химии. В настоящее время накопленный химией экспериментальный материал столь обширен и разнообразен, а картина химической связи в разных соединениях столь пестра, что задача нахождения последовательного, единого и всеобъемлющего определения В. представляется крайне сложной. Эти трудности побуждают некоторых химиков вообще отказаться от поисков универсального понятия В. и заменить его набором более узких, но зато более конкретных и более точных понятий (ковалентность, гетеровалентность, координационное число и т.д.), область применимости каждого из которых ограничена соединениями с каким-либо одним преобладающим типом взаимодействия (ковалентным, ионным, координационным и т.д.). Однако до настоящего времени и в специальной, и в учебной литературе В. продолжает широко использоваться и как определение способности атома к образованию связей в самом общем смысле слова, и как количественная мера этой способности, и как синоним предлагаемых более узких понятий.
Для отдельных классов соединений, где преобладает какой-либо один тип химического взаимодействия, полезную информацию о способности атомов к образованию связей могут дать перечисленные ниже частные понятия (частные определения В.).
1. Определение понятия «валентность» и связь его с другими понятиями химии
Ковалентность – мера способности атома к образованию ковалентных химических связей, возникающих за счёт двух электронов (по одному от каждого атома) и имеющих малополярный характер (см. Ковалентная связь (См. Купер)).
Ковалентность равна числу неспаренных электронов атома, участвующих в образовании связи, и часто может принимать все значения от 1 до максимальной, которая для большого числа элементов совпадает с номером их группы в периодической системе Менделеева (подробно см. разделы 2 и 3).
Гетеровалентность (употребляются также термины электровалентность и ионная валентность) – мера способности атома к образованию ионных химических связей, возникающих за счёт электростатического взаимодействия ионов, которые образуются при полном (или почти полном) переходе электронов одного атома к другому (см. Ионная связь). Гетеровалентность равна числу электронов, которые атом отдал или получил от другого атома, и совпадает с зарядом соответствующего иона (см. раздел 2).
Координационное число (КЧ) равно числу атомов, ионов или молекул, находящихся в непосредственной близости с данным атомом в молекуле, комплексном соединении или кристалле. В отличие от ковалентности и гетеровалентности, это понятие имеет чисто геометрический смысл и не зависит от характера связи между центральным атомом и лигандом. Так, например, КЧ атомов Al, Si, Р в комплексных ионах 3- , 2- , – равно 6, а КЧ атомов В, Xe, Ni в [ВН 4 ] – , ХеО 4 , Ni (CO) 4 равно 4. В кристалле NaCl каждый атом Na окружен шестью атомами Сl, так что КЧ Na равно 6. Величина КЧ может определяться как относительными размерами атомов, так и другими, более сложными причинами (см. разделы 2 и 3).
Окислительное число (ОЧ) (или степень окисления) – понятие, получившее в последнее время распространение в неорганической химии, – это электростатический заряд, условно приписываемый атому по следующим правилам. В ионных соединениях ОЧ совпадает с зарядом иона (например, в NaCl ОЧ Na равно +1, ОЧ Cl равно -1). В ковалентных соединениях ОЧ принято считать равным заряду, который получил бы атом, если бы все пары электронов, осуществляющие связь, были целиком перенесены к более электроотрицательным атомам (то есть если условно допустить, что связь имеет полностью ионный характер). Например, в HCl ОЧ Н равно +1, ОЧ Cl равно -1. В элементарных соединениях ОЧ равно 0 (например, в O 2 , Cl 2 , Р 4 , S 8 , в алмазе). При вычислении ОЧ в соединениях, где имеются два связанных атома одного элемента, их общую электронную пару принято делить пополам. Понятие ОЧ полезно при составлении уравнений окислительно-восстановительных реакций, для классификации неорганических и комплексных соединений и т.д.
Однако по своему определению ОЧ, в отличие от ковалентности и ионной В., имеющих чёткий физический смысл, носит в общем случае условный характер и, за исключением весьма ограниченного класса соединений с чисто ионной связью, не совпадает ни с эффективными зарядами атомов в соединениях, ни с фактическим количеством связей, которые атом образует. Кроме того, в ряде случаев, в частности, когда электроотрицательности двух разных связанных атомов близки и связь между ними имеет почти чисто ковалентный характер, возникает неопределённость, к какому из них следует целиком относить электронную пару (см. Окислительное число).
2. Эволюция понятия «валентность» и его роль в истории химии
В таком определении В., естественно, всегда выражается целыми числами. Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом Н был выбран в качестве стандарта, обладающего В., равной 1. В «водородной» шкале кислород и сера имеют В., равную 2, азот и фосфор 3, углерод и кремний 4. Однако «водородной» шкалы оказалось недостаточно: в других соединениях, например в окислах, один и тот же элемент может реализовать В., которые не осуществляются в гидридах (существуют окислы P 2 O 5 , SO 3 и Cl 2 O 7 , но неизвестны гидриды PH 5 , SH 6 и ClH 7). В качестве второго стандарта с В., равной 2, был выбран кислород.
Лит.:
Сыркин Я. К., Периодическая система и проблема валентности, М., 1971; Сыркин Я. К. и Дяткина М. Е., Химическая связь и строение молекул, М.-Л., 1946; Паулинг Л., Природа химической связи, пер. с англ., М. – Л., 1947; Шусторович Е. М., Новое в учении о валентности, М., 1968; Коулсон Ч., Валентность, пер. с англ., М., 1965: Маррел Д., Кеттл С., Теддер Д., Теория валентности, пер. с англ., М., 1968; Астахов К. В., Современное состояние периодической системы Д. И. Менделеева, М., 1969.
Первый камень преткновения изучающих химию. Большой ошибкой является подход, когда учащийся не пытается понять валентность, ожидая, что знания об этом потом приложатся сами собой. Но этот подход неверный, так как без понимания этого мы упираемся в тупик неспособности составить даже простейшую формулу.
Что такое «валентность» элементов?
Валентность – слово взятое учеными из латинского языка, что в переводе значит сила и возможность. Конечно, название неслучайно и может нам очень помочь в понимании сути термина. Ведь валентность характеризует атом с точки зрения его способности образовывать связи с другими атомами. Говоря иначе, валентность можно рассматривать, как возможность атома образовывать связи, благодаря которым появляются молекулы.
Обозначают валентность элемента
всегда только римскими цифрами. Посмотреть ее значение для разных атомов можно в специальной таблице.
Какие бывают характеристики у валентности элементов?
Все вещества, которые обладают валентностью, характеризуются тем, что она у них или постоянна (во всех связях), либо переменная. Постоянная валентность – характеристика очень небольшой группы веществ (водорода, фтора, натрия, калия, кислорода и др. Намного больше в мире атомов, которые обладают переменной валентностью. В разных реакциях, взаимодействуя с разными атомами, они становятся разновалентными. Например, азот в соединении NH3 имеет валентность – III, так как связан с тремя атомами, а в природе он бывает с валентность от одного до четырех. Еще раз повторю, что разная валентность – более распространенное явление.
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента
» пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Выглядит это так: используя знание, что валентность кислорода всегда равна двум, мы можем с легкостью высчитать валентность всего кислотного остатка. Например, в H 2 SO 3 валентность SO 3 – I, в HСlO 3 валентность СlO 3 – I.
Валентность элементов в формулах.
Как мы уже говорили выше, понятие «валентность элементов
» связанно с электронной структурой атома. Но это не единственный вид связи, которые существуют в природе. Химики знакомы еще с ионными, кристаллическими и другими формами структуры вещества. Для таких структур валентность уже не столь актуальна, но вот работая с формулами молекулярных реакций, мы обязательно должны ее учитывать.
Для того, чтоб сделать формулу мы должны расставить все индексы, которые уравновешивают количество атомов, вступающие в реакцию. Только зная валентность веществ, мы можем правильно расставить индексы. И наоборот, зная молекулярную формулу и имея индексы, можно узнать валентность элементов, что входят в состав вещества.
Для произведения подобных расчетов важно помнить, что валентности обоих элементов, вступивших в реакцию, будут равны, а значит, для поиска необходимо найти наименьшее общее кратное.
Например, возьмем, оксид железа. В химической связи у нас участвуют железо и кислород. В данной реакции у железа валентность равна III, а кислорода – II. Путем легких вычислений определяем, что наименьшее общее кратное – 6. А значит формула имеет вид Fe 2 O 3 .
Необычные способы определения валентности элементов.
Есть и более нестандартные, но интересные способы определения валентности вещества. Если хорошо знать свойства элемента, то определить валентность можно даже визуально. Например, медь. Ее оксиды будут красными и черными, а гидроксиды – желтыми и синими.
Наглядность.
Для того, чтоб валентность элемента
была более понятна рекомендуют писать структурные формулы . Создавая их, мы пишем условные обозначения атомов, а потом рисуем черточки, опираясь на валентность. Там каждая черточка обозначает связи каждого из элементов и получается очень наглядно.
Валентность – это способность химических элементов удерживать определенное количество атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
Спонсор размещения P&G
Статьи по теме “Как определить валентность”
Как доказать амфотерность гидроксидов
Как вычислить валентность
Как определить химическую формулу
Инструкция
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Примите к сведению, что валентность атомов одних элементов постоянна, а других – переменна, то есть, имеет свойство меняться. Например, водород во всех соединениях одновалентен, поскольку образует только одну связь. Кислород способен образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV или VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера – элемент с переменной валентностью.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в CaH2 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V – это валентность атомов элементов, а К – количество атомов в молекуле. С ее помощью легко определить показатель валентности любого элемента, если известны остальные данные.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Как просто
Другие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – H2SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Валентность – это способность атома присоединять другие атомные группы и отдельные атомы. Это важное понятие позволяет определить, сколько атомов того или иного вещества входит в формулу, и изобразить молекулу вещества графически. Вам понадобится таблица валентностей Спонсор размещения P&G Статьи
«Знание шрифтов – одно из самых элементарных требований, предъявляемых к сыщику!», – так наставлял когда-то великий Шерлок Холмс своего друга и летописца доктора Ватсона. Аналогично этому, можно смело сказать: «Знание того, как составляются химические формулы – одно из самых элементарных
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность химического элемента – это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Нужно помнить, что некоторые атомы одного и того же химического элемента могут иметь разную валентность в разных соединениях. Вам
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме “Что такое валентность” Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами
Как составлять химические формулы с элементами, у которых переменная валентность?
Ираида Женгова
Ученик
(96),
на голосовании
4 года назад
Как составить формулу, если у обоих элементов разные валентности? Например, SnCl2.
И как составить формулы, если у одного валентность известна, а у другого – нет? Например, в чём отличие между SO2 и SO3? По какому принципу идёт составление?
Голосование за лучший ответ
Александр Шеруда
Просветленный
(41481)
4 года назад
Очень просто.
Например, представьте мальчика, у которого две руки. Это Олово.
А теперь девочку, у которой волосы сплетены в косу. Это Хлор.
Очевидно, что такой мальчик может таскать за косы сразу двух девочек.
P.S. Валентности всех элементов известны и находятся по таблице тов. Менделеева.
Ираида ЖенговаУченик (96)
4 года назад
А если хлор проявляется в 4 валентностях и олово в 2? Вы как определили, что тут конкретно эти валентности?
Александр Шеруда
Просветленный
(41481)
не, хлор проявляется в 5 валентностях, это +7, +5, +3, +1 и -1. Он образует хлорную кислоту (где его валентность +7), хлористую (+5), хлорноватую (+3), хлорноватистую (+1) и внимание, солЯную (-1).
Формула соляной кислоты HCl. А SnCl2 это оловянная соль этой кислоты, хлорид олова. Известно ещё много таких солей, в каждой из которых атом хлора одновалентен. Отсюда мы делаем вывод, что с металлами атом хлора одновалентен. Вот и всё правило.
Также, все остальные галогены тоже одновалентны с металлами, потому что известно много их солей.
Далее аналогичная картина с оловом. Оно может иметь разную валентность, причём одна валентность проявляется с одним классом соединений, а с другим классом проявляется другая валентность. Приходится запомнить с какими какая.
Bolvar Fordragon
Гуру
(3390)
4 года назад
Все по названиям: хлористое олово – SnCl2, хлорное олово SnCl4. Еще могут указать в скобках валентность металла (если мы говорим о солях) – например хлорид олова (II) – SnCl2.
Теперь по хлору:
хлорид олова (II) – хлор имеет валентность 1 (степень окисления -1) SnCl2.
гипохлорит олова – хлор тоже имеет 1 (но степень окисления -1) – Sn(ClO)2
хлорат олова – хлор имеет валентность 5 – Sn(ClO3)2
перхлорат олова – хлор имеет валентность 7 – Sn(ClO4)2