Составьте формулы сульфатов − соединений с двухвалентной группой атомов $SO_{4}$ − следующих металлов: а) K; б) Mg; в) Al.
| Действие | Примеры | Примеры | Примеры |
|---|---|---|---|
| 1) Запишите рядом символы элементов | а) | б) | в) |
| 2) Над символами римскими цифрами укажите валентности элементов | |||
| 3) Найдите наименьшее общее кратное двух числовых значений валентности | |||
| 4) Определите индексы, разделив наименьшее общее кратное на числовые валентности каждого элемента |
Расположите данные сульфаты в порядке возрастания их Mr:
а) Mr ( _ ) =
б) Mr ( _ ) =
в) Mr ( _ ) =
Ответ:
reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §8. Часть I. Номер №5
Решение
| Действие | Примеры | Примеры | Примеры |
|---|---|---|---|
| 1) Запишите рядом символы элементов | а) $KSO_{4}$ | б) $MgSO_{4}$ | в) $AlSO_{4}$ |
| 2) Над символами римскими цифрами укажите валентности элементов | $overset{I}{K}$, $overset{II}{SO_{4}}$ | $overset{II}{Mg}$, $overset{II}{SO_{4}}$ | $overset{III}{Al}$, $overset{II}{SO_{4}}$ |
| 3) Найдите наименьшее общее кратное двух числовых значений валентности | 2 | 2 | 6 |
| 4) Определите индексы, разделив наименьшее общее кратное на числовые валентности каждого элемента | $K_{2}SO_{4}$ | $MgSO_{4}$ | $Al_{2}(SO_{4})_{3}$ |
Расположите данные сульфаты в порядке возрастания их Mr:
а) Mr ($K_{2}SO_{4}$) = 39 * 2 + 32 + 16 * 4 = 174
б) Mr ($MgSO_{4}$) = 24 + 32 + 16 * 4 = 120
в) Mr ($Al_{2}(SO_{4})_{3}$) = 27 * 2 + 32 * 3 + 16 * 4 * 3 = 342
Ответ: б, а, в
Описание презентации по отдельным слайдам:
-
1 слайд
Что такое соль?
14/06/22
Соли – сложные вещества, состоящие из атомов металла и кислотного остатка -
2 слайд
2. На второе место – кислотный остаток
Правила составления
формул солей:
1. На первое место в формуле соли пишется металл
3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислотеНитрат алюминия
Al
NO3
(
)
III
I
3 -
3 слайд
2. На второе место – кислотный остаток
Правила составления
формул солей:
1. На первое место в формуле соли пишется металл
3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислотеСиликат калия
K
SiO3
I
II
2 -
4 слайд
2. На второе место – кислотный остаток
Правила составления
формул солей:
1. На первое место в формуле соли пишется металл
3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислотеФосфат магния
Mg
PO4
II
III
3
2
(
) -
-
6 слайд
Соли серной кислоты называются – сульфаты
H2SO4
SO4
II
SO4
Ca
Na
SO4
Al
SO4
II
II
II
I
II
III
2
2
(
)
3
Сульфат
натрия
Сульфат
кальция
Сульфат
алюминия
14/06/22 -
7 слайд
Соли фосфорной кислоты называются – фосфаты
H3PO4
PO4
III
PO4
Ca
Na
PO4
Al
PO4
III
III
III
I
II
III
3
2
(
)
3
фосфат
натрия
фосфат
кальция
фосфат
алюминия
14/06/22 -
8 слайд
Соли угольной кислоты называются – карбонаты
H2СO3
СO3
II
СO3
Ca
Na
СO3
Al
СO3
II
II
II
I
II
III
2
карбонат
натрия
карбонат
кальция
карбонат
алюминия
14/06/22
(
)
2
3 -
Al2(SO4)3 — сульфат алюминия, неорганическое вещество из класса солей. Встречается в виде кристаллов или порошка белого цвета, хорошо растворяется в воде. Химически активное вещество, хорошо реагирует со многими компонентами, поэтому часто используется в опытах и задачах по химии, но для их решения нужно знать молярную массу Al2(SO4)3.
Относительная молекулярная масса сульфата алюминия — это объем одной отдельной молекулы этого вещества. Рассмотрим подробнее.
Показатель выражают в атомных единицах массы (а.е.м.). Ее легко высчитать при помощи периодической системы элементов Менделеева, зная формулу вещества.
Для этого нужно найти в таблице элементы, из которых состоит интересующее нас вещество, — алюминий, серу и кислород. Относительная масса одного атома алюминия составляет 26,992 а.е.м. (округляем до 27), атома серы 32,064 (округляем до 32), атома кислорода 15,999 (округляем до 16).
Формула молекулы сульфата алюминия на рисунке ниже. На нем виден состав молекулы, и сколько атомов каждого элемента участвует в образовании одной условной молекулы вещества.
Дальше нужно умножить массу одного атома алюминия на количество этих частиц в молекуле Al2(SO4)3. Это число указано нижним индексом справа от символа алюминия — 2. Умножаем 2 на 27, получаем 54 а.е.м.
Далее повторим действия с атомом серы. В состав молекулы сульфата алюминия входит три частицы (SO4), а значит три атома серы. Умножаем 32 на 3, получаем 96 а.е.м.
Такой же расчет производим с атомами кислорода. Сначала подсчитаем, сколько их входит в состав молекулы. В ней содержатся три частицы (SO4), то есть 12 атомов кислорода. Умножаем массу на количество атомов — 16 на 12, получаем 192 а.е.м.
54 + 96 + 192 = 342 а.е.м.
Итак, молекулярная масса алюминия сульфата составляет 342 а.е.м.
Молярная масса al2 so4 3 — это объем одного моля сульфата алюминия. Его очень легко узнать, так как он численно равен молекулярной массе, но выражается в других единицах измерения — г/моль.
Итак, молярная масса al2 so4 3 составляет 342 г/моль. Эта величина часто требуется для решения задач.
Для расчета этой величины нужно знать фактор эквивалентности. Он определяется по-разному для классов веществ.
Сульфат алюминия относят к группе средних солей. Для таких соединений фактор эквивалентности считается так:
Чтобы найти молярную массу эквивалента сульфата алюминия, умножим его молярную массу на фактор эквивалентности:
342 * 1 / 6 = 57 г/моль.
Итак, молярная масса эквивалента Al2 (SO4) 3 равна 57 г/моль.
Расчеты окончены, искомая величина определена.
Источник
Сульфат алюминия, характеристика, свойства и получение, химические реакции
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Сульфат алюминия – неорганическое химическое соединение, соль серной кислоты и алюминия .
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.) |
алюминий сернокислый (рус.) Тип вещества неорганическое Внешний вид бесцветные гексагональные кристаллы Цвет белый, бесцветный Вкус сладковато-терпкий Запах без запаха Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) твердое вещество Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 2710 Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 2,710 Температура разложения, °C 770 Температура плавления, °C 770 Молярная масса, г/моль 342,15 Гигроскопичность гигроскопичен Растворимость в воде (25 o С), г/100 г 38,5
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
- 1. взаимодействия сульфата меди и алюминия :
- 2. взаимодействия оксида алюминия и гидросульфата калия:
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
Химические свойства сульфата алюминия аналогичны свойствам сульфатов других металлов . Однако, сульфат алюминия не реагирует с кислотами. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия :
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия :
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития :
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
В результате реакции образуются сульфат бария и нитрат алюминия .
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия :
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия :
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
В результате реакции образуются сульфат натрия , гидроксид алюминия и оксид углерода (IV).
11. реакция термического разложения сульфата алюминия:
В результате реакции образуются оксид алюминия, оксид серы (IV) и кислород .
12. реакция термического разложения октадекагидрата сульфата алюминия:
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.
Источник
Сульфат алюминия
2,710 г/см 3 (безв.)
1,690 г/см 3 ( 18-водн. )
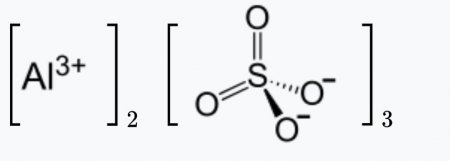
| Сульфат алюминия | |
|---|---|
 |
|
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Содержание
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см 3 , удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см 3 . При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Источник
1. KCl — хлорид калия
2. Na₂SO₄ — сульфат натрия
3. Cu(NO₃)₂ — нитрат меди-2
4. ZnF₂ — фторид цинка
5. CaBr₂ — бромид кальция
6. BaSO₃ — сульфит бария
7. Li₃PO₄ — ортофосфат лития
8. KClO₃ — хлорат калия
9. FeS — сульфид железа-2
10. MgI₂ — иодид магния
11. Ni(NO₂)₂ — нитрит никеля-2
12. NaClO₄ — перхлорат натрия
13. MnCl₂ — хлорид марганца-2
14. CuF — фторид меди-2
15. LiNO₃ — нитрат лития
16. ZnSO₃ — сульфит цинка
17. Cr₂(SO₄)₃ — сульфат хрома-3
18. CoS — сульфид кобальта
19. SrBr₂ — бромид стронция
20. CaI₂ — иодид кальция
0

























