Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июня 2020 года; проверки требуют 11 правок.
| Сульфат алюминия | |
|---|---|
 ![{displaystyle mathrm { ! {Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)  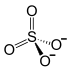 ![{displaystyle mathrm { ! {Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0) |
|
 |
|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C[1] |
| • кипения | 1600 °C[2] |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
InChI=1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т алюми́ния — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства[править | править код]
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре[3][4].
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы[3]:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства[править | править код]
- Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид[3]:
- Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины[4][5].
- Гидролизуется горячей водой:
- При сплавлении со щелочами образует алюминаты:
- В холодном концентрированном растворе аммиака образует осадок гидроксида, а в горячем – метагидроксида алюминия[6]:
Получение[править | править код]
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение[править | править код]
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520[7].
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей[4].
Примечания[править | править код]
- ↑ Aluminum sulfate (англ.)
- ↑ Aluminum sulfate
- ↑ 1 2 3 Волохов, 1988.
- ↑ 1 2 3 Гурлев, 1988, с. 285.
- ↑ Джеймс, 1980, с. 83.
- ↑ Лидин, 2000, с. 85.
- ↑ E-520 (Е-520) Сульфат алюминия. Дата обращения: 30 марта 2010. Архивировано 15 сентября 2011 года.
Литература[править | править код]
- Волохов Ю. А. Алюминия сульфат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 121. — 623 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Джеймс Т. Теория фотографического процесса = The theory of the photographic process / пер. 4-го американского изд. под ред. Картужанского А. Л.. — 2-е русское изд. — Л.: «Химия». Ленинградское отделение., 1980. — 672 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| Сульфат алюминия | |
|---|---|
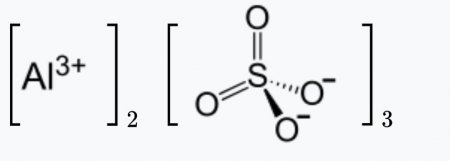 |
|
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
- Al2(SO4)3 →580∘C Al2O3 + 3 SO3
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
- 2 Al(OH)3 + 3 H2SO4 ⟶ Al2(SO4)3 + 6 H2O
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
- 2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
| Сульфат алюминия | |
|---|---|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 |
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия
Физические свойства сульфата алюминия
Получение сульфата алюминия
Химические свойства сульфата алюминия
Химические реакции сульфата алюминия
Применение и использование сульфата алюминия
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Сульфат алюминия – неорганическое химическое соединение, соль серной кислоты и алюминия.
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Гигроскопичен.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.)
алюминий сернокислый (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные гексагональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | сладковато-терпкий |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2710 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,710 |
| Температура разложения, °C | 770 |
| Температура плавления, °C | 770 |
| Молярная масса, г/моль | 342,15 |
| Гигроскопичность | гигроскопичен |
| Растворимость в воде (25 oС), г/100 г | 38,5 |
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
- 1. взаимодействия сульфата меди и алюминия:
3CuSO4 + 2Al → 3Cu + Al2(SO4)3.
- 2. взаимодействия оксида алюминия и гидросульфата калия:
Al2O3 + 6KHSO4 → Al2(SO4)3 + 3K2SO4 + 3H2O (t = 400-550 °C).
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
Химические свойства сульфата алюминия аналогичны свойствам сульфатов других металлов. Однако, сульфат алюминия не реагирует с кислотами. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4.
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия:
Al2(SO4)3 + 6KOH → 2Al(OH)3 + 3K2SO4.
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития:
Al2(SO4)3 + 6LiOH → 2Al(OH)3 + 3Li2SO4.
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
Al2(SO4)3 + 3Ba(NO3)2 → 3BaSO4 + 2Al(NO3)3.
В результате реакции образуются сульфат бария и нитрат алюминия.
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
Al2(SO4)3 + 3Pb(NO3)2 → 3PbSO4 + 2Al(NO3)3.
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия:
2Na3PO4 + Al2(SO4)3 → 2AlPO4 + 3Na2SO4.
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия:
2K3PO4 + Al2(SO4)3 → 2AlPO4 + 3K2SO4.
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
3Ca(HCO3)2 + Al2(SO4)3 → 2Al(OH)3 + 3CaSO4 + 6CO2.
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2SO4.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
11. реакция термического разложения сульфата алюминия:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2 (t = 770-860°C).
В результате реакции образуются оксид алюминия, оксид серы (IV) и кислород.
12. реакция термического разложения октадекагидрата сульфата алюминия:
Al2(SO4)3•18H2O → Al2(SO4)3 + 18H2O (t = 420 °C).
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфат алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата алюминия
реакции
Коэффициент востребованности
5 270
Приведите формулу сульфата алюминия, формулы гидроксидов, соответствующих этой соли, формулы оксидов, соответ-ющих этим гидроксидам, формулы соответ-ющих оксидам металла и неметалла
Найди верный ответ на вопрос ✅ «Приведите формулу сульфата алюминия, формулы гидроксидов, соответствующих этой соли, формулы оксидов, соответ-ющих этим гидроксидам, …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Приведите формулу сульфата алюминия, формулы гидроксидов, соответствующих этой соли, формулы оксидов, соответ-ющих этим гидроксидам, формулы соответ-ющих оксидам металла и неметалла












