Артём Снытников
Профи
(585),
на голосовании
4 года назад
Пожалуйста, напишите подробно.
Голосование за лучший ответ
Владислав
Оракул
(54139)
4 года назад
Берем катионы железа-3 и анионы сульфата-2. Находим наименьшее общее кратное 3 и 2. Делим это число на 3 и на 2 = получаем индексы уравнения Fe2(SO4)3
Похожие вопросы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 марта 2021 года; проверки требуют 6 правок.
У этого термина существуют и другие значения, см. Сульфат железа.
| Сульфат железа(III) | |
|---|---|
 ![mathsf{ ! Biggr]_2}mathsf{ Biggl[}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cb5546c6c9660f939cf7ddc3a9c08c5f9312552) 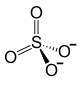 ![mathsf{ ! Biggr]_3}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3194efdc05d85bc053d93d7b8e7571e11dd48842) |
|
 |
|
| Общие | |
| Систематическое наименование |
сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
| Хим. формула | Fe2(SО4)3 |
| Рац. формула | Fe2(SO4)3 |
| Физические свойства | |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса |
(безв.) 399.88 г/моль (пентагидрат) 489.96 г/моль (нонагидрат) 562.02 г/моль |
| Плотность |
(безв.) 3.097 г/см³ (пентагидрат) 1.898 (нонагидрат) 2.1 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления |
(безв.) 480 °C (с разл.) (нонагидрат) 175 °C |
| • разложения | 600[1] |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
(безв.) растворим (нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Классификация | |
| Рег. номер CAS |
10028-22-5 15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| PubChem | 24826 |
| Рег. номер EINECS | 233-072-9 |
| SMILES |
[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[Fe+3].[Fe+3] |
| InChI |
InChI=1S/2Fe.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 RUTXIHLAWFEWGM-UHFFFAOYSA-H |
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| Безопасность | |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |
|
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат железа(III) (лат. Ferrum sulfuricum oxydatum) — неорганическое химическое соединение, соль, химическая формула — 
Физические свойства[править | править код]
Безводный сульфат железа(III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4.
Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации.
Растворим в воде, трудно растворим в этаноле[2].
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1.
Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4.
Хорошо растворяется в воде (440 г на 100 г воды)[3].
В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
С аммиаком образует аддукт вида Fe2(SO4)3·n NH3, где n = 8, 12.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе[править | править код]
Минералогическая форма сульфата железа(III) — микасаит (англ. mikasaite), смешанный сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
Кристаллическая структура кокимбита
- Паракокимбит (англ. paracoquimbite) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Марс[править | править код]
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта[4]. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение[править | править код]
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммония и калия, и вода:
Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа(III):
Сульфат железа(II) можно окислить триоксидом ксенона:
Химические свойства[править | править код]
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Использование[править | править код]
- Как реактив при гидрометаллургической переработке медных руд.
- Как протрава при окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационный регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химической промышленности как окислитель и катализатор.
См. также[править | править код]
- Алунит
- Ярозит
Примечания[править | править код]
- ↑ [www.xumuk.ru/spravochnik/460.html Сайт XuMuK.ru]. Дата обращения: 4 апреля 2010.
- ↑ Рипан, Четяну, 1972, с. 526.
- ↑ Кнунянц, 2013, с. 38.
- ↑ Kenneth Chang. Mars Rover’s 5 Working Wheels Are Stuck in Hidden Soft Spot (англ.). The New York Times (19 мая 2009). Дата обращения: 25 апреля 2011. Архивировано 22 апреля 2012 года.
Литература[править | править код]
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Кнунянц И.Л. Краткая химическая энциклопедия. — М.: Рипол Классик, 2013. — 548 с.
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Iron(III) Sulfate is an inorganic compound that is also termed ferric sulfate. Its chemical formula is Fe2(SO4)3. In iron III sulfate, each iron atom has ionic bonds with the sulfate. A variety of hydrates of iron III sulfate are known, such as nonahydrate, anhydrous monohydrate, etc. In fact, they are the most commonly encountered form of “Iron III Sulfate”. It is slightly soluble in water and very hygroscopic. It is sparingly soluble in alcohol and negligibly soluble in acetone and ethyl acetate. It is not soluble in sulfuric acid and ammonia. As iron III sulfate is insoluble in sulfuric acid, it is used for producing iron III sulfate. It emits toxic fumes of iron and sulfur oxide when heated to decomposition. It is a threat to the environment and immediate steps should be taken to control its spread in the environment. It is used as a coagulant in water purification, as an astringent, and as a soil conditioner. It is corrosive to copper, copper alloys, mild steel, and galvanized steel.
Structure of Iron (III) Sulfate
The chemical formula of Iron(III) Sulfate is Fe2(SO4)3, which has Fe+3 cations and (SO4)-2 anions that form a crystalline salt with rhomboidal geometry. Its molecular formula is Fe2O12S3. The ratio of iron and sulfate ions in Iron III Sulfate is 3:2.
Iron III Sulphate structure
Preparation of Iron (III) Sulfate
Naturally, iron sulfates are found in a variety of rare and commercially unimportant minerals. However, iron III sulfate is mainly found in minerals like pyrite and marcasite. In general, iron III sulfates are used as a solution that is generated from iron wastes. Although the actual specification is vague, its applications do not require high-purity materials.
On a large scale, iron III sulfates are prepared by treating sulfuric acid with a hot solution of iron(II) sulfate and an oxidizing agent. Hydrogen peroxide, chlorine, and nitric acid are some of the typical oxidizing agents used in the preparation of iron III sulfate.
2FeSO4 + H2SO4 + H2O2 → Fe2(SO4)3 + 2H2O
It can also be prepared industrially by injecting chlorine gas into an iron(II) sulfate solution, resulting in a mixture of iron(III) sulfate and iron(III) chloride.
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Properties of Iron (III) Sulfate
| Chemical Formula | Fe2(SO4)3 |
|---|---|
| IUPAC name | Iron(III) sulfate |
| Appearance | yellow crystalline solid or greyish-white crystals |
| Molar Mass/Molecular weight | 399.88 g/mol (anhydrous) 489.96 g/mol (pentahydrate) 562 g/mol (nonahydrate) |
| Density | 3.097 g/cm3 (anhydrous) 1.898 g/cm3 (pentahydrate) |
| Melting point | 480 °C (anhydrous) 175 °C (nonahydrate) |
| Solubility in Water | Slightly Soluble |
| Refractive index | 1.814 (anhydrous) 1.552 (nonahydrate) |
Other Experimental Properties and Reactions
- When iron(III) sulfate is heated to decomposition, it produces iron(III) oxide, sulfur dioxide, and oxygen. This reaction occurs at a temperature between 900 and 1000 °C.
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
- Barium carbonate (BaCO3) reacts with iron III sulfates to produce white precipitates of barium sulfate and ferric carbonate.
3BaCO3 + Fe2(SO4)3 → 3BaSO4 + Fe2(CO3)3
- Iron III sulfate reacts with sodium sulfide (Na2S) to form ferrous sulfide, sodium sulfate, and sulfur.
Fe2(SO4)3 + 3Na2S → 2FeS + 3Na2SO4 + 2S
- The following reaction takes place when iron III sulfate is added to water.
Fe2(SO4)3 + 3Ca(HCO3)2 → 2Al(OH)3↓ + 3CaSO4↓ + 6CO2
Uses of Iron III Sulfate
- Iron III Sulfate is mainly used as a coagulant in water purification and sewage treatment.
- The solution of ferric sulfate is used as a mordant in dyeing and calico printing.
- It is also used in the preparation of iron salts and pigments, in the ferric salt leaching process, in soil conditioners, and in the coal conversion process.
- It acts as a disinfectant, polymerization catalyst, and hemostatic agent for endodontic surgery.
- It is also used in etching aluminium and in pickling stainless steel and copper.
- It is also used as a solids removal agent and oxidizing agent.
Hazards
- Iron III sulfate is a threat to the environment and immediate steps should be taken to control its spread in the environment.
- Though Iron III Sulfate is a stable, not flammable compound, it emits toxic fumes of iron and sulfur oxide when heated to decomposition.
- Prolonged exposure to Iron III Sulfate is toxic to the lungs and mucous membranes and may cause damage to them.
- Contact with this causes skin irritation and may also cause an allergic skin reaction.
- Inhalation of its dust irritates the nose and throat, and its ingestion irritates the mouth and stomach.
- It is harmful to aquatic life with long-lasting effects.
FAQs on Iron Sulfate Formula
Question 1: What is Iron III Sulfate?
Answer:
Iron III Sulfate is an inorganic compound that is also termed ferric sulfate. Its chemical formula is Fe2(SO4)3. In iron III sulfate, each iron atom has ionic bonds with the sulfate. It emits toxic fumes of iron and sulfur oxide when heated to decomposition. Iron III Sulfate is mainly used as a coagulant in water purification and sewage treatment.
Question 2: How is Iron III Sulfate prepared?
Answer:
Iron III sulfate is prepared on a large scale by treating sulfuric acid with a hot solution of iron(II) sulfate and an oxidizing agent. Hydrogen peroxide, chlorine, and nitric acid are some of the typical oxidizing agents used in the preparation of iron III sulfate.
2FeSO4 + H2SO4 + H2O2 → Fe2(SO4)3 + 2H2O
It can also be prepared industrially by injecting chlorine gas into an iron(II) sulfate solution, resulting in a mixture of iron(III) sulfate and iron(III) chloride.
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Question 3: Mention some properties of Iron III Sulfate.
Answer:
Iron III Sulfate is an inorganic salt with the chemical formula Fe2(SO4)3. In iron III sulfate, each iron atom has ionic bonds with the sulfate. It is slightly soluble in water and very hygroscopic. It appears as greyish-white crystals or a yellow odorless powder. It is sparingly soluble in alcohol and negligibly soluble in acetone and ethyl acetate. It is not soluble in sulfuric acid and ammonia.
Question 4: What are the uses of Iron III Sulfate?
Answer:
- Iron III Sulfate is mainly used as a coagulant in water purification and sewage treatment.
- The solution of ferric sulfate is used as a mordant in dyeing and calico printing.
- It is also used in the preparation of iron salts and pigments, in the ferric salt leaching process, soil conditioners, and the coal conversion process.
- It acts as a disinfectant, polymerization catalyst, and hemostatic agent for endodontic surgery.
Question 5: Mention some hazards of Iron III Sulfate.
Answer:
- Iron III sulfate is a threat to the environment and immediate steps should be taken to control its spread in the environment.
- Though Iron III Sulfate is a stable, not flammable compound, it emits toxic fumes of iron and sulfur oxide when heated to decomposition.
- Prolonged exposure to Iron III Sulfate is toxic to the lungs and mucous membranes and may cause damage to them.
Question 6: Write the thermal decomposition reaction of iron(III) sulfate.
Answer:
When iron(III) sulfate is heated to decomposition, it produces iron(III) oxide, sulfur dioxide, and oxygen. This reaction occurs at a temperature between 900 and 1000 °C.
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Last Updated :
14 Sep, 2022
Like Article
Save Article
- Справочник
- Справочник структурных формул
- с
- Сульфат железа(III)
Сульфат железа(III)
Fe2(SO4)3
Fe(+3)2(S(+6)O(-2)4)3
$slope(45)O^-`S`/O/`O/O^-Fe^++/0O`^-S`/O/c/O`/O^-/0Fe^++/0O`^-S/O`/O“/O`^-
Брутто-формула: Fe2O12S3
Молекулярная масса: 399.878
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Fe | Железо (Iron) | 55.849 | 2 | 27.9% |
| O | Кислород (Oxygen) | 15.999 | 12 | 48% |
| S | Сера (Sulfur) | 32.064 | 3 | 24.1% |
Синонимы
- Сульфат железа(III)(IUPAC)
- сернокислое железо(III)
- тетрасульфид(VI) железа(III)
- Diiron trisulfate
- Ferric persulfate
- Ferric sesquisulfate
- Ferric sulfate
- Ferric tersulfate
- Iron persulfate
- Iron sesquisulfate
- Iron tersulfate
- Iron(3+) sulfate
- Iron(III) sulfate(IUPAC)
- Sulfuric acid, iron(3+) salt (3:2)(CAS)
- iron(3+);trisulfate(IUPAC)
Входит в группы
Неорганические соли
zkerscta195
Вопрос по химии:
Написать формулу сульфата железа (lll) и рассчитать содержание железа в этом соединении. Формулу я нашёл Fe2(SO4)3
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
ateapo
w(Fe) = 2*56/(56*2+32*3+16*4*3) = 112/400 = 0,28 или 28%
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
















![{displaystyle {mathsf {Fe[(H_{2}O)_{6}]^{3+}+H_{2}Orightleftarrows Fe[(H_{2}O)_{5}(OH)]^{2+}+H_{3}O^{+};~~~~~~p{mathit {K}}=2,17}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09427beb34aa8eb4063e41a402cd7e369f733cc4)
![{displaystyle {mathsf {Fe[(H_{2}O)_{5}(OH)]^{2+}+H_{2}Orightleftarrows Fe[(H_{2}O)_{4}(OH)_{2}]^{+}+H_{3}O^{+};~~~~~~p{mathit {K}}=3,26}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5b393cbf01f2d08f638e6b58d6a9725cb66137a2)
![{displaystyle {mathsf {[2Fe(H_{2}O)_{6}]^{3+}+2H_{2}Orightleftarrows [Fe_{2}(H_{2}O)_{8}(OH)_{2}]^{4+}+2H_{3}O^{+};~~~~~~p{mathit {K}}=2,91}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/665d26192c906f42b8a16bb98f03fbd88d0ede0f)










