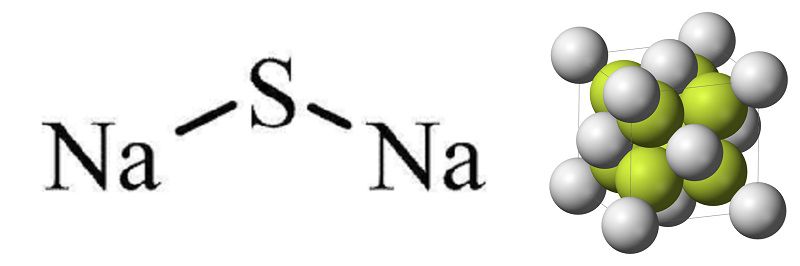Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 ноября 2022 года; проверки требует 1 правка.
| Сульфид натрия | |
|---|---|
  |
|
| Общие | |
| Систематическое наименование |
Сульфид натрия |
| Традиционные названия | сернистый натрий |
| Хим. формула | Na2S |
| Рац. формула | Na2S |
| Физические свойства | |
| Молярная масса | 78,0452 г/моль |
| Плотность | 1,856 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1176 °C |
| Классификация | |
| Рег. номер CAS | 1313-82-2 |
| PubChem | 14804 |
| Рег. номер EINECS | 215-211-5 |
| InChI |
InChI=1S/2Na.S/q2*+1;-2 GRVFOGOEDUUMBP-UHFFFAOYSA-N |
| RTECS | WE1905000 |
| ChEBI | 76208 |
| ChemSpider | 207721 |
| Безопасность | |
| Предельная концентрация | 0,2 мг/м³ |
| ЛД50 | 100-142 мг/кг |
| Токсичность | токсичен, ирритант |
| NFPA 704 |
1 3 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфи́д на́трия, традиционное название — серни́стый на́трий, — сложное неорганическое вещество, бинарное соединение с химической формулой 
Описание[править | править код]
Сульфид натрия — бескислородная соль. При обычных условиях — порошок белого цвета, очень гигроскопичный. Плавится без разложения, термически устойчивый. Технический сульфид натрия желтоватый или коричневатый (красноватый) содержит в себе до 60 % сульфида натрия.
Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет из-за выпадения коллоидной серы и желтеет (цвет полисульфидов). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
Получение[править | править код]
В промышленности — прокаливанием минерала мирабилита 
.
.
.
Химические свойства[править | править код]
Сульфид натрия гидролизуется в 2 этапа:
.
Взаимодействует с разбавленной соляной кислотой:
.
Взаимодействует с концентрированной серной кислотой:
.
Реагирует с водным раствором перманганата калия:
.
В реакции с иодом выпадает элементарная сера:
.
Концентрированным раствором пероксида водорода и кислородом при нагревании переводится в сульфат:
.
.
С раствором сульфита натрия и иода образует тиосульфат[1]:
.
При сплавлении с серой образует полисульфиды натрия переменного состава (серная печень):
Применение[править | править код]
Сульфид натрия применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии, а также для химической водоочистке.
Безопасность[править | править код]
Сульфид натрия ядовит, раздражает кожу и слизистые оболочки. Пожаро- и взрывобезопасен. ПДК в рабочей зоне — 0,2 мг/м³ по ГОСТ 12.1.007-76.
См. также[править | править код]
- Натрий
- Неорганические сульфиды
- Сульфид калия
Примечания[править | править код]
- ↑ Лидин, 2000, с. 28.
Литература[править | править код]
- Лидин Р. А. «Справочник школьника. Химия» М.: Астерель, 2003.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Сульфид натрия – это сложное неорганическое соединение, имеющее в составе атомы натрия и серы. Реагент используется во многих сферах: он необходим для производства бумаги, очистки нефти, синтеза различных производных, очистки воды. В качестве сульфирующего агента в промышленной химии он незаменим для введения сульфогруппы. В органической химии сульфид натрия играет роль реактива для получения тиоэфиров, сернистых красителей.
Содержание
- Что такое сульфид натрия, формула
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение
- Применение
- Применение сульфида натрия в химии, водоочистке
- Применение сульфида натрия в целлюлозно-бумажной промышленности и других сферах
- Опасность, токсичность, транспортировка, утилизация
- Заключение
Что такое сульфид натрия, формула
Сульфид натрия представляет собой бескислородную натриевую соль, его называют сернистым натрием. Химическая формула – Na2S, атомы занимают особое положение в пространстве, выстраиваясь в форме антифлюорита: катионы натрия располагаются в углах куба, анионы занимают внутреннее положение. В природе сульфид натрия встречается редко, в основном в крупных месторождениях серы. Для нужд индустрии его вырабатывают синтетическим путём.
Физические свойства, внешний вид
Технический сульфид натрия — это крупные пластинчатые кристаллы желтоватого, оранжевого, красноватого цвета, содержание активного компонента в нём до 60%, остальное – различные примеси, полисульфиты. При нормальных условиях чистый сульфид натрия имеет вид белые или бесцветных мелких кристаллов без вкуса и запаха, характеризуется гигроскопичностью. При увлажнении воздуха сульфид выделяет сероводород. Реакцию можно обнаружить по появлению сильного резкого запаха, напоминающего тухлые яйца. В связи со способностью поглощать влагу, сульфид натрия способен к образованию кристаллогидратов (пентагидрат: Na2S ∙ 5H2O).
Температура плавления ангидрида сульфида натрия составляет 1,176 °С. Раствор сульфида натрия менее устойчивый и плавится при достижении температурного режима в 50 °С, пентагидрат расплавляется при 100 °С. Наибольшую плотность имеет безводный сульфид (1,856 г/см3). Вещество хорошо растворяется в воде, при подогревании растворимость возрастает. Гидролиз наблюдается при 50 °С. С трудом растворим в органических растворителях: спирт, эфиры, фенолы.
Химические свойства, реакции
Положение атомов сульфида натрия в пространстве, структурная формула
Наибольшей реакционной способностью обладает раствор сульфида натрия. Он взаимодействует с простыми веществами. Так, сульфид натрия реагирует с кислород при разогреве до 400°С:
Na2S + 2O2 → Na2SO4
В реакции раствора сульфида натрия с кристаллической серой происходит образование трисульфида натрия:
Na2S + 2S → Na2S3
При увеличении количества серы изменяется продукт: тетрасульфид, пентасульфид:
Na2S + 3S → Na2S4
Na2S + 4S → Na2S5
Сульфид натрия реагирует с галогенами. С йодом даёт чистую серу, йодид натрия:
Na2S + I2 → S↓ + 2NaI
Раствор сульфида реагирует с кислотами. В реакции с соляной кислотой образуется хлорид натрия и дигидросульфид:
Na2S + 2HCl → 2NaCl + H2S↑
C концентрированной серной кислотой сульфид натрия формирует гидросульфид натрия, оксид серы:
Na2S + 3H2SO4 → 2NaHSO4 + SO2 + H2O + S
Сернокислый натрий является продуктом реакции сульфида натрия с сероводородом:
Na2S + H2S → 2NaHS
Расплав сульфида натрия подвергается электролизу, при этом вещество распадается на отдельные элементы:
Na2S →2Na + S
Раствор сульфида натрия также подвергается электрохимическому разложению:
Na2S + H2O → S↓ + 2NaOH + H2↑
Гидролиз соединения протекает по аниону, т.е. процесс обратимый, характерна щелочная среда с большим количеством ионов OH–, выделяется кислая соль:
Na2S + H2O → NaHS + Na+ + OH–
Для сульфида натрия характерна реакция ионного обмена, при которой происходит обратимое разложение продукта:
3Na2S + Al2(SO4)3 + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 3Na2SO4
Обмен может протекать и с выпадением осадка. Реакция с сульфатом марганца приводит к выделению нерастворимого сульфида марганца:
Na2S + MnSO4 → MnS↓ + Na2SO4
Производство и получение
В лабораторных условиях получение сульфида натрия идёт посредством восстановления молекулярной серы. Уравнение реакции:
S + 2Na → Na2S
В промышленности добыча ведётся из минерала мирабелита (Na2SO4 ∙ 10H2O). В специализированных печах проводят прокаливание глауберовой соли с добавлением реагентов. Перед этим сырьё подготавливают, измельчают в дробилках, затем просеивают от ненужного мусора, после чего проводится обработка водородом, угарным газом либо углём:
- Na2SO4 + 4H2 → Na2S + 4H2O
- Na2SO4 + 4C → Na2S + 4CO↑
- Na2SO4 + 4CO → Na2S + 4CO2↑
Для получения вещества с большей чистотой, его дополнительно фильтруют, промывают и просушивают, контролируют содержание примесей.
Применение
Основная сфера применения натрия сульфида – химическая промышленность. Он востребован в органическом и неорганическом синтезе как реактив, являющийся источником сульфогруппы. Серосодержащие соединения используются во всех областях, важной отправной точкой для их синтеза является использования сульфида натрия. Он нужен для обработки кожи, актуально его применение на нефтеперерабатывающих заводах, для выпуска поверхностно-активных веществ (ПАВ), необходим в текстильном производстве, фотографии.
Применение сульфида натрия в химии, водоочистке
Сульфид натрия выступает как носитель сульфатной группы, он может быть донором электронов (выступать как нуклеофил). Соединение выполняет ряд полезных функций и участвует в процессах добычи следующих веществ:
- сложных тиоэфиров;
- серных красителей;
- пластификаторов резины;
- нитроанилинов;
- хлортолуола.
Применение натрия сульфида в аналитике и органике обусловлено высокой реакционной активностью, которая контролируется и направляется. При очищении воды сульфид натрия применим для поглощения кислорода и тяжёлых металлов.
Применение сульфида натрия в целлюлозно-бумажной промышленности и других сферах
Еще одна сфера применения сульфида натрия – краф-процесс. Благодаря наличию сульфида можно получить сульфатную целлюлозу, которая отличается хорошими показателями сопротивления бумаги растяжению и разрыву. Добавление сульфида проводят при щелочной делигнификации древесины на стадии сульфатной варки. Сульфид натрия – это компонент белого щелока, в котором дерево вываривают.
Соединение – отбеливающий агент текстиля. Он позволяет получить стойкий белый цвет, зафиксировать имеющееся отбеливание. Сульфид натрия предотвращает потускнение и посерение окраски. Он применяется в химической фотографии для придания чёрно-белому фото эффекта матовости.
Опасность, токсичность, транспортировка, утилизация
Сульфид натрия крайне токсичен, относится ко 2 классу опасности (высокоопасные отходы): раздражает слизистые оболочки, кожу, вызывает ожоги. Транспортируют в оригинальной герметичной упаковке крытыми видами транспорта, за исключением самолётов. Утилизация проводится путём окисления растворов при высокой температуре.
Заключение
Сульфид натрия – это вещество, использующееся для получения производных, красителей, обесцвечивающий ткани. Применяется для очищения жидкостей, разделения нефти на фракции, матирования фотографий, выработки целлюлозы, дубления кож. Соединение токсично и при применении его требуется соблюдение техники безопасности, ношения защитной одежды.
Читайте также:
- Оксид азота: свойства, применение, реакции
- Угольная кислота: описание, свойства и реакции, применение
- Сульфат алюминия: свойства, применение
- Дихлорметан: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Other names
Disodium sulfide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.829 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1385 (anhydrous) 1849 (hydrate) |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na2S |
| Molar mass | 78.0452 g/mol (anhydrous) 240.18 g/mol (nonahydrate) |
| Appearance | colorless, hygroscopic solid |
| Odor | none |
| Density | 1.856 g/cm3 (anhydrous) 1.58 g/cm3 (pentahydrate) 1.43 g/cm3 (nonohydrate) |
| Melting point | 1,176 °C (2,149 °F; 1,449 K) (anhydrous) 100 °C (pentahydrate) 50 °C (nonahydrate) |
|
Solubility in water |
12.4 g/100 mL (0 °C) 18.6 g/100 mL (20 °C) 39 g/100 mL (50 °C) (hydrolyses) |
| Solubility | insoluble in ether slightly soluble in alcohol[1] |
|
Magnetic susceptibility (χ) |
−39.0·10−6 cm3/mol |
| Structure | |
|
Crystal structure |
Antifluorite (cubic), cF12 |
|
Space group |
Fm3m, No. 225 |
|
Coordination geometry |
Tetrahedral (Na+); cubic (S2−) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
   
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H311, H314, H400 |
|
Precautionary statements |
P260, P264, P270, P273, P280, P301+P312, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P322, P330, P361, P363, P391, P405, P501 |
| NFPA 704 (fire diamond) |
3 1 1 |
|
Autoignition |
> 480 °C (896 °F; 753 K) |
| Safety data sheet (SDS) | ICSC 1047 |
| Related compounds | |
|
Other anions |
Sodium oxide Sodium selenide Sodium telluride Sodium polonide |
|
Other cations |
Lithium sulfide Potassium sulfide Rubidium sulfide Caesium sulfide |
|
Related compounds |
Sodium hydrosulfide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium sulfide is a chemical compound with the formula Na2S, or more commonly its hydrate Na2S·9H2O. Both the anhydrous and the hydrated salts in pure crystalline form are colorless solids, although technical grades of sodium sulfide are generally yellow to brick red owing to the presence of polysulfides and commonly supplied as a crystalline mass, in flake form, or as a fused solid. They are water-soluble, giving strongly alkaline solutions. When exposed to moist air, Na2S and its hydrates emit hydrogen sulfide, an extremely toxic, flammable and corrosive gas which smells like rotten eggs.
Some commercial samples are specified as Na2S·xH2O, where a weight percentage of Na2S is specified. Commonly available grades have around 60% Na2S by weight, which means that x is around 3. These grades of sodium sulfide are often marketed as ‘sodium sulfide flakes’.
Structure[edit]
Na2S adopts the antifluorite structure,[2][3] which means that the Na+ centers occupy sites of the fluoride in the CaF2 framework, and the larger S2− occupy the sites for Ca2+.
Production[edit]
Industrially Na2S is produced by carbothermic reduction of sodium sulfate often using coal:[4]
- Na2SO4 + 2 C → Na2S + 2 CO2
In the laboratory, the salt can be prepared by reduction of sulfur with sodium in anhydrous ammonia, or by sodium in dry THF with a catalytic amount of naphthalene (forming sodium naphthalenide):[5]
- 2 Na + S → Na2S
Reactions with inorganic reagents[edit]
The sulfide ion in sulfide salts such as sodium sulfide can incorporate a proton into the salt by protonation:
- S2−
+ H+ → SH−
Because of this capture of the proton ( H+), sodium sulfide has basic character. Sodium sulfide is strongly basic, able to absorb two protons. Its conjugate acid is sodium hydrosulfide (SH−
). An aqueous solution contains a significant portion of sulfide ions that are singly protonated.
- S2−
+ H2OSH−
+ OH− - SH−
+ H2OH2S + OH−
Sodium sulfide is unstable in the presence of water due to the gradual loss of hydrogen sulfide into the atmosphere.
When heated with oxygen and carbon dioxide, sodium sulfide can oxidize to sodium carbonate and sulfur dioxide:
- 2 Na2S + 3 O2 + 2 CO2 → 2 Na2CO3 + 2 SO2
Oxidation with hydrogen peroxide gives sodium sulfate:[6]
- Na2S + 4 H2O2 → 4 H2O + Na2SO4
Upon treatment with sulfur, polysulfides are formed:
- 2 Na2S + S8 → 2 Na2S5
Uses[edit]
Sodium sulfide is primarily used in the kraft process in the pulp and paper industry.
It is used in water treatment as an oxygen scavenger agent and also as a metals precipitant; in chemical photography for toning black and white photographs; in the textile industry as a bleaching agent, for desulfurising and as a dechlorinating agent; and in the leather trade for the sulfitisation of tanning extracts. It is used in chemical manufacturing as a sulfonation and sulfomethylation agent. It is used in the production of rubber chemicals, sulfur dyes and other chemical compounds. It is used in other applications including ore flotation, oil recovery, making dyes, and detergent. It is also used during leather processing, as an unhairing agent in the liming operation.
Reagent in organic chemistry[edit]
Alkylation of sodium sulfide give thioethers:
- Na2S + 2 RX → R2S + 2 NaX
Even aryl halides participate in this reaction.[7] By a broadly similar process sodium sulfide can react with alkenes in the thiol-ene reaction to give thioethers.
Sodium sulfide can be used as nucleophile in Sandmeyer type reactions.[8] Sodium sulfide reduces1,3-dinitrobenzene derivatives to the 3-nitroanilines.[9] Aqueous solution of sodium sulfide can be refluxed with nitro carrying azo dyes dissolved in dioxane and ethanol to selectively reduce the nitro groups to amine; while other reducible groups, e.g. azo group, remain intact.[10] Sulfide has also been employed in photocatalytic applications.[11]
Sodium sulfide is the active ingredient in Dr. Scholl’s ingrown toenail pain treatment.
Safety[edit]
Like sodium hydroxide, sodium sulfide is strongly alkaline and can cause chemical burns. Acids react with it to rapidly produce hydrogen sulfide, which is highly toxic.
References[edit]
- ^ Kurzin, Alexander V.; Evdokimov, Andrey N.; Golikova, Valerija S.; Pavlova, Olesja S. (June 9, 2010). “Solubility of Sodium Sulfide in Alcohols”. J. Chem. Eng. Data. 55 (9): 4080–4081. doi:10.1021/je100276c.
- ^ Zintl, E; Harder, A; Dauth, B. (1934). “Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums”. Z. Elektrochem. Angew. Phys. Chem. 40: 588–93.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Holleman, A. F.; Wiberg, E. “Inorganic Chemistry” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ So, J.-H; Boudjouk, P; Hong, Harry H.; Weber, William P. (1992). Hexamethyldisilathiane. Inorg. Synth. Inorganic Syntheses. Vol. 29. p. 30. doi:10.1002/9780470132609.ch11. ISBN 978-0-470-13260-9.
- ^ L. Lange, W. Triebel, “Sulfides, Polysulfides, and Sulfanes” in Ullmann’s Encyclopedia of Industrial Chemistry 2000, Wiley-VCH, Weinheim. doi:10.1002/14356007.a25_443
- ^ Charles C. Price, Gardner W. Stacy “p-Aminophenyldisulfide” Org. Synth. 1948, vol. 28, 14. doi:10.15227/orgsyn.028.0014
- ^ Khazaei; et al. (2012). “synthesis of thiophenols”. Synthesis Letters – Thieme Chemistry. 23 (13): 1893–1896. doi:10.1055/s-0032-1316557. S2CID 196805424.
- ^ Hartman, W. W.; Silloway, H. L. (1955). “2-Amino-4-nitrophenol”. Organic Syntheses.
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collective Volume, vol. 3, p. 82 - ^ Yu; et al. (2006). “Syntheses of functionalized azobenzenes”. Tetrahedron. 62 (44): 10303–10310. doi:10.1016/j.tet.2006.08.069.
- ^ Savateev, A.; Dontsova, D.; Kurpil, B.; Antonietti, M. (June 2017). “Highly crystalline poly(heptazine imides) by mechanochemical synthesis for photooxidation of various organic substrates using an intriguing electron acceptor – Elemental sulfur”. Journal of Catalysis. 350: 203–211. doi:10.1016/j.jcat.2017.02.029.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1.
Показано записей: 1.
Сульфид натрия
Брутто-формула:
Na2S
CAS# 1313-82-2
Названия
Русский:
- Натрий сернистый
- Натрия сульфид
- Сульфид натрия [Wiki]
English:
- Dinatriumsulfid
- Disodium monosulfide
- Disodium sulfide
- Disodium sulphide
- Sodium monosulfide
- Sodium monosulphide
- Sodium sulfide [Wiki]
- Sodium sulfide scales
- Sodium sulfidosodium
Варианты формулы:
Реакции, в которых участвует Сульфид натрия
-
Pb(NO3)2 + {M}2S -> PbS”|v” + 2{M}NO3
, где M =
H Li Na K Rb -
3Na2S2O4 + 6NaOH → 5Na2SO3 + Na2S + 3H2O
-
Na2MoO4 + 4Na2S + 4H2O -> Na2MoS4 + 8NaOH
-
SnCl2 + Na2S -> SnS”|v” + 2NaCl
-
Be(NO3)2 + {M}2S + 2H2O -> Be(OH)2 + H2S + 2{M}NO3
, где M =
Na K Li Rb Cs (NH4)
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.