CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Молекулярная формула (также называемая брутто-формулой) используется в химии для обозначения типа и количества атомов в химическом соединении. Если соединение состоит из дискретных молекул, молекулярная формула указывает их состав[1][2]. Однако для таких соединений, как соли, молекулярная формула соответствует формульной единице, указывающей стехиометрический состав. Молекулярная формула часто не то же самое, что простейшая формула, которая определяет наименьшее возможное соотношение чисел атомов химических элементов, входящих в химическое соединение.
| Вещество | Структурные формулы | Другие способы представления | |||||
|---|---|---|---|---|---|---|---|
| Диаграмма Льюиса[en] | Валентная форма |
Проекция Натта | Скелетная формула | Рациональная формула | Брутто-формула | Простейшая формула | |
| вода | 
|
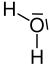
|

|
не существует | не существует | H2O | H2O |
| метан | 
|

|
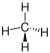
|
не существует | CH4 | CH4 | CH4 |
| пропан | CH3-CH2-CH3 | С3Н8 | С3Н8 | ||||
| уксусная кислота | 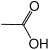
|
CH3-COOH | С2Н4О2 | CH2O |
Структура формулы[править | править код]
Молекулярная формула химического соединения состоит из символов химических элементов, а также подстрочных арабских цифр для указания их количества в этом соединении. Количество атомов всегда помещается в виде индекса справа от символа элемента, при этом число «1» не пишется[3]. Т.о, для воды вместо «H2O1» указывается «H2O».
Если соединение состоит из дискретных молекул, молекулярная формула указывает состав молекулы. Молекулярная формула дитиодихлорида — S2Cl2, а этана C2H6. Простейшие формулы для этих веществ SCl и СН3 соответственно.
Существуют разные способы упорядочивания элементов в молекулярных формулах. В таблицах и базах данных — особенно для органических соединений — обычно предпочтительнее использовать систему Хилла[en], согласно которой сначала указываются атомы углерода, затем атомы водорода, а затем все остальные атомы, отсортированные по алфавиту. Эта система упрощает поиск соединений, если вы не знаете их название.
Для неорганических соединений часто выбирают другой путь, который учитывает стехиометрический состав соединений: элемент с более высокой электроотрицательностью (обычно правее или выше в периодической таблице) находится справа от элемента с более низким значением электроотрицательности (как в молекулярной формуле, так и в названии вещества). Например, хлорид натрия обозначается как «NaCl», а не «ClNa». В случае комплексных солей сначала указывается катион с центральным атомом и его лигандами, а затем анион с центральным атомом и его лигандами; например, (NH4)2SO4 для сульфата аммония. Неорганические кислоты указываются аналогично родственным солям. Атомы водорода находятся впереди вместо катионов, как в случае H3PO4, молекулярной формулы ортофосфорной кислоты. Эти формулы представляют собой формульные единицы для стехиометрических расчетов, но не отображают структуру соединений.
Примеры и особенности[править | править код]
- В хлориде натрия NaCl мольное соотношение[de] натрия к хлору равно n(Na) : n(Cl) = 1 : 1. Молекулярная формула хлорида натрия ничего не говорит о структуре соединения (см. иллюстрация).
- В оксиде алюминия Al2O3 мольное соотношение n(Al) : n(O) = 2 : 3.
- H2O, молекула воды, состоит из двух атомов водорода (H) и атома кислорода (O) (соотношение 2 : 1);
- H2SO4, молекула серной кислоты, состоит из двух атомов водорода, одного атома серы (S) и 4 атомов кислорода (соотношение 2 : 1 : 4).
- В гексане C6H14 мольное соотношение n(C) : n(H) = 6 : 14 = 3 : 7. Следовательно, простейшая формула молекулы гексана будет C3H7. Однако такие формулы не указывают реальное количество атомов в молекуле и поэтому зачастую неоднозначны.
В случае простых соединений молекулярная формула часто совпадает с простейшей, которая использует наименьшие возможные целые числа.
Использование молекулярных формул[править | править код]
Молекулярные формулы также используются при формулировании уравнений химических реакций. Исходные и конечные продукты реакции (реагенты и продукты) в реакционной схеме в неорганической химии обычно указываются в виде молекулярных формул. Они составляют основу стехиометрических расчетов. Молекулярные формулы редко используются в органической химии, так как они почти не содержат информации, важной для протекания реакций с участием органических соединений.
Примечания[править | править код]
- ↑ IUPAC – molecular formula (M03987) (англ.). Дата обращения: 15 ноября 2020. Архивировано 4 марта 2021 года.
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 433.
Как правильно называть химические формулы?
Первая часть названия — это название элемента-неметалла с суффиксом «-ид». Вторая часть названия — это название элемента-металла в родительном падеже. Пример: Al2O3. Al2 = Алюминий; O3 = Кислород (Оксиген).
Как составить формулу?
Создание простой формулы в Excel
- Выделите на листе ячейку, в которую необходимо ввести формулу.
- Введите = (знак равенства), а затем константы и операторы (не более 8192 знаков), которые нужно использовать при вычислении. В нашем примере введите =1+1. Примечания: …
- Нажмите клавишу ВВОД (Windows) или Return (Mac).
Как правильно писать химические элементы?
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат.
Как образуются химические формулы?
Простейшая формула – химическая формула, составленная из символов химических элементов и таких подстрочных индексов, отношение которых равно отношению чисел атомов соответствующих элементов в этом веществе. Подстрочные индексы в простейшейформуле не имеют общего делителя. Индекс » 1″ в формулах не ставится.
Как назвать углеводороды по структурным формулам?
Углеводороды
| Вещество | Упрощенная структурная формула | Брутто-формула |
|---|---|---|
| Пропан | CH3-CH2-CH3 | C3H8 |
| Бутан | CH3-CH2-CH2-CH3 | C4H10 |
| Пентан | CH3-CH2-CH2-CH2-CH3 | C5H12 |
| Гексан | CH3-CH2-CH2-CH2-CH2-CH3 или то же самое, но короче: CH3-(CH2)4-CH3 | C6H14 |
Как даются названия химическим элементам?
Систематическое обозначение элемента образуется из трёх первых букв каждого цифрового корня, при этом первая буква представляется заглавной.
Как правильно составить формулы солей?
Учимся называть правильно
| Формула кислоты | Название кислоты | Кислотный остаток (формула) |
|---|---|---|
| HBr | бромоводородная | Br — |
| H 2 SO 3 | сернистая | SO 3 2- |
| H 2 SO 4 | серная | SO 4 2- |
| HClO | хлорноватистая | ClO — |
•4 дек. 2021 г.
Как составить формулу оксида элемента?
0:012:48Рекомендуемый клип · 60 сек.составляем формулы оксидов — YouTubeYouTube
Как определить валентность элемента?
– Большинство химических элементов обладают переменной валентностью, и ее можно определить по таблице Менделеева. В этой таблице номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность.
Что означают цифры над химическими элементами?
Цифра над названием элемента — это атомный номер. Он указывает на количество протонов в ядре и используется для упорядочивания элементов в таблице.
Как сделать молекулярную формулу?
Структура формулы Молекулярная формула химического соединения состоит из символов химических элементов, а также подстрочных арабских цифр для указания их количества в этом соединении. Количество атомов всегда помещается в виде индекса справа от символа элемента, при этом число «1» не пишется.
Как понять химическую формулу?
Хими́ческая фо́рмула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.).
Как называть вещества по номенклатуре Июпак?
При составлении названий органических соединений по систематической номенклатуре IUPAC используют основных понятия: органический радикал, родоначальная структура, характеристическая группа, заместитель. остаток органической молекулы, из которой удален один или несколько атомов водорода.
Как определять название предельных углеводородов?
По номенклатуре ИЮПАК названия предельных углеводородов (алканов) характеризуются суффиксом -ан. Первые четыре углеводорода носят исторически сложившиеся названия; начиная с пятого, в основе названия углеводорода лежит греческое название соответствующего числа углеродных атомов.
Кто дал названия химическим элементам?
По имени известных ученых: кюрий — в честь ученых Пьера Кюри и Марии Склодовской-Кюри; энштейний — в честь Альберта Энштейна; нобелий — в честь Альберта Нобеля; резерфордий — в честь Резерфорда. По цвету элементов и их соединений: бериллий — зеленый, по цвету минерала изумруда; индий — от исп.
Как называются элементы?
Список химических элементов
| № | Название | Латинское название |
|---|---|---|
| 1 | Водород | Hydrogenium |
| 2 | Гелий | Helium |
| 3 | Литий | Lithium |
| 4 | Бериллий | Beryllium |
Как образовывать соли?
- Основные соли образуются при взаимодействии щелочей с растворимыми в воде солями. …
- Основные соли образуются при взаимодействии избытка основания с кислотой. …
- Гидроксокарбонат меди(II), свинца(II), цинка и некоторых других металлов образуется при взаимодействии растворов солей этих металлов с растворами карбонатов.
-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Проблема:
«Брутто-формула органического соединения
— С6НюО.
Требуется -установить структурную
формулу, используя спектроскопию ЯМР».
При решении этой задачи будем
придерживаться принципов планирования
эксперимента, изложенных в § 2.
-
Формулировка
проблемы
Прежде
всего целесообразно рассмотреть вопрос
о том, насколько ясно сформулирована
данная задача. Заметим, что приведенная
выше формулировка по существу содержит
ряд дополнительных условий, опущенных
в целях компактности (в таком виде
подобные формулировки часто встречаются
в учебниках и задачниках по
спектроскопии ЯМР). Попытаемся, однако,
дать более определенную формулировку,
не обращая внимание на неизбежный отказ
от компактности формы.
Расширенная
формулировка проблемы. Известно,
что некоторое органическое соединение
имеет брутто-формулу СбН10О.
Соединение химически индивидуально.
Требуется определить структурную
формулу соединения; учет динамических
и колебательно-вращательных форм не
обязателен. Структура удовлетворяет
правилам насыщения валентностей и
находится в злектрически-нейт- ральной
форме. Таким образом, различные ионные
и радикальные формы должны быть исключены
из рассмотрения. Для установления
структуры соединения следует
применить спектроскопию ЯМР-
Предполагается, что соединение растворимо
в стандартных органических растворителях
и имеется в количествах, достаточных
для регистрации стандартных спектров
ЯМР.
-
Выдвижение
гипотез. Концепция последовательного
эксперимента
Полный
список структур, имеющих брутто-формулу
С6Н10О,
можно получить с помощью специальных
ЭВМ-программ, однако уже из общих
соображений ясно, что число таких
структур достаточно велико. Таким
образом, ста-
дия
анализа теоретических следствий (гл.
2, § 2) для всех элементов множества
гипотез может оказаться чрезвычайно
трудоемкой. В этом случае оказывается
целесообразным использовать стратегию
последовательного эксперимента,
смысл которого состоит в следующем.
Несмотря на то что каждый элемент
множества гипотез в отдельности не
рассматривается, в некоторых случаях
возможно так переформулировать начальные
условия, что это множество будет
разделено на ограниченное число
подмножеств. Изучая различия в признаках
этих подмножеств, планируют эксперимент
№ 1, с помощью которого относят
изучаемую систему к одному из. указанных
подмножеств. В дальнейшем это
подмножество разбивают снова на ряд
подмножеств и с помощью эксперимента
№ 2 устанавливают, какое из этих
подмножеств адекватно эксперименту.
Подобную шаговую стратегию используют
до тех пор, пока не станет возможным
использование прямых процедур, описанных
выше в § 2.
Классификацию
множеств гипотез в рассматриваемой
нами задаче целесообразно проводить,
исходя из анализа функций атома кислорода.
С этой точки зрения можно выделить
четыре подмножества структур Hi—
Нi
:
соединения типа R^CO;
#2
:
соединения типа RCHO;
#з
•’ спирты
ROH;
Ht
:
простые эфиры R,—О—R2,
содержащие
фрагменты типа С—О—СН3,
С—О—СН2—СНз.
Можно
полагать, что сумма элементов подмножеств
Hi—Н4
почти полностью совпадает с исходным
множеством элементов (исключение
составляет, например, диаллиловый эфир
(СН2=СН—СН2)гО).
Предполагая подмножества Hj—М4
равновероятными, приходим к выводу, что
информационная емкость проблемы
составляет 2 бит (точнее, несколько более
2 бит, если учитывать указанные выше
исключения).
-
Выбор
адекватной гипотезы
Допустим,
что экспериментальная проверка гипотез
Hi—#4
может быть проведена с помощью обзорных
спектров ЯМР ‘Н и ЯМР 13С—{*Н}.
Рассмотрим теперь, какими особенностями
будут характеризоваться спектры • ЯМР
подмножеств Н!—Н4.
Для простоты заменим полное описание
спектров значительно более грубым
анализом значений «двоичных факторов»,
т. е. параметров, принимающих только
одно из двух возможных значений: + («да»)
и
-
(«нет»).
Безусловно, при этом, информационная
емкость метода ЯМР существенно
уменьшается, поэтому нужно быть
уверенным, что остающейся информации
достаточно для решения задачи. Анализ
литературных данных по химическим
сдвигам ядер *Н и 13С
(гл. 3) позволяет, например, выдвинуть
следующие четыре фактора?
(<Pi)
—
наличие сигнала в области 9—10 м. д.
(6-шкала, ЯМР :Н);
(фг)
— наличие уширенного синглета в одну
протонную единицу в области
-
5
м. д. (ЯМР >Н);
(фз)
— наличие узкого синглета или мультиплета
с узкими компонентами в области 3,2—3,6
м. д. (ЯМР *Н);
(ф4)
— наличие сигнала в области 180—210 м. д.
(ЯМР 13С
— {*Н}). Матрица следствий для четырех
факторов на системе четырех гипотез
должна содержать 16 элементов:
Значение,
фактора
Ф1
Фг
Фз
ф4
Гипотеза
Hi
Н2
//, Я4
-
_
_|_
+
+ – –
С
помощью этой матрицы можно рассчитать
информативности каждого фактора;
используя формулу (7.7), получим hi=h2—h3=0,85
бит
и Л4=
1 бит.
Планирование
эксперимента. Анализ матрицы следствий
показывает, что указанная проблема
выбора одной из четырех гипотез не
решается с помощью ‘какого-либо одного
или даже двух факторов, поскольку сумма
информации любых двух факторов меньше
2 бит. Из возможных “триад факторов
(1,2,3), (1,2,4), (1,3,4) и (2,3,4) комбинация (2Д4) не
является решающей, так как оиа не
позволяет различать шпютезы Я, и Я2.
Остальные триады являются решающими
и могут быть использованы для решения
задачи. Учитывая, однако, что использование
триад (1,2,4) и (1,3,4) связано с привлечением
обоих методов — ЯМР ‘Н и ЯМР 13С—{‘Н},
— приходим к выводу, что оптимальной
является методика (1,2,3), требующая
экспериментального измерения значений
трех факторов грь If2
и фа.
Непосредственно
из рассмотрения следствий <pi—ф3
вытекают требования К
экспериментальной
методике. Обзорный спектр ЯМР ]Н
должен быть записан В
области
от
0 до 10
м. д. Идентификация типа мультиплета
гребуег разреше ния не хуже 2 Гц. Необходима
запись интегральной кривой. В качестве
растворителя в данном случае можно
использовать четыреххлористый углерод,
хлороформ. В последнем случае могут
появиться сигналы в области 7,0— 7,2 м.
д., однако эта область ие влияет на
экспериментальное определение факторов
ф[ — ф3.
Эксперимент.
Регистрация спектра ЯМР ‘Н соединения
с брутто-формулой C«HioO
проведена
на спектрометре Varian
HAJ100
Ь
с использованием ССЦ и качестве
растворителя (гл. 5, § 3). Спектр
удовлетворяющий сформулированным
выше требованиям, приведен на рис. 5.16,
К.
Из этого спектра следуют экспериментальные
значения факторов ф!—фз:ф1=(
+ ), фг= (—). фз=(—).
На
основании экспериментальных значений
факторов приходим к выводу что гипотезы
Яь
Я3,
Я4
неадекватны эксперименту. Гипотеза Яг
не противоречит эксперименту и
рассматривается как ответ.
-
Дальнейшая
детализация гипотез
Таким
образом, изучаемое соединение представляет
собой альдегид. Множество всех
альдегидов с брутто-формулой СбНщО
разделим на два подмножества.
Я21:
соединения,
содержащие иенасыщенность вида —СН
= СГЬ, — СН —СН— или
— СН=С—;
Я2г
: соединения, не содержащие ненасыщенности
указанного выше типа.
Предполагая
эти подмножества равновероятными,
приходим к выводу, что информационная
емкость задачи выбора одного из
подмножеств равна
-
бит.
Анализ
литературных данных по химическим
сдвигам протонов (гл. 3) позволяет
выдвинуть еще один «двоичный фактор»:
(фв)
— наличие сигнала в области 4,5—6,5 м. д.
Вновь
обращаясь к эксперименту (рис. 5.16, К),
приходим к выводу, что изучаемое
соединение является ненасыщенным
альдегидом. Остающееся множество
структур уже достаточно ограниченное
и может быть пересчитано с помощью общей
структурной формулы вида
ХЧ
/Y
z>
<т
с
соответствующими изомерными формами
X JL
Y4
/Z Ух
/X Z X
2Ч
/X
>С=С<
/С=С< /С=С<; >С=С< /С=С(
Y Х/
ХТ
Z’
ХТ X/
ЧТ
Y/
ХТ
где
X, Y,
Z —
углеводородные заместители; Т —
заместитель содержащий группу СНО.
Множество структур указанного типа
можно разбить на семь подмножеств в
соответствии со.схемой:
|
X |
Y |
Z |
т |
Число изомеров |
|
н |
Н |
С2н5 |
СНаСНО |
3 |
|
н |
н |
СНз |
сн.2сн2сно |
3 |
|
н |
н |
н-С8Н7 |
СНО |
3 |
|
н |
н |
«зо-С3Н7 |
СНО |
3 |
|
н |
н |
■ |
СН |
3 |
|
н |
СНз |
С2Н5 |
сно |
6 |
|
н |
сн3 |
СНз |
сн2сно |
3 |
Гипотеза
#211
#2!
г
#213
#214
#215
#216 #217
Таким
образом, всего имеется 24 элемента в семи
подмножествах. Задача выбора одйой из
равновероятных 24 структур содержит 4,6
бит.
Используя
литературные данные о химических сдвигах
и константах спии- спинового взаимодействия
протонов (гл. 3), а также свойства спектров
первого порядка (гл. 6,
§ 3), приходим к выводу, что проблема
выбора одной из 24 гипотез может быть
решена с помощью нижеприведенных
факторов (<р6)
— (фэ)-
(ф6)
— форма сигнала альдегидного протона.
Этот фактор принимает 4 значения:
(++) — дублет с константой 7—8
Гц, (Ч—) — дублет с константой
-
3
Гц, (—Ь) — триплет с константой 2—3 Гц,
( ) — сииглет. Соответствие структурных
фрагментов и форм спектра альдегидного
протона таково:
-СНо-СНО
С—
СН—СНО
I
с
/Н
С=С<
хСНО
(+ +) ■
–с(
чсно;
(—)
(-+)
(ф7)
—
наличие сигналов в области 5—6
м. д. с суммарной интегральной
интенсивностью в две протонные единицы;
(фв)
—
наличие дублета в области 1—2
м. д.’ с суммарной интегральной
интенсивностью в шесть протонных
единиц;
(фэ)
—
наличие расщеплений порядка 15—17 Гц на
сигналах в олефиновой части спектра.
Нетрудно
видеть, что суммарная информация,
получаемая с помощью факторов фг—Фв.
равна 5, что превышает информационный
объем задачи.
Обращаясь
к экспериментальному спектру (рис.
5.16, К)
и данным расшифровки спектра (гл. 6,
§ 1 и 3; табл.
6.1 и 6.4), получим
следующие
экспериментальные значения (фе)
= (+ + ), (фг) = (+), (фв) =
( + ) и (ф9)
=
(+). Отсюда непосредственно следует,
что рассматриваемое соединение
представляет собой траяс-гексен-2-аль.
Возвращаясь
к исходной формулировке проблемы,
приходим к выводу, что суммарная
информационная емкость проблемы
составляет 7,6 бит. Отсюда можио
предположить, что полное множество
структур с брутто-формулой С6НюО
включает 200—300 элементов.
-
Практическаи
формулировка задачи
Формулировка
задачи, рассмотренная выше, в 4.1, как
уже указывалось, представляет собой
некоторую идеализацию, преследующую
в основном учебные цели. Это становится
очевидным хотя бы из того факта, что
получение брутто-формуль! продукта
требует некоторых предварительных
сведений о ве ществе, таких, как
температуры кипения или плавления,
летучести, растворимости и т. д.
На
практике формулировки задач включают
различные сведения, составляющие
«предысторию» проблемы. Привлечение
этих
сведений обычно поз во*
ляет
существенно ограничить число гипотез
и ускорить процедуру решения. Одна из
таких практических формулировок
рассматривается ниже.
Формулировка
проблемы [1]. При нагревании |3-этокси
альдегид а (I) с NH4H2PO4
при
160—190°С с выходом ~45% образуется соединение,
имеющее следующие характеристики: т.
кип. 50—52°С (20 мм рт. ст.), п20а
=
1,4422. Соответствующее ему
2,4-динитрофеиилгидразиновое производное
имеет т. пл. 143—144°С. Соединение обнаруживает
единственный пик на газожидкостной
хроматограмме и, следовательно, является
химически индивидуальным. Требуется
установить химическую структуру
соединения.
Выдвижение
гипотез. Можно предполагать на основании
известных литературных данных, что
нагревание 3-этоксигексаналя в
присутствии
NH4H2PO4
сопровождается
реакцией 1,2-отщепления
R
(ОСаНв)
CH-CH2CHO~nh‘»?po<
->
С2Н5ОН
+ RCH=CHCHO,
(I)
где
R—С3Н7.
Указанный
процесс относится к бимолекулярным
реакциям типа
Е2,
которые в большинстве случаев являются
стереоспецифическими. З-Этокси- гексаналь
может быть представлен тремя ротамерами:
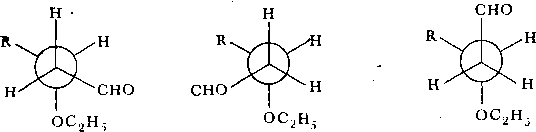
Обычно
эти реакции происходят при трансоидном
расположении отщепляющихся групп
(в данном случае атома водорода и группы
О—С2Н5).
Трансоид-
‘ная конфигурация Н и ОС2Н5
реализуется в ротамерах а
и б. В
результате отрыва этих групп образуются
непредельные альдегиды, причем ротамер
а
приводит к траяс-изомеру, а ротамер
б
— к циснизомеру:
Mr”
_
R
к’
Т^сно
н
R н
н/с=°ч
н
СИ©
СНО
Ж
н
СНО-
СНО
>
и
н
н
ос2н5
Таким
образом, в качестве продуктов реакции
можно ожидать образования цис-
или транс-гексеи-2-аля.
Решение задачи сводится к выбору одной
из двух гипотез, что требует 1
бит информации в предположении
равновероятности гипотез.
Правомерно
поставить следующий вопрос: каковы
априорные вероятности каждой из гипотез?
Можно предположить, что вероятности
образования изомеров определяются
энергиями ротамеров а и б.
Поскольку
вокруг связи С—С происходит быстрое
вращение, то энергии каждой из форм
будут определять также долю конформера
в равновесии трех
249
16
П. М. Сергеев
форм.
Механические модели показывают, что в
форме б
три объемистых заместителя С3Н7,
СНО и
ОС2Н5
оказываются
в максимально сближенных условиях,
что должно привести к дестабилизации
(т. е. повышению энергии) этой формы.
Таким образом, можно считать, что
образование цнс-нзомера значительно
менее вероятно.
Решение
задачи. Цис- и транс-нзомерные гексен-2-али
соответствуют двум гипотезам типа
Н213,
рассмотренным выше, в 4.2 и 4.3. Для выбора
одной из двух гипотез достаточно
воспользоваться фактором (фд), основанным
на значениях констант спин-спинового
взаимодействия между олефнновымн
протонами. Экспериментальная проверка,
проведенная с помощью обзорных спектров
ЯМР ‘Н (гл. 6,
рис. 6.9), показывает, что полученное
соединение является транс-изомером.
Этот вывод находится в соответствии с
оценками априорных вероятностей и,
таким образом, не является неожиданным.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #


