| Ортофосфат магния | |
|---|---|
  |
|
| Общие | |
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
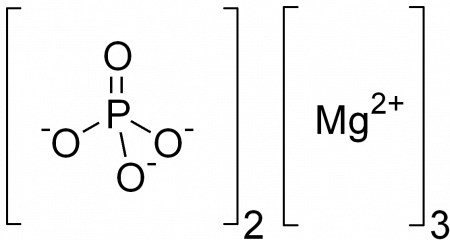
| Хим. формула | Mg3(PO4)2 |
| Физические свойства | |
| Молярная масса | 262,855 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 1357 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 3,9·10–26 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7757-87-1 |
| PubChem | 24439 |
| Рег. номер EINECS | 231-824-0 |
| SMILES |
[O-]P(=O)([O-])[O-].[O-]P(=O)([O-])[O-].[Mg+2].[Mg+2].[Mg+2] |
| InChI |
InChI=1S/3Mg.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 GVALZJMUIHGIMD-UHFFFAOYSA-H |
| Кодекс Алиментариус | E343 |
| ChEBI | 190298 |
| ChemSpider | 22847 |
| Безопасность | |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Ортофосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Получение[править | править код]
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
Применение[править | править код]
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии[1].
Ссылки[править | править код]
- MeSH Magnesium+phosphate
- B05XA10
- PubChem 24439
- PubChem 123955
Примечания[править | править код]
- ↑ В.Н.Тихонов. Аналитическая химия магния. — Москва: “Наука”, 1973. — С. 61-63.
Литература[править | править код]
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 1. — 560 с.
| Ортофосфат магния | |
|---|---|
 |
|
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
| Хим. формула | Mg3(PO4)2 |
| Молярная масса | 262,855 г/моль |
| Температура | |
| • плавления | 1357 °C |
| Растворимость | |
| • в воде | 3,9·10–26 г/100 мл |
| Рег. номер CAS | 7757-87-1 |
| PubChem | 24439 |
| Рег. номер EINECS | 231-824-0 |
| SMILES |
[O-]P(=O)([O-])[O-].[O-]P(=O)([O-])[O-].[Mg+2].[Mg+2].[Mg+2] |
| InChI |
1S/3Mg.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 GVALZJMUIHGIMD-UHFFFAOYSA-H |
| Кодекс Алиментариус | E343 |
| ChemSpider | 22847 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Содержание
- 1 Получение
- 2 Применение
Получение
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
-
- 3 MgSO4 + 2 Na2HPO4 + 2 NaHCO3 → Mg3(PO4)2 + 3 Na2SO4 + 2 CO2 + 2 H2O
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
-
- 3 MgO + Na4P2O7 →900oC Mg3(PO4)2 + 2 Na2O
Применение
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии.
Составьте формулу следующей соли:фосфат магния
-
- 0
-
-
- 0
-
Mg3(PO4)2 все эти цифры при письме маленькие
-
Комментариев (0)
-
- 0
-
Mg3(PO4)2
Фосфат магния или ортофосфат магния
-
Комментариев (0)
Ваш ответ
Светило науки – 3685 ответов – 38807 раз оказано помощи
1. Учим формулы кислот.
Если элемент стоит в четной группе, то в молекуле образованной им кислоты 2 атома водорода. если в нечетной , то 1 или 3 (как у фосфорной).
2. учим латинские названия элементов:
сера – сульфур
азот – нитрогениум
углерод – карбониум
кремний – силициум
3. названия солей происходят от латинских названий элементов
Если кислота серНАя, ее соли сульфАТЫ
если кислота сернИстая – ее соли сульфИты
сероводородная – сульфИДы
в любом случае, еслив формуле кислотного остатка нед кислорода – суффикс ИД
азотНАя – нитрАты
азотИстая – нитрИты
угольная – карбонаты
крнмниевая – силикаты
фосфорНАя – фосфАты
4. заряд кислотного остатка =числу атомов водорода в кислоте.
H2SO4 – кислотный остаток SO4 имеет заряд (2-)
H3PO4 – кислотный остаток PO4 имеет заряд (3-)
определяем заряд иона металла
он или указан в скобках, например, сульфат меди(II), или равер номеру группы, в которой стоит металл, например, Mg(2+)
5. определяем наименьщее общее кратное этих двух зарядов
например – фосфат магния: Mg(2+) и PO4 (3-) наименьшее общее кратное 6
6 делим на заряд магния – у магния появляется цифра 3, 6 делим на заряд фосфат-аниона- получаем 2. фосфат-анион берем в скобки, ставим 2 нижним индексом
Mg3(PO4)2
если заряды катиона и аниона совпадают, то никаких цифр на ставим
сульфат меди(II) -CuSO4
Magnesium phosphate, Mg3(PO4)2, is a mineral that can be found in bones, many plant seeds, and a variety of minerals. It’s used to supplement one’s diet with magnesium. The interaction of magnesium chloride or sulfate with the phosphate salt can produce tribasic magnesium phosphate. It’s simple to make the solution by stirring some salt with carbon dioxide-free water for several hours.
Magnesium Phosphate Formula
Magnesium phosphate has the chemical formula Mg3(PO4)2 and comprises the ions magnesium (Mg2+) and phosphate (PO3–4). Magnesium and phosphate ions are linked via an ionic connection. As a result, it is classified as an ionic compound.
Magnesium Phosphate Structure
Physical Properties of Magnesium Phosphate
The following are the physical properties of magnesium phosphate,
- Magnesium phosphate is a crystalline white powder.
- The majority of phosphate salts are water-soluble. Magnesium phosphate, on the other hand, is insoluble in water due to the fact that magnesium salts are normally insoluble in water. Magnesium cations are insoluble in most cases. It can be dissolved in salt solutions.
- Magnesium phosphate has a melting point of 1457K.
Chemical Properties of Magnesium Phosphate
The following are the chemical characteristics of magnesium phosphate,
- The reaction of Magnesium phosphate with Hydrochloric Acid: When magnesium phosphate combines with hydrochloric acid, it produces magnesium chloride salt and phosphoric acid. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
- The reaction of Magnesium phosphate with Sodium Hydroxide: Sodium phosphate and magnesium hydroxide are formed when magnesium phosphate interacts with sodium hydroxide. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Uses of Magnesium Phosphate
- Magnesium phosphate is mostly used in food as an acidity control.
- Fertilizers contain it.
- It’s a polishing agent for dentifrices.
- Cosmetics, shampoos, toothpaste, perfumes, and other products include it.
- It’s utilized as an adsorbent, a plastic stabilizer, and more.
- It’s also utilized in agricultural goods that aren’t pesticides.
- Vitamin E insufficiency is also treated with it.
- Magnesium phosphate is a nutritional supplement that helps people with magnesium insufficiency.
- It’s utilized as an anti-caking agent in cleaning products that contain silicate.
Sample Questions
Question 1: What is magnesium phosphate used for?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 2: What are the physical properties of magnesium phosphate?
Answer:
- Magnesium phosphate is a white powder with a crystalline structure.
- Water is soluble in the majority of phosphate salts. Magnesium phosphate, on the other hand, is water insoluble since magnesium salts are generally water insoluble. In most circumstances, magnesium cations are insoluble. Salt solutions can be used to dissolve it.
- The melting point of magnesium phosphate is 1457K.
Question 3: What will happen when Magnesium phosphate reacts with Sodium Hydroxide?
Answer:
When magnesium phosphate reacts with sodium hydroxide, sodium phosphate and magnesium hydroxide are produced.
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Question 4: What are the uses of Magnesium phosphate?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 5: What will happen when Magnesium phosphate reacts with Hydrochloric Acid?
Answer:
Magnesium phosphate creates magnesium chloride salt and phosphoric acid when it reacts with hydrochloric acid.
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
Question 6: When magnesium phosphate is combined with water, what happens?
Answer:
Magnesium phosphate undergoes a chemical reaction with water, yielding magnesium hydroxide and phosphoric acid as the end products.
Question 7: How many moles of magnesium phosphate Mg3(PO4)2 will contain 0.25 mole of oxygen atoms?
Answer:
There are 8 oxygen atoms in each molecule of magnesium phosphate. As a result, one mole of magnesium phosphate contains 8 moles of oxygen.
As a result, there are 0.25 moles of oxygen atoms in 1/8 × 0.25 = 3.125 × 10−2 moles of magnesium phosphate.
Last Updated :
13 Apr, 2022
Like Article
Save Article





