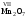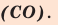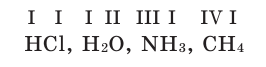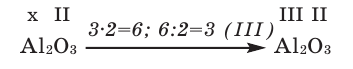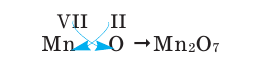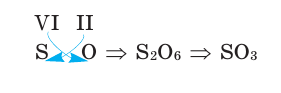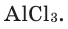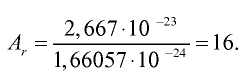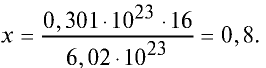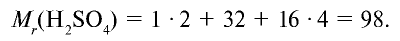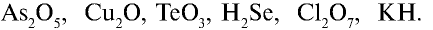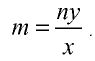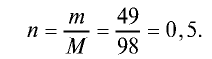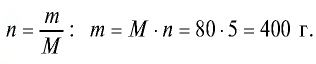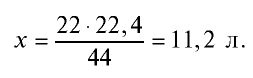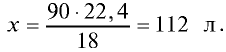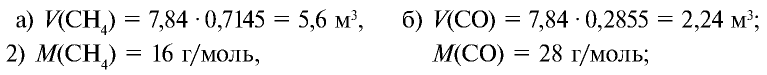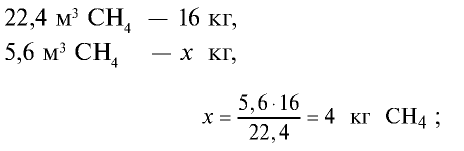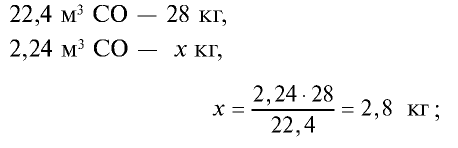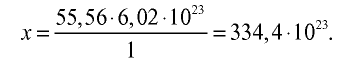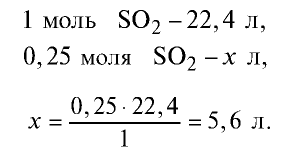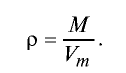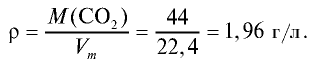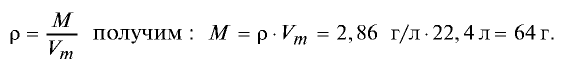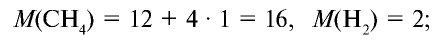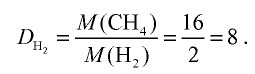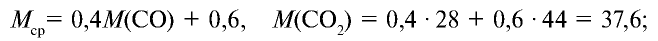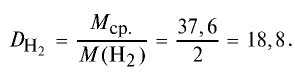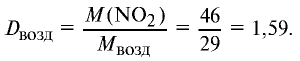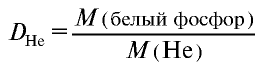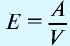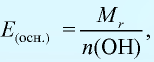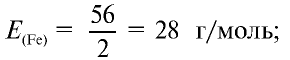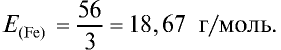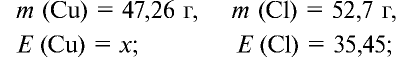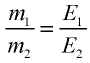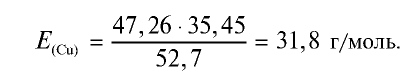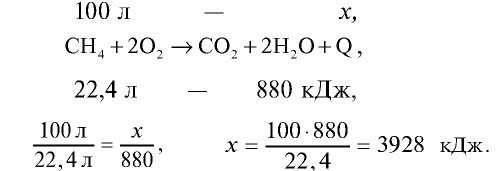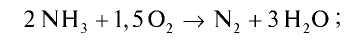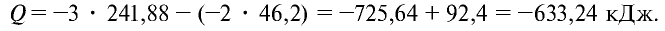Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
| Абсолютная атомная масса химического элемента
m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака
(произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
Исключение составляют:
- некоторые соединения азота с водородом (например, аммиак NH3, гидразин N2H4);
- соли органических кислот (например, формиат натрия HCOONa, ацетат кальция (CH3COO)2Ca);
- углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Например:
2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере CaCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 1023 молекул CaCO3 |
| Относительная молекулярная масса вещества (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
| Молярная масса вещества (M) | М(CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе): | Состав карбоната кальция по массе:
W(Ca) = (n(Ca)·Ar(Ca))/Mr(CaCO3) = (1·40)/100= 0,4 (40%) W(C) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (1·12)/100= 0,12 (12%) W(О) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (3·16)/100= 0,48 (48%) |
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: | Молекула СаСО3 состоит из иона Са2+ и иона СО32-
1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионов СО32-; 1 моль (100г) карбоната кальция содержит 40г ионов Са2+ и 60г ионов СО32- |
| Молярный объем вещества при нормальных условиях (только для газов) |
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными.
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:
Автор:
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Вы знаете, чем простые вещества отличаются от сложных? Напомню, что молекулы простых веществ состоят из атомов одного вида (сера S, золото Au, кислород O2), а сложные – из атомов разных видов (вода Н2О, фосфорная кислота Н3РО4, этиловый спирт С2Н5ОН). Тут резонно задать вопросом, а почему атомы не соединятся один с одним, ведь так всё будет гораздо проще, мы получим вещества с формулами вида НО, HS, CaOH и так далее. Но это решительно невозможно потому, что в дело вступает валентность.
Напомню, что валентность – это способность атома образовывать химическую связь. Вот представьте, что атом водорода хочет соединиться с атомом кислорода (это будет вода). И тут проблема:
водород всегда имеет валентность I, а кислород всегда имеет валентность II.
Это означает, что один атом водорода может образовать только одну связь и не больше. А атому кислорода подавай две и не меньше! Как же быть? А давайте-ка одному предложим соединиться с двумя атомами водорода. Это будет выглядеть так: Н-О-Н. Здесь тире означает ту самую химическую связь. И, как видно из этой простой схемы, все счастливы: каждый атом водорода получил одну связь, а единственный атом кислорода радостно образовал две. Таким образом, формула воды Н2О.
Перед тем, как мы начнём тренироваться, нужно запомнить две принципиально важные вещи. Мы их рассмотрим на примере оксида алюминия:
1. Валентность пишется над знаком элемента и всегда римскими цифрами. Валентность никогда не может быть дробной, это всегда целое число. Просто потому, что атома связаны одной, двумя, тремя связями. Атомы не могут быть связаны полутора, двумя с половиной или тремя четвертями связей.
2. Рядом со знаком элемента внизу справа находится индекс. Это важно запомнить! Индекс (он пишется привычной арабской цифрой) показывает, сколько атомов данного вида входит в молекулу. В нашем примере мы видим, что в молекуле оксида алюминия имеется два атома алюминия (справа внизу от знака алюминия цифра 2) и три атома кислорода (справа внизу от знака кислорода цифра 3). Индекс всегда целое число! Потому что в молекулу не может входит половина атома или полтора атома. Представьте для наглядности, что молекула – это семья, где есть родственники. В семье же не может быть две с половиной бабушки или полтора брата. По крайней мере, я таких не видела.
А теперь тренировка
Учитель химии просит
составить формулу вещества, при этом валентность атомов известна.
Напомню, что некоторые атомы, склонные к постоянству, всегда имеют одинаковую валентность. Она определяется группой, в которой атом стоит в таблице Менделеева. Так, металлы основной подгруппы первой группы всегда имеют валентность I, второй – II, третьей – III. Элементы основной подгруппы седьмой группы имеют валентность I (пока просто запомните это). Итак, нам нужно составить формулу оксида натрия. Сразу понимаем, что молекула состоит из атомов натрия и кислорода. Записываем это: NaO. Теперь вспоминаем про валентность (без неё никак): натрий – элемент основной подгруппы первой группы, имеющий валентность I, кислород тоже постоянен в привычках и имеет валентность II. Записываем и это:
Обратите внимание, что пока индексы обозначены X и Y, ведь мы же их не знаем. Репетитор по химии расскажет, что нужно найти наименьшее кратное и будет говорить всякие другие страшные слова, но мы будем действовать проще. Поставьте валентность по диагонали, превратив их в арабские цифры:
Смотрите, что произошло. Валентность кислорода II. Мы превращаем её в арабскую 2 и переносим по диагонали к натрию. Валентность натрия I. Мы превращаем её в арабскую 1 и переносим к кислороду. Вы скажете, что справа внизу от кислорода нет никаких единиц, в чём дело? А дело в том, что если в молекуле уже есть атом, то понятно, что он есть и он один. Мы же в формуле указали, что кислород присутствует, значит, он и есть в единственном числе. Таким образом формула оксида натрия Na2О.
Другой случай. Нам нужна формула оксида цинка. Кислород с валентностью II встречается с цинком, который тоже всегда имеет валентность II. Это идеальная пара, смотрите:
Цинк образует две связи и кислород образует две связи, значит, им больше ничего не нужно, эти два атома свяжутся друг с другом с помощью двух связей. Не надо ничего переносить по диагонали, достаточно понять, что если валентности равны, то атомы соединяются один к одному, то есть формула оксида цинка ZnO.
Теперь разберём пример посложнее. В учебнике химии задание: составить формулу оксида железа (III). Обратите внимание, что тут указана валентность железа. Так пишут в случае, когда элемент может обладать разной валентность. Например, желез может быть двухвалентным или трёхвалентным. Чтобы было понятно, о каком именно идёт речь, валентность указывают в скобках. Итак, действуем привычным способом:
Что мы видим? Валентности, увы, разные, следовательно атомы не соединяются один к одному. Тогда без колебаний действуем как в первом примере: используем перенос по диагонали. Валентность железа III превращаем в арабскую 3 и приписываем справа внизу к кислороду. Валентность кислорода II превращаем в арабскую 2 и приписываем внизу справа к железу. Вуаля!
Вот так симпатично и выглядит оксид железа (III) Fe2О3!
Продолжаем. Хотите узнать формулу оксида серы (VI)? Это просто. Давайте сразу запишем:
Тут придётся слегка напрячься. По идее мы можем сделать перенос по диагонали и получить формулу S2О6. Но это неверно, будьте внимательны! Дело в том, что в такой куче получается слишком много атомов, а ведь их можно просто уменьшить в два раза, получив более простую (и правильную!) формулу SО3.
Ну и в заключение ещё один пример, который может встретиться в контрольной по химии. Как выглядит оксид азота (V)? Азот, кстати, тоже любит хулиганить и выступать с разной валентностью. Конкретно в этом случае у него валентность V. Думаю, теперь уже без заумных пояснений понятно, что формула будет такой:
Ура!
Но спешу вас немного огорчить: пока мы натренировались составлять формулы, если известна валентность. В следующий раз мы будет решать обратную задачу: зная формулу, будем определять валентность. Это уже гораздо проще, так что готовьте чай и печеньки.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Алгоритмы составления химических формул
Составлениехимических формул для соединений двуххимических элементов в тех случаях,когда для каждого элемента существуеттолько одна стехиометрическая валентность.
| Алгоритм действия | Составление химической формулы оксида алюминия | |
| Установление (по названию соединения) химических символов элементов | Аl | О |
| Определение валентности атомов элементов | АIII | ОII |
| Вычисление наименьшего общего кратного | 6 | |
| Определение дополнительных множителей | 2 | 3 |
| Указание числового отношения атомов в соединении | 2 : 3 | |
| Указание стехиометрических индексов | Аl2 | О3 |
| Составление формулы | Аl2О3 |
Составлениехимических формул для соединений,которые существуют в водном растворев виде ионов.
| Алгоритм действия | Составление химической формулы сульфата алюминия | |
| Установление (по названию соединения) химических формул ионов | Аl3+ | SО42– |
| Определение числа зарядов ионов | 3 | 2 |
| Вычисление наименьшего общего кратного | 6 | |
| Определение дополнительных множителей | 2 | 3 |
| Указание числового отношения ионов | 2 : 3 | |
| Указание стехиометрических индексов | Аl2 | (SО4)3 |
| Составление формулы | Аl2(SО4)3 |
Написание химических формул
Дляуказания в химических формулахстехиометрических индексов и зарядовионов существуют следующие правила.
1. Еслистехиометрический индекс относится кгруппе атомов, обозначающие эту группухимические символы ставятся в скобки:
С3Н5(ОН)3– в молекуле глицерина содержатся 3гидроксигруппы;
Ca(NО3)2– в формульной единице нитрата кальциясодержатся ионы кальция и нитрат-ионыв соотношении 1 : 2.
2.Данные о заряде сложного многоатомногоиона в химической формуле относятся ковсему иону:
SО42– – сульфат-ион – имеет двухкратныйотрицательный заряд;
NН4+ – ион аммония – имеет одинарныйположительный заряд.
3.Химическая формула комплексного ионаставится в квадратные скобки, за которымиуказывается его заряд; она состоит из:
– химическогосимвола центрального атома;
– химической формулы лиганда в круглых скобках;
– нижнегоиндекса, указывающего число лигандов.
[Fe(CN)6]4–– гексацианоферрат(II)-ион; в имеющемчетыре отрицательных заряда ионе шестьлигандов СN–(цианид-ион) связаны с центральным атомомFеII(катион железа Fe2+).
[Cu(NH3)4]2+–ион тетраамминмеди (II); в имеющем дваположи-тельных заряда ионе четырелиганда NH3(молекула аммиака) связаны с центральныматомом меди (ион Сu2+).
4.Химическая формула воды в гидратах икристаллогидратах отделяется точкойот химической формулы основноговещества.
CuSO4· 5H2O– пентагидрат сульфата меди (II)(медный купорос).
Классификация неорганических веществ и их свойства
Всенеорганические вещества делятся напростые и сложные.
Простыевещества подразделяются на металлы,неметаллы и инертные газы.
Важнейшимиклассами сложных неорганических веществявляются: оксиды,основания, кислоты, амфотерные гидрооксиды,соли.
Оксиды—это соединения двух элементов, один изкоторых кислород. Общая формулаоксидов:
ЭmOn
где m–числоатомов элемента Э;
n– число атомов кислорода.
Примерыоксидов: К2О,CaO,SO2,P2O5
Основания– это сложные вещества, молекулы которыхсостоят из атома металла и одной илинескольких гидроксидных групп – ОН.Общая формула оснований:
Me(ОН)y
где у– числогидроксидных групп, равное валентностиметалла (Me).
Примерыоснований: NaOH,Ca(OH)2,Со(ОН)3
Кислоты—это сложные вещества, содержащие атомыводорода, которые могут замещатьсяатомами металла.
Общаяформула кислот
НхАсу
где Ас – кислотный остаток (от англ., acid– кислота);
х– числоатомов водорода, равное валентностикислотного остатка.
Примерыкислот: НС1, HNO3,H2SO4,H3PO4
Амфотерныегидроксиды– это сложные вещества, которые имеютсвойства кислот и свойства оснований.Поэтому формулы амфотерных гидроксидовможно записывать в форме основанийи в форме кислот. Примеры амфотерныхгидроксидов:
Zn(OH)2= H2ZnO2
Al(OH)3= H3AlO3
форма форма
оснований кислот
Соли– это сложные вещества, которые являютсяпродуктами замещения атомов водородав молекулах кислот атомами металла илипродуктами замещения гидроксидныхгрупп в молекулах оснований кислотнымиостатками. Например:
| Са(ОН)2 основание | Са(NО3)2 соль |
Составнормальных солей выражается общейформулой:
Мех(Ас)у
где х— числоатомов металла; у—число кислотных остатков.
Примерысолей: K3PO4;MgSO4;Al2(SO)3;FeCl3.
Оксиды
| Название оксида | = | «Оксид» | + | Название элемента (в род, пад.) | + | Валентность элемента (римскими цифрами) |
Например:СО – оксид углерода (II)– (читается: «оксид углерода два»);СО2– оксид углерода (IV);Fe2O3– оксид железа (III).
Еслиэлемент имеет постоянную валентность,ее в названии оксида не указывают.Например: Nа2О– оксид натрия; Аl2О3– оксид алюминия.
Классификация
Всеоксиды делятся на солеобразующие и несолеобразующие (или индифферентные).
Несолеобразующие(индифферентные) оксиды— это оксиды, которые не образуютсолей при взаимодействии с кислотамии основаниями. Их немного. Запомнитечетыре несолеобразующих оксида: СО,SiO,N2O,NO.
Солеобразующиеоксиды— это оксиды, которые образуют солипри взаимодействии с кислотами илиоснованиями. Например:
Na2O+ 2НС1 = 2NaCl+ Н 2О
оксид кислота соль
| SO3 | + | 2NaOH | = | Na2SO4 | + | Н2О |
| оксид | основание | соль |
Многиесолеобразующие оксиды взаимодействуютс водой. Продукты взаимодействия оксидовс водой называются гидратами оксидов(или гидроксидами). Например:
| Na2O | = | H2O | + | 2NaOH |
| оксид | гидроксид |
Некоторыеоксиды с водой не взаимодействуют, ноим соответствуют гидроксиды, которыеможно получить косвенным (непрямым)путем. В зависимости от характерасоответствующих гидроксидов всесолеобразующие оксиды делятся на тритипа: основные, кислотные, амфотерные.
Основныеоксиды— это оксиды, гидраты которых являютсяоснованиями. Например:
| Основные оксиды | Основания |
Всеосновные оксиды являются оксидамиметаллов.
Кислотныеоксиды— это оксиды, гидраты которых являютсякислотами. Например:
Большинствокислотных оксидов являются оксидаминеметаллов. Кислотными оксидамиявляются также оксиды некоторых металловс высокой валентностью. Например: ,
Амфотерныеоксиды— это оксиды, которым соответствуютамфотерные гидроксиды.
Всеамфотерные оксиды являются оксидамиметаллов.
Следовательно,неметаллыобразуют только кислотныеоксиды;металлыобразуютвсе основные,все амфотерныеи некоторые кислотныеоксиды.
Всеоксиды одновалентныхметаллов (Na2O,K2O,Cu2Oи др.) являются основными. Большинствооксидов двухвалентныхметаллов (CaO,BaO,FeOи др.) также являются основными.
Исключения:BeO,ZnO,PbO,SnO,которые являются амфотерными. Большинствооксидов трех-ичетырехвалентныхметаллов являютсяамфотерными: ,,,,и др. Оксиды металлов свалентностью V, VI, VII.
являются кислотными: ,,идр.
Металлыс переменной валентностью могутобразовывать оксиды всех трех типов.
Например:СrО – основный оксид, Сr2О3– амфотерный оксид, СrО3– кислотный оксид.
Графическиеформулы
Вмолекуле оксида атом металла непосредственносоединяется с атомами кислорода.
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
| Абсолютная атомная масса химического элемента
m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака
(произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
Исключение составляют:
- некоторые соединения азота с водородом (например, аммиакNH3, гидразинN2H4);
- соли органических кислот (например, формиат натрияHCOONa, ацетат кальция(CH3COO)2Ca);
- углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Например:
2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере CaCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 1023 молекул CaCO3 |
| Относительная молекулярная масса вещества (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
| Молярная масса вещества (M) | М(CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе): | Состав карбоната кальция по массе:
W(Ca) = (n(Ca)·Ar(Ca))/Mr(CaCO3) = (1·40)/100= 0,4 (40%) W(C) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (1·12)/100= 0,12 (12%) W(О) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (3·16)/100= 0,48 (48%) |
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: | Молекула СаСО3 состоит из иона Са2+ и иона СО32-
1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионов СО32-; 1 моль (100г) карбоната кальция содержит 40г ионов Са2+ и 60г ионов СО32- |
| Молярный объем вещества при нормальных условиях (только для газов) |
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными.
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками.
Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:
Метельский А.В.
Дата в источнике: 1999 год
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



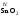
V,
VI,
VII
.являются
кислотными:
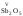


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
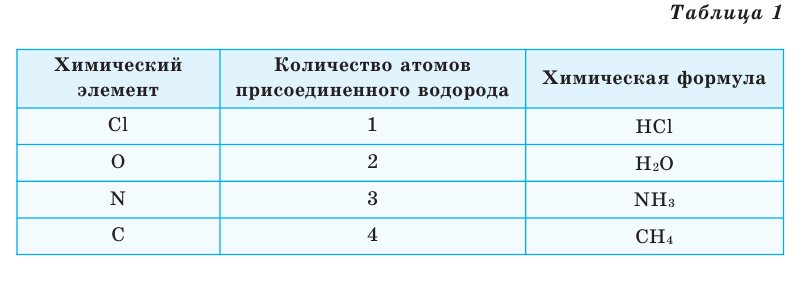
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 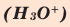
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
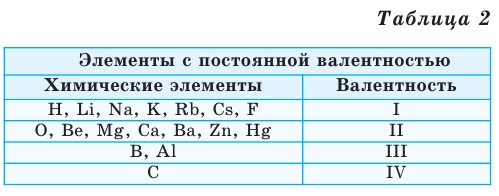
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
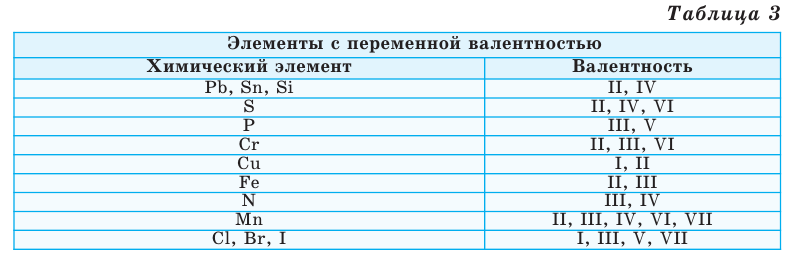
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 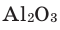
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
Химическая формула
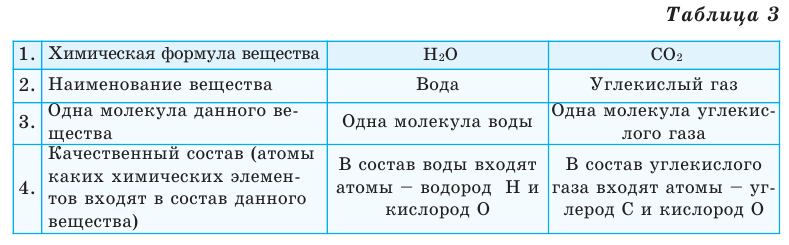
Заполните таблицу. Как произносится химическая формула вещества?
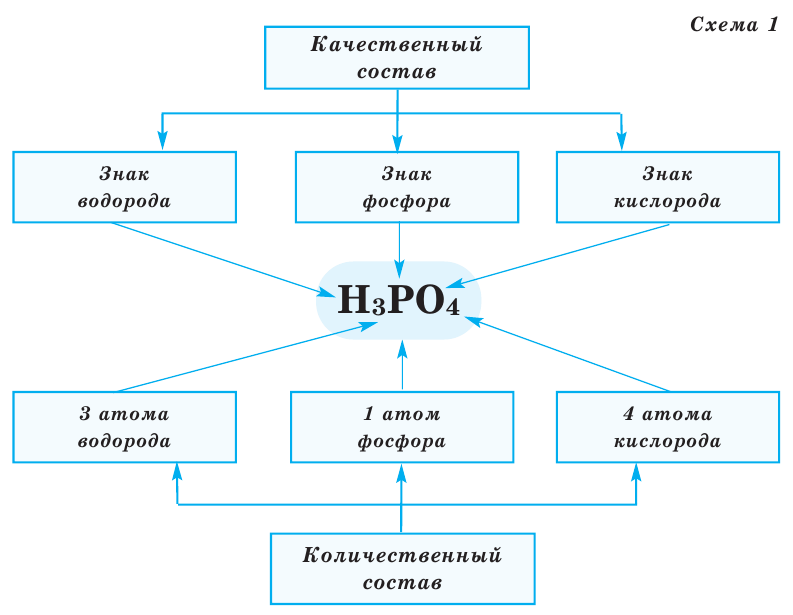
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
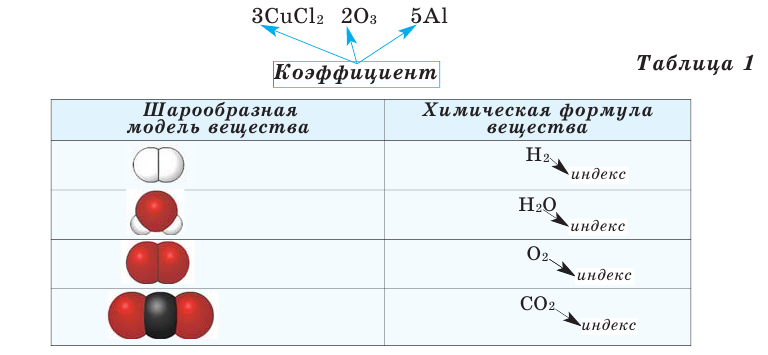
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза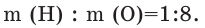
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 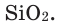

Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium (“образующий воду”).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•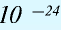

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 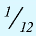
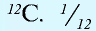
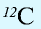

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02•
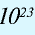
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 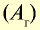 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ: 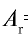
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 •
Тогда, если 6,02 • 

Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 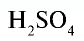
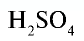
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (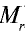
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (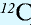
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 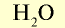 |
18 | 1 | 6,02• |
| Углекислый газ | 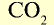 |
44 | 1 | 6,02• |
| Серная кислота | 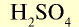 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 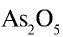
2) 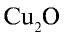
3) 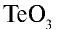
4) 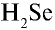
5) 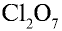
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 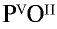
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – 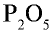
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 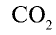
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 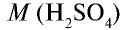
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество |  |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
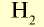 |
2 | 2 | 22,4 | 6,02• |
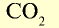 |
44 | 44 | 22,4 | 6,02• |
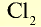 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 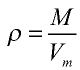
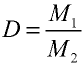
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 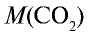
2) вычислим объем 22 г 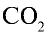
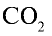
Ответ: 22 г 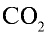
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
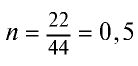
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(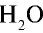
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 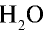
90г 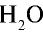
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{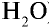
2) вычислим количество вещества в 1000 г воды:
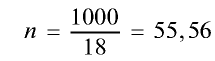
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02•
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
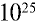
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 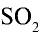
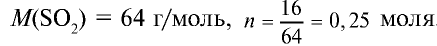
2) вычислим, какой объем займут 16 г (или 0,25 моля) 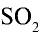
Ответ: 16 г 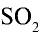
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(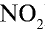
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = 
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 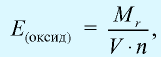
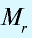
Эквивалентность оснований выражается формулой:
где 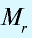
Эквивалентность кислот выражается формулой: 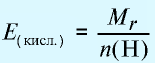
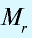
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 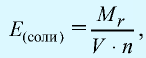
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 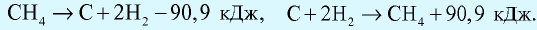
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии