Гальванический
элемент –
это химический
источник тока,
в котором энергия,
выделяющаяся при протекании на электродах
окислительно-восстановительной
реакции,
непосредственно преобразуется в
электрическую энергию.
Принцип
работы гальванического элемента можно
рассмотреть на примере элемента Даниэля
–
Якоби (рис 9.2).

Рис.
9.2. Схема гальванического элемента
Даниэля –
Якоби
Здесь
I
– стакан, содержащий раствор ZnSO4
в воде с погруженной в него цинковой
пластинкой; II
– стакан, содержащий раствор CuSO4
в воде с погруженной в него медной
пластинкой; III
– солевой мостик (электролитический
ключ), который обеспечивает перемещение
катионов и анионов между растворами;
IV
– вольтметр (нужен для измерения ЭДС,
но в состав гальванического элемента
не входит).
Стандартный
электродный потенциал цинкового
электрода
![]() .
.
Стандартный электродный потенциал
медного электрода
![]() .
.
Так как![]() ,
,
то атомы цинка будут окисляться:
|
Zn– 2ē =Zn2+. |
(а) |
Электрод, на
котором идет реакция окисления или
который посылает катионы в электролит,
называется анодом. У рассматриваемого
гальванического элемента в роли анода
выступаетцинковыйэлектрод. Так
как стандартный электродный потенциал
цинка ниже, чем у меди, цинковому
электроду приписывается условный заряд
«–», а медному – «+».
Электроны,
освободившиеся в результате окисления,
по внешней цепи переходят на медь
(возникает электрический ток).
На медном
электроде происходит процесс
восстановления катионов электролитаCu2+:
|
Cu2++2ē =Cu. |
(б) |
Электрод, на
котором идет реакция восстановления
или который принимает катионы
из электролита, называется катодом.
Через
электролитический ключ происходит
движение ионов в растворе: анионов
SO42– к аноду,
катионовZn2+к
катоду. Движение ионов в растворе
замыкает электрическую цепь гальванического
элемента.
Реакции (а) и
(б) называются электродными реакциями.
Складывая уравнения процессов,
протекающих на электродах, получаем
суммарное уравнение окислительно-восстановительной
реакции, протекающей в гальваническом
элементе:
|
Zn+Cu2+=Zn2++Cu |
(в) |
или,
с учетом анионов раствора:
|
Zn + CuSO4= |
(г) |
В общем случае,
суммарное уравнение окислительно-восстановительной
реакции, протекающей в произвольном
гальваническом элементе, можно
представить в виде:
|
MeА+ MeКn+MeАn++ MeК, |
(д) |
где индексы А и
К относятся к металлам анода и катода
соответственно.
Реакции (в) –
(д) называются токообразующими
реакциями.
Символическая запись (схема) гальванического
элемента имеет вид:

Часто
вместо растворов обозначают только
катионы, содержащиеся в растворе:
|
|
(9.3) |
Схема
гальванического элемента Даниэля– Якоби имеет
вид:
Zn| ZnSO4
||CuSO4|Cu
Максимальная
разность потенциалов электродов,
которая может быть получена при работе
гальванического элемента, называется
электродвижущей силой(ЭДС) элементаЕ. Она вычисляется по формуле;
|
Е = φк– φа, |
(9.4) |
где
φк
и φа –
электродные потенциалы катода и анода
соответственно.
Величина ЭДС
элемента Даниэля – Якоби при стандартных
условиях равна:
Е= +0,34 – (–0,76) = 1,10 В.
Электродвижущая
сила Ехарактеризует способность
гальванического элемента совершать
электрическую работу во внешней цепи.
Электрическая
работа определяется максимальной
полезной работой, совершаемой химической
реакцией, которая равна изменению
изобарно-изотермического потенциала
∆Gпроцесса. Связь между величиной ∆Gи ЭДС описывается уравнением:
|
∆G= –nFE, |
(9.5) |
где
n
– число электронов в элементарном
окислительно-восстановительном акте,
F
– число Фарадея.
Величина
изменения изобарно-изотермического
потенциала токообразующей реакции
при стандартных условиях
∆G0связана
с константой равновесия этой реакцииКравнсоотношением
|
|
(9.6) |
Гальванические
элементы являются первичными (однократно
используемыми) химическими источниками
тока (ХИТ). Вторичными (многократно
используемыми) ХИТ являются аккумуляторы.
Процессы, протекающие при разряде и
заряде аккумуляторов, взаимнообратны.
Гальванические
элементы, у которых электроды выполнены
из одного и того же металла и опущены
в растворы своих солей разной концентрации,
называются концентрационными.
Функцию анода в таких элементах выполняет
металл, опущенный в раствор соли с
меньшей концентрацией, например:

Пример 1.Составьте схему гальванического
элемента, в основе которого лежит
реакция:Mg+ZnSO4
=MgSO4+Zn.Что является катодом
и анодом в этом элементе? Напишите
уравнения процессов, протекающих на
этих электродах. Рассчитайте ЭДС
элемента при стандартных условиях.
Вычислите константу равновесия для
токообразующей реакции.
Решение
В таблице находим
значения стандартных электродных
потенциалов систем Zn/Zn2+иMg/Mg2+
:
![]()
![]()
Поскольку
![]() ,
,
то магниевый электрод выполняет функцию
анода, а цинковый – катода. Схема
гальванического элемента имеет вид:
![]()
На аноде идет
процесс окисления:
![]()
На катоде –
восстановление катионов среды:
![]()
Стандартная
ЭДС гальванического элемента
Е= φ0к– φ0а=
–0,763 – (–2,37) = 1,607 В.
По уравнениям
(9.5) и (9.6) вычислим константу равновесия
токообразующей реакции:
![]()
Потенцируя,
находим Кравн= 3,5 ∙1054.
Поскольку К>>1, то токообразующая реакция
практически необратима.
Пример 2.Составьте схему гальванического
элемента, состоящего из цинкового и
серебряного электродов, погруженных
в растворы их солей. Концентрации ионов
в растворах:CZn2+
= 0,1 моль/л,CAg+
= 0,01 моль/л. Укажите, какой электрод
является катодом, а какой – анодом.
Напишите уравнения реакций, протекающих
на электродах, а также суммарное
уравнение токообразующей реакции в
гальваническом элементе. Рассчитайте
ЭДС этого элемента.
Решение
Так как концентрации ионов не
равны единице, то вначале рассчитаем
потенциалы электродов, используя
формулу Нернста. Если в условии задачи
отсутствует значение температуры, то
ее принимают равной стандартной
температуре Т= 298 К. Поэтому будем
использовать уравнение (9.2):
![]()
Подставим
числовое значение концентрации в
формулу Нернста, используя данные
таблицы 9.1:
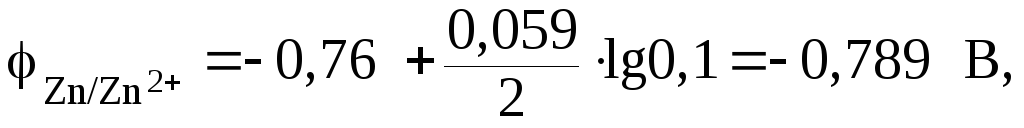

Из расчета
видно, что
![]() .
.
Поэтому цинковый электрод выполняет
функцию анода, а серебряный – катода.
Схема
гальванического элемента:
![]()
Вычислим ЭДС
элемента по формуле (9.4):
Е= φк– φа = 0,741 –
(-0,789) = 1,530 В.
Теперь запишем
электродные реакции. На аноде происходит
процесс окисления:
![]()
а
на катоде – процесс восстановления:
![]()
Складывая
уравнения электродных процессов (с
учетом равенства числа принимаемых и
отдаваемых электронов), получаем
суммарное уравнение токообразующей
реакции: Zn+ 2Ag+=Zn2++ 2Ag.
Задачи
221–226Напишите уравнения катодного и анодного
процессов и составьте схему гальванического
элемента, при работе которого протекает
следующая реакция (см. таблицу). На
основании значений стандартных
электродных потенциалов рассчитайте
константу равновесия данной реакции
и ЭДС элемента.
|
№ задачи |
Реакция |
Ответ |
|
221 |
Sn |
Кр |
|
222 |
Zn |
Кр |
|
223 |
Zn |
Кр |
|
224 |
Ni |
Кр |
|
225 |
Zn |
Кр |
|
226 |
Mg |
Кр |
227–233 Рассчитайте значения
электродных потенциалов металла,
являющегося анодом, при различных
концентрациях раствора: 10; 0,1; 0,01; 0,001
моль/л. Концентрация раствора, в который
погружен катод, постоянна и равна 1
моль/л. Определите ЭДС.
Постройте
график зависимости ЭДС гальванического
элемента от логарифма концентрации
раствора, в который погружен анод.
Напишите уравнение токообразующей
реакции, протекающей в гальваническом
элементе.
|
№ задачи |
Гальванический |
|
227 |
Ni|Ni2+ |
|
228 |
Zn |
|
229 |
H2|2H+||Cu2+|Cu |
|
230 |
Mg| |
|
231 |
Al|Al3+||Fe2+|Fe |
|
232 |
Zn |
|
233 |
Mg| |
234–236Одним
из электродов гальванического элемента
является металл (см. таблицу), погруженный
в раствор своей соли с концентрацией
ионов 0,01 моль/л, а другим – водородный
электрод. ЭДС этого элемента составляетЕ, В. Напишите уравнения катодной
и анодной реакций, приведите схему
гальванического элемента. Рассчитайте
потенциал водородного электрода и
концентрацию ионов водорода в растворе.Т= 298K.
|
№ задачи |
металл |
Е, |
Ответ |
|
234 |
Zn |
0,701 |
0,01 |
|
235 |
Cu |
0,371 |
0,03 |
|
236 |
Ni |
0,250 |
0 |
237–240Запишите уравнения электродных реакций
и составьте схему гальванического
элемента, работа которого выражается
уравнением, представленным в таблице.
Укажите, какой электрод является катодом
и анодом. Рассчитайте значения электродных
потенциалов при концентрациях растворов
анодаС1и катодаС2(см. таблицу). Определите ЭДС этого
элемента.
|
№ задачи |
Реакция |
С1, моль/л |
С2, |
Ответы |
|
237 |
Fe |
0,01 |
0,1 |
1,24 |
|
238 |
Ni |
0,1 |
0,1 |
0,59 |
|
239 |
Mg |
1 |
0,01 |
2,184 |
|
240 |
Zn |
0,01 |
0,01 |
0,513 |
241–244Составьте схему гальванического
элемента, состоящего из двух металлов
Ме1и Ме2, погруженных в
раствор собственных солей с концентрацией
ионовС1иС2(см.
таблицу). Укажите, какой электрод
является катодом и анодом. Напишите
уравнения реакций, протекающих на
данных электродах, а также суммарное
уравнение токообразующей реакции в
гальваническом элементе. Рассчитайте
ЭДС этого элемента.
|
№ задачи |
Ме1 |
Ме2 |
С1, |
С2, |
Ответы |
|
241 |
Zn |
Ni |
0,01 |
0,01 |
0,51 |
|
242 |
Fe |
Cu |
0,1 |
0,01 |
0,75 В |
|
243 |
Fe |
Ag |
0,001 |
0,01 |
1,21 |
|
244 |
Mg |
Fe |
0,01 |
1 |
1,99 В |
245–247Рассчитайте
значения электродных потенциалов
металлов, приведенных в условии задачи,
при концентрациях растворовС1(для 1-го металла) иС2(для 2-го
металла). Определите анод и катод.
Вычислите ЭДС элемента.
Аналогичные расчеты проведите
для концентраций растворов, уменьшенных
в 10 раз. Изменится ли ЭДС?
Приведите
уравнения электродных реакций.
|
№ задачи |
Ме1 |
Ме2 |
С1, |
С2 |
Ответы |
|
245 |
Zn |
Cu |
0, 1 |
0, 1 |
1,10 В |
|
246 |
Al |
Ni |
0,1 |
0,01 |
1,41 В |
|
247 |
Mg |
Ni |
0,01 |
0,1 |
2,15 В |
248Какой гальванический
элемент называется концентрационным?
Составьте его схему. Напишите уравнения
анодного и катодного процессов, вычислите
ЭДС. Гальванический элемент состоит
из серебряных электродов, опущенных:
первый в 0,01 М, а второй в 0,1 М растворыAgNO3.
Ответ: 0,059 В.
249Составьте схему двух
гальванических элементов, в одном из
которых никель был бы анодом, в другом
– катодом. Напишите для каждого из них
уравнения реакций, протекающих на аноде
и на катоде, и рассчитайте ЭДС
гальванических элементов при стандартных
условиях. Изменится ли ЭДС этого
элемента, если концентрацию каждого
из ионов уменьшить в 10 раз?
250Железная и серебряная
пластины соединены внешним проводником
и погружены в раствор серной кислоты.
Составьте схему данного гальванического
элемента и напишите электронные
уравнения процессов, проходящих на
катоде и аноде.
Соседние файлы в папке Химия_очное
- #
- #
- #
- #
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:

В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.

Возникает так называемый двойной электрический слой.

Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:

На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:

Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.

Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
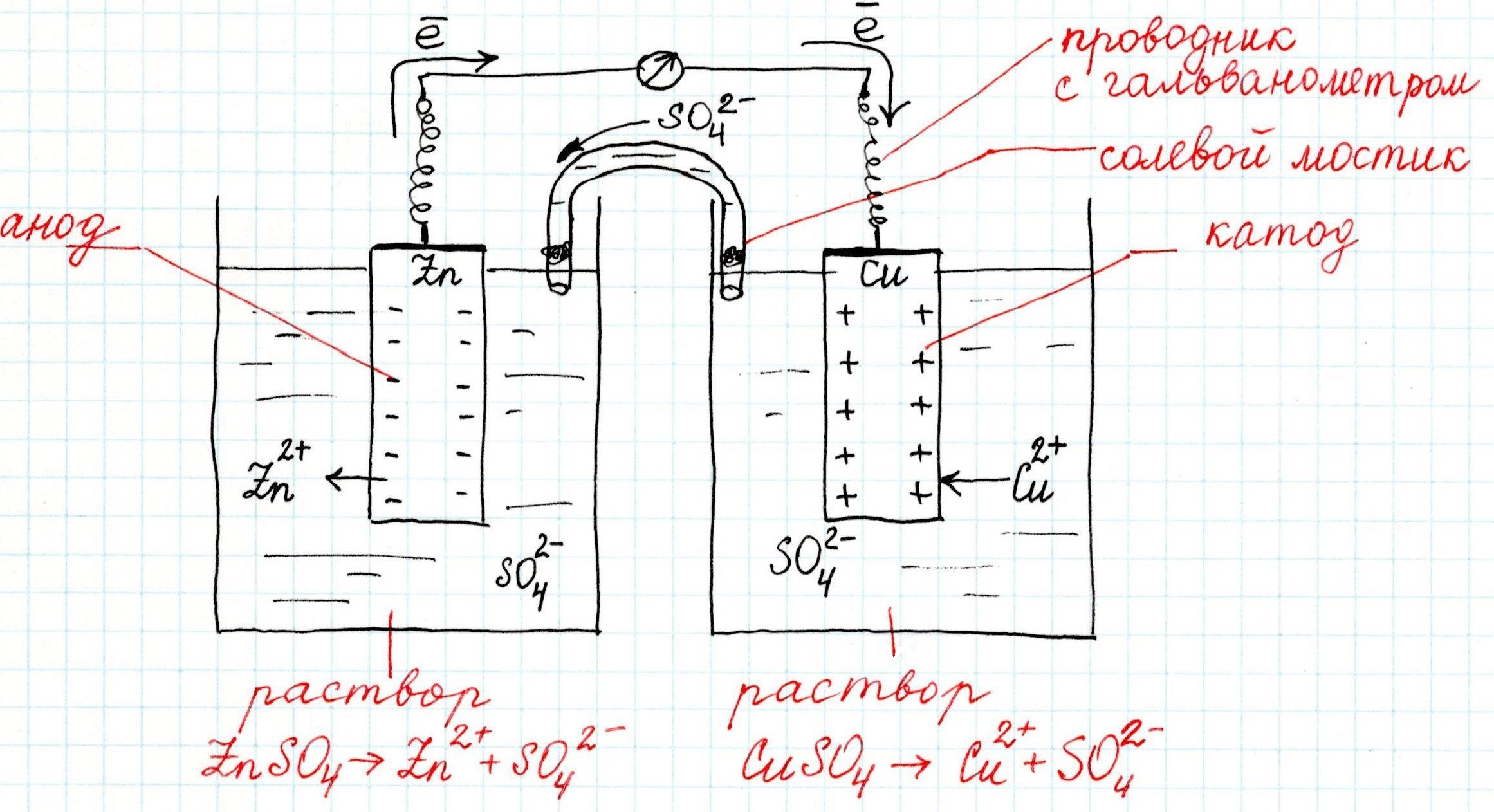
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):

Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):

Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:

Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
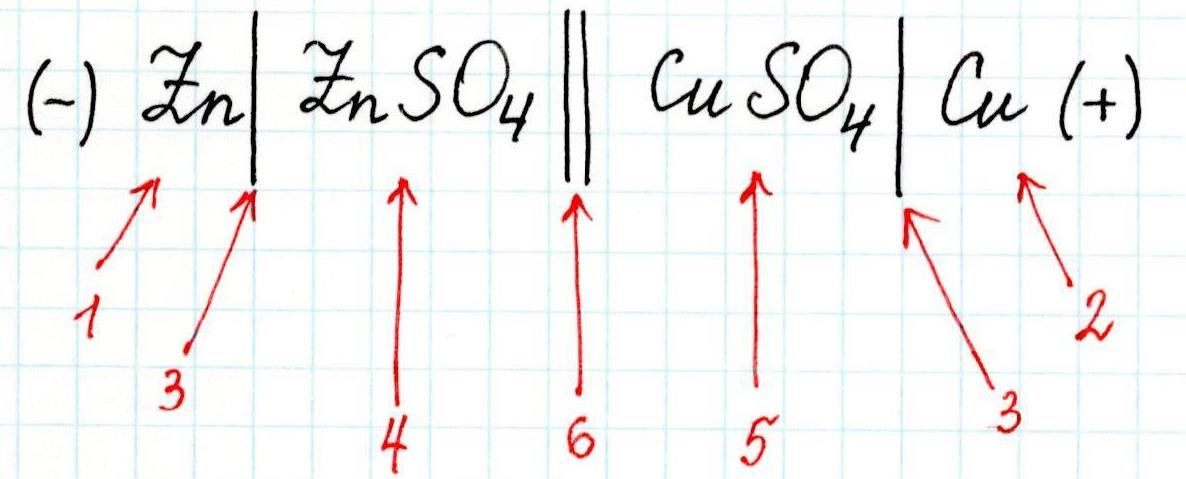
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:
 Решение:
Решение:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:
 Решение:
Решение:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Вы знаете, что такое электролиз? Да, это окислительно-восстановительный процесс, идущий под действием электрического тока. Конечно, с чего бы это вдруг сульфат меди в водном растворе стал разлагаться? Или расплав хлорида натрия, к примеру? А вот если пропустить через раствор или расплав электрический ток, то разложение любой соли, да и не только соли, происходит “на ура”. Электролиз протекает по своим законам. Они элементарны.
А вот что такое гальванический элемент и чем он отличается от электролизной ванны? А может, у них есть что-то общее? Разберёмся.
Гальванический элемент, а мы все знаем его по обычным батарейкам, топливным элементам, аккумуляторам сотовых телефонов и автомобильным аккумуляторам, это химический источник электрического тока. Электрический ток возникает в гальваническом элементе в результате протекания химической реакции. Поток электронов, переходящий от восстановителя к окислителю (помните электронный баланс?) движется по внешнему проводнику, то есть частично выводится из системы и питает потребителя, то есть используется во внешней цепи.
Другими словами, гальванический элемент — это устройство, в котором энергия окислительно-восстановительной химической реакции превращается в электрическую. Обратите внимание, при электролизе происходит обратный процесс – электрическая энергия превращается в энергию химической реакции. Понятно?
Самый простой гальванический элемент называется элементом Даниэля – Якоби и основан на очень простой окислительно-восстановительной реакции:
Zn + CuSO4 = ZnSO4 + Cu
Ну, вы знаете, цинковую пластинку помещают в голубой раствор сульфата меди, со временем голубой цвет исчезает, а цинковая пластинка покрывается розовым медным налётом. Окисляется цинк, его можно смело назвать анодом, а восстанавливается медь и она – катод.
Так вот, в гальваническом элементе анодное и катодное пространство разделены.
Металлическая пластинка, опущенная в раствор соли своего металла, называется электродом. Цинковый и медный электроды соединены внешним металлическим проводником, по которому электроны движутся от цинкового анода к медному катоду.
С другой стороны, нужен солевой мостик, по которому в обратном направлении перетекают сульфат-ионы. Потому что они становятся нужны в прианодном пространстве для сохранения баланса зарядов, ведь на катоде будет скапливаться избыточный отрицательный заряд, а на аноде – положительный. Этот заряд будет противодействовать потоку электронов и в какой-то момент (очень скоро) поток электронов прекратится и работа гальванического элемента остановится.
Солевой мостик в самом простом исполнении – это изогнутая полая трубочка, наполненная электролитом. Как на картинке выше. Однако, это может быть и мембрана, и пористый материал, и даже фильтровальная бумага – всё зависит от конструкции самого гальванического элемента. Задача солевого моста – обеспечить движение ионов и сохранять баланс зарядов внутри гальванического элемента.
(-) Zn | ZnSO4 || Cu | CuSO4 (+)
На аноде, как и в случае электролиза, происходит процесс окисления. Однако, заряд анода здесь – отрицательный. Катодный процесс – восстановление, но знак заряда катода – положительный.
В этом – отличие от электролиза.
Итак, разные задачи у электролиза и гальванического элемента – это разное их устройство. Но в основе и того, и другого – окислительно-восстановительная реакция и электродные процессы: катодный – восстановление и анодный – окисление.
Гальванические элементы могут быть разными, электрическая энергия может быть добыта с помощью самых разных окислительно-восстановительных процессов. Достаточно вспомнить лишь названия – свинцовый аккумулятор, литий-ионный аккумулятор, марганцево-цинковый элемент…
Вот так устроен обычный свинцовый аккумулятор:
Марганцево-цинковый элемент, его ещё называют элементом Лекланше, это химический источник тока, в котором катодом является диоксид марганца MnO2 в смеси с графитом (около 9,5 %), электролитом — раствор хлорида аммония NH4Cl, а анодом — металлический цинк. Вот как он устроен:
В наше время самыми распространёнными аккумуляторами являются литий-ионные элементы питания. Они везде – в сотовых телефонах, ноутбуках, цифровых фотоаппаратах, видеокамерах, электромобилях. Совсем недавно, в 2019 году трое учёных – Уиттингем, Гуденаф и Ёсино даже получили Нобелевскую премию по химии с формулировкой «За развитие литий-ионных аккумуляторов».
Устройство литий-ионного аккумулятора более сложное и тонкое. Во многом даже микроскопическое. Катодный материал помещён на алюминиевую фольгу, анодный – на медную. Катодное и анодное пространства разделены пористым сепаратором, пропитанным электролитом. Пакет электродов помещён в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъёмникам. Корпус часто оснащают предохранительным клапаном, сбрасывающим внутреннее давление при аварийных ситуациях или нарушениях условий эксплуатации. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет свойство внедряться в кристаллическую решётку других материалов (например, в графит, оксиды и соли металлов) с образованием химической связи, например: в графит с образованием LiC6, оксиды (LiMnO2) и соли металлов.
Вот так работают наши телефоны, компьютеры и прочие блага цивилизации. С помощью химических источников электрической энергии.
Составление схем гальванических элементов
Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[Al3+] = 0,0001 моль/л, [Аg+] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) – катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1 = Ag0
= Ag0
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Al0 – 3 = Al3+
= Al3+
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Al0 + 3Ag+ = 3Ag0 + Al3+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Тогда
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 – (-1,74) = +2,48 B.
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Mg/Mg2+//Al3+/Al
Или
Mg/MgCl2//AlCl3/Al
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) – катод, т. е. электрод, на котором протекает восстановительный процесс:
Al3+ + 3 = Al0
= Al0
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Mg0 – 2 = Mg2+
= Mg2+
Cуммарное уравнение процесса:
3Mg0 + 2Al3+ = 3Mg2+ + 2Al0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag+ + Cl– = AgCl. Рассчитать стандартную ЭДС элемента при 25o C,  Go и константу равновесия реакции.
Go и константу равновесия реакции.
Решение.
1. Схема гальванического элемента имеет вид:
Ag|AgCl|Cl–||Ag+|Ag
2. Электродные процессы:
Правый электрод: Ag+ +1 = Ag; Eo = +0,799 В;
= Ag; Eo = +0,799 В;
Левый электрод: AgCl + 1 = Ag+ + Cl– ; Eo = +0,222 В;
= Ag+ + Cl– ; Eo = +0,222 В;
Общая реакция: Ag+ + Cl– = AgCl; Eo = +0,557 В.
3. Рассчитаем энергию Гиббса процесса:
Для расчета  Go используем формулу:
Go используем формулу:
 Go = –nFEo, где
Go = –nFEo, где
n – количество электронов, участвующих в процессе, 1 электрон; F – универсальная газовая постоянная, 96485 Кл.моль-1; Eo – окислительно-восстановительный потенциал процесса, +0,557 В.
Тогда
 Go = –nFEo = -(96485 Кл.моль-1) . (0,557 В) = -53,742 кДж. моль-1.
Go = –nFEo = -(96485 Кл.моль-1) . (0,557 В) = -53,742 кДж. моль-1.
4. Расчет константы равновесия реакции:
Для расчета используем формулу:
К = exp– Go/RT = exp[ -53,742/(8,31 . 298,15)] = 2,6 . 109
Go/RT = exp[ -53,742/(8,31 . 298,15)] = 2,6 . 109
Свинцовую и цинковую пластины опустили в раствор нитрата серебра. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником? Напишите схему гальванического элемента.
Решение задачи
Запишем уравнения химических реакций, происходящих на пластинах.
Свинцовая пластина:
![]()
Pb0 – 2e– → Pb2+
Ag+ + e– → Ag+
Цинковая пластина:
![]()
Zn0 – 2e– → Zn2+
Ag+ + e– → Ag0
Если наружные концы пластин соединить проводником, образуется гальванический элемент.
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Составим схему гальванического элемента:
Zn │Zn(NO3)2 ║ Pb(NO3)2 │Pb
Сравним стандартные электродные потенциалы цинка (Zn) и свинца (Pb):
E0(Zn2+/Zn0) = – 0,76 В,
E0(Pb 2+/ Pb 0) = – 0,13 В.
Цинк (Zn) – металл, имеющий более отрицательное значение стандартного электродного потенциала и поэтому является более сильным восстановителем. Следовательно, цинк (Zn) будет подвергаться окислению под действием ионов свинца (Pb), и электроны от цинка (Zn) будут переходить к свинцу(Pb):
Таким образом, Zn – анод (А) и Zn – восстановитель, Pb – катод.
(–) Zn │Zn(NO3)2 ║ Pb(NO3)2 │Pb (+)
Электроны двигаются от цинка к свинцу. Схема гальванического элемента
Запишем электронные уравнения процессов, протекающих на электродах на пластинах, и составим суммарное уравнение:
(-) (А) Zn0 – 2e– → Zn2+ – процесс окисления
(+) (K) Ag+ + e– → Ag0 – процесс восстановления
Схема гальванического элемента
Вывод:
при замыкании пластин цинковая пластина растворяется, а на свинцовой пластине осаждается серебро.
