Методическая
разработка:
«Алгоритм
составления названий и формул оснований (гидроксидов)»
При изучении химии в 8 классе учащиеся
сталкиваются с затруднениями в названии химических веществ и составления формул
химических соединений. Для лучшего усвоения данного материала им помогут
«Алгоритмы» – краткая запись последовательности действий.
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ ОСНОВАНИЙ.
Основания – сложные химические вещества ,
состоящие из ионов металла связанных с гидроксогруппой (-ОН)
При названии оснований необходимо соблюдать
данную последовательность действий:
1. Дается
название последней части вещества – гидроксид.
2. Называется
металл, который связан с гидроксогруппой (-ОН), в родительном падеже (записан
перед гидроксогруппой).
3. Если
заряд металла переменный, в скобках указывается валентность металла.
Запомните: количество
гидроксогрупп равно заряду и валентности металла.
ПРИМЕР:
Fe( OH)2
гидроксид железа (ii)
Al(OH)3
гидроксид алюминия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ ОСНОВАНИЙ.
1.
Записываются символы металла и гидроксогруппы
(-ОН).
2.
Указывается заряд металла.
3.
Записывается индекс для гидроксогруппы. Если
заряд металла больше 1, гидроксогруппу заключают в скобки. Индекс указывается
за скобками.
ПРИМЕР:
Гидроксид
алюминия гидроксид меди (II)
1. Al OH
1.
Cu
OH
2. 3+
2.
2+
Al OH
Cu OH
3. Al
(OH)3
3. Cu
(OH)2
Сегодня поговорим об очень большой группе соединений, которые называются гидроксиды. Как говорит учебник химии,
гидроксид – это химическое соединение, в котором есть группа –ОН.
Собственно, именно по этому признаку и можно определить, что перед нами гидроксид: в нём всегда есть одна или несколько гидроксильных групп –ОН.
Также запомните, что есть понятие «щёлочь». К щелочам относят гидроксиды металлов щелочных (то есть стоящих в первой группе таблицы Менделеева в основной подгруппе), щёлочноземельных (то есть стоящих во второй группе таблицы Менделеева в основной подгруппе) и аммония NH4+.
В чём разница между гидроксидами и щелочами
Щёлочь – понятие более узкое, гидроксид – более широкое. То есть щёлочь – всегда гидроксид, но гидроксид – не всегда щёлочь.
Например, гидроксид натрия NaOH. Натрий находится в первой группе периодической таблицы, это щелочной металл. Поэтому NaOH – это щёлочь. Но если вы назовёте его гидроксидом, ошибкой это не будет.
Другой пример. Гидроксид меди (II) Сu(OH)2 – это гидроксид, но никак не щёлочь (посмотрите в таблицу Менделеева. Медь находится в первой группе, но не в основной, а в побочной! Медь – не щелочной металл!). То есть назвать Сu(OH)2 щёлочью будет ошибкой, это гидроксид.
Как составить формулу гидроксида
Первым делом вспоминаем про валентность, без неё в химии никуда. Далее нужно понять, что группа ОН – это цельная структурная единица. Составляя формулу, мы всегда заключаем её в скобки (если ОН группа одна, то скобки не нужны), а индекс, маленькая цифра внизу справа, относится ко всей гидроксильной группе.
Также сразу запомните, что
группа –ОН всегда имеет валентность I.
Чтобы этот факт навсегда врезался вам в память, запомните следующее. Группа –ОН образуется из воды. Формула воды Н2О, это всем известно. Выглядит молекула воды так: Н-О-Н. То есть в ней две части Н– и –ОН. Каждая из этих частей имеет валентность I, это видно и из формулы:
Нам здесь важно, что гидроксильная группа имеет валентность I. Это надо запомнить.
Теперь переходим к практике и решению химии.
Пример 1.
Составьте формулу гидроксида калия.
Это очень просто. Калий в таблице Менделеева находится в первой группе в основной подгруппе, он имеет валентность I. Группа –ОН также имеет валентность I. Следовательно, формула гидроксида калия КОН.
Пример 2.
Составьте формулу гидроксида кальция.
Кальций находится в периодической таблице во второй группе в основной подгруппе, его валентность II. Тогда:
Здесь надо припомнить, как составляется формула вещества, если известна валентность. Нужно, чтобы произведение валентности и индекса у каждого элемента совпадало. Поэтому формула гидроксида кальция выглядит так:
Напоминаю, что если гидроксильных групп больше одной, то мы из заключаем в скобки. Обратите внимание, что такое написание (ОН)2 означает, что в формуле не два атома водорода, а две группы ОН!
Итак, формула гидроксида кальция – Ca(ОН)2.
Пример 3.
Составьте формулу гидроксида железа (III).
Валентность железа задана условиями, поэтому:
Отсюда следует:
Таким образом, формула гидроксида железа (III) – Fe(OH)3.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Схема образования гидроксида натрия:
Na+ + H-O-H > NaOH + H+;
Уравнение реакции: 2Na + 2HOH = 2NaOH + H2
OH– – гидроксид-ион является сложным ионом.
Название основания = Гидроксид + Название металла в родительном падеже + С.О. римскими цифрами
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Дай название веществам: Ba(OH)2, KOH , Al(OH)3, Zn(HO)2. Воспользуйся тренажером. (Оценка за тренажер не входит в итоговую оценку. Нажми на ссылку ответь на вопросы и закрой страницу с тестами.)
Порядок составления формул оснований
При
составлении формулы конкретного основания, необходимо в таблице
растворимости найти ион металла, для которого составляем формулу, и в
соответствии с зарядом этого иона металла составить, формулу основания:
-
Если заряд иона металла “+”, то с ионом металла связанна только одна гидроксогруппа OH–, например гидроксид натрия Na+OH;
-
Если “2+”, то две Ca2+(OH)2.
![]() Вопрос:
Вопрос:
Заряд иона алюминия “3+” (Al3+) сколько гирдроксогупп связанно с алюминием в гидроксиде алюминия?
![]() Запомни:
Запомни:
Оксиду металла соответствует основание: Ca > CaO > Ca(OH)2. Такие оксиды называют основные оксиды. СаО – основный оксид.
Составим основания из оксидов: Na2O , FeO , Fe2O3
|
Na+2O > Na+OH– |
Fe2+O > Fe+2(OH)2 |
Fe23+O3 > Fe3+(OH)3 |
|
|
|
|
Составь:
-
Основания из оксидов: ZnO , Li2O , MgO
-
Оксиды из оснований: CuOH , Cu(OH)2
* * *
.

Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
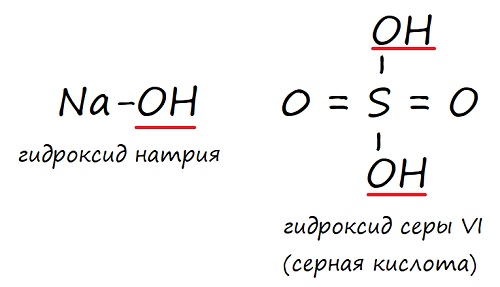
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 8) Ca(OH)2 9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.

Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20


3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl

Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O


2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.

3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль

5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20

7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.

8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O



