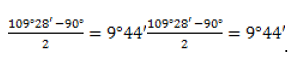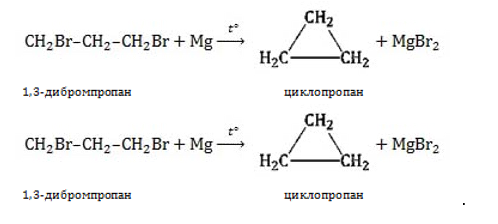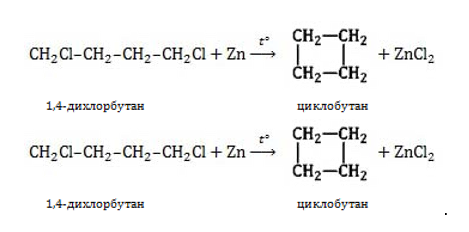1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Содержание
- 1 Понятие о циклоалканах. Общая формула
- 2 Строение циклоалканов
- 3 Гомологический ряд и устойчивость циклоалканов
- 3.1 Малый цикл
- 3.2 Средний цикл
- 4 Изомерия и номенклатура
- 4.1 Виды структурной изомерии циклоалканов
- 4.2 Пространственная изомерия
- 4.3 Номенклатура
- 5 Физические свойства
- 6 Химические свойства
- 7 Способы получения циклоалканов
- 8 Применение циклоалканов
Среди карбоциклических соединений различают две группы веществ, имеющих принципиально разное строение: алициклические, которые близки по свойствам к соединениям с открытой цепью, и ароматические. Предельные алициклические углеводороды называются циклоалканами, или циклопарафинами. Свойства циклоалканов аналогичны свойствам насыщенных углеводородов линейного строения.
Понятие о циклоалканах. Общая формула
Определяющий признак соединений данного ряда – отсутствие кратных связей в молекулах. Все атомы соединяются посредством одинарных связей, поэтому валентности углерода максимально насыщены.
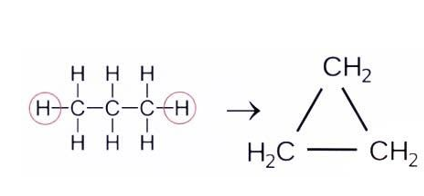
Состав циклоалканов выражает общая формула гомологического ряда В любом циклоалкане недостает двух водородных атомов по сравнению с алканом
, имеющим такое же количество углерода. Они отщеплены от концевых звеньев линейной молекулы, за счет чего и происходит замыкание углерод-водородной цепочки в циклическую структуру:
Структурные формулы циклоалканов часто имеют упрощенный вид геометрической фигуры, а запись групп , расположенных в вершинах многоугольника, опускается:
Строение циклоалканов
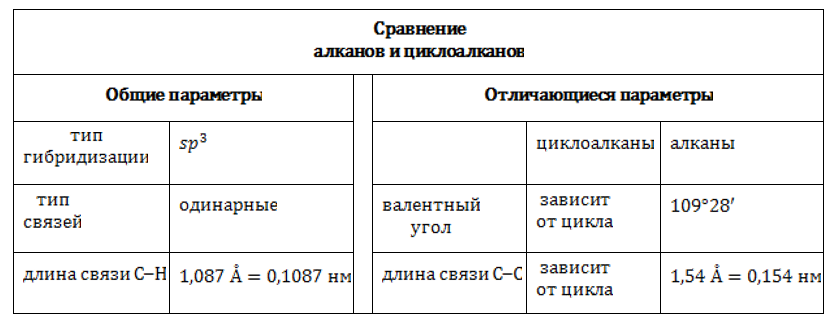
Сходство циклопарафинов с алканами проявляется в полном насыщении углеродного скелета молекулы водородом. Оно возникает благодаря тому, что каждый атом углерода формирует по четыре одинарных связи: либо
и
в соединениях с боковыми углеводородными цепочками. Это указывает на тип гибридизации углерода в циклоалканах: sp3.
В sp3-гибридизованном состоянии четыре равноценных валентности углеродного атома имеют тетраэдрическую направленность, а величина валентного угла составляет 109°28`109°28`. Но, в отличие от ациклических углеводородов, в молекулах циклоалканов может возникать напряжение, степень которого зависит от числа атомов, участвующих в образовании цикла.
Валентные углы углерода в циклоалканах подчинены геометрии цикла. Связи отклоняются от нормального направления, вследствие чего и возникает напряжение. Оно, в свою очередь, влияет на прочность молекулы.
Гомологический ряд и устойчивость циклоалканов
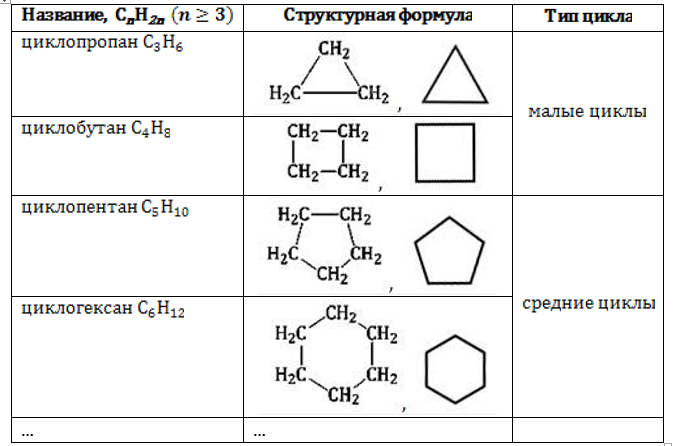
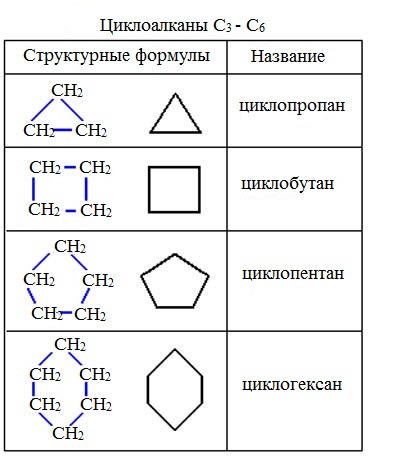
Для образования цикла необходимы как минимум три углеродных атома. Поэтому ряд начинается с соединения циклопропана. Важной особенностью ряда является внутренняя классификация соединений по типу циклов, от которого зависят их свойства.
Малый цикл
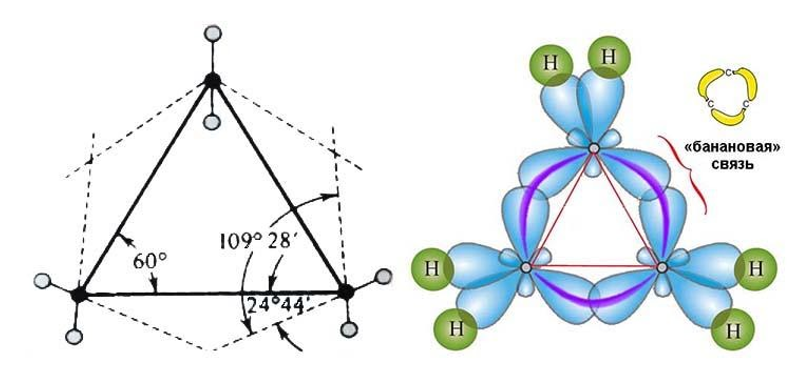
Молекулы соединений малого цикла отличаются сильным угловым напряжением из-за большого отклонения тетраэдрического угла 109°28`109°28`. В трехчленной молекуле циклопропана, где валентные углы в трехчленном цикле должны составлять 60°60°, оно особенно велико:
Это приводит к изгибанию связи, которая из-за характерной формы получила название «банановой». Перекрывание орбиталей в такой связи осуществляется не по прямой между центрами углеродных атомов, поэтому «банановая», или связь, слабее обычной
связи.
Четырехчленная структура циклобутана позволяет ослабить напряжение:
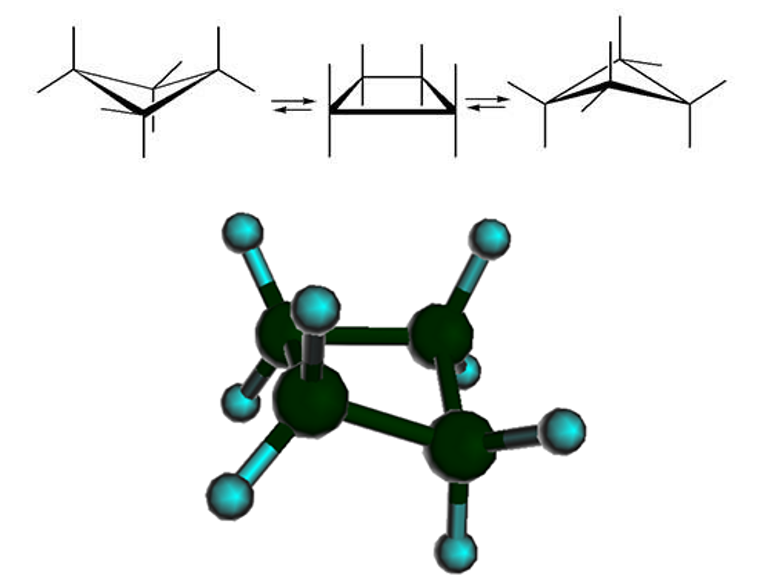
Кроме того, один из четырех атомов в цикле на 25°25° отклоняется от плоскости, в результате чего молекула циклобутана колеблется между двумя равноправными конформациями, условно называемыми «бабочка»:
Средний цикл
Молекулы циклопентана и циклогексана гораздо устойчивее, чем малые циклы, благодаря незначительному отклонению валентного угла:
В циклогексане благодаря большому числу конформаций напряжение отсутствует.
Изомерия и номенклатура
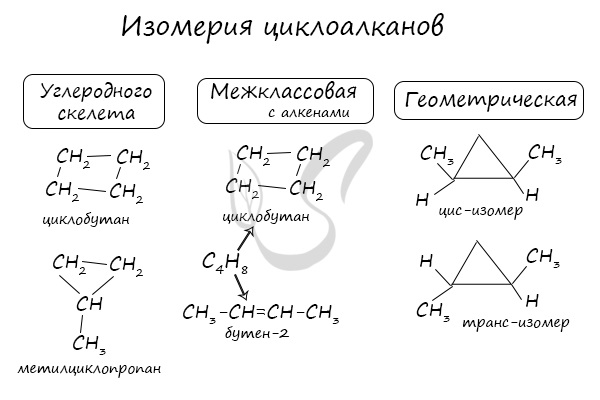
Изомерия циклоалканов может быть двух типов:
- структурная, возникающая вследствие различий в строении;
- пространственная, связанная с вариантами конфигурации одинаковых по строению молекул.
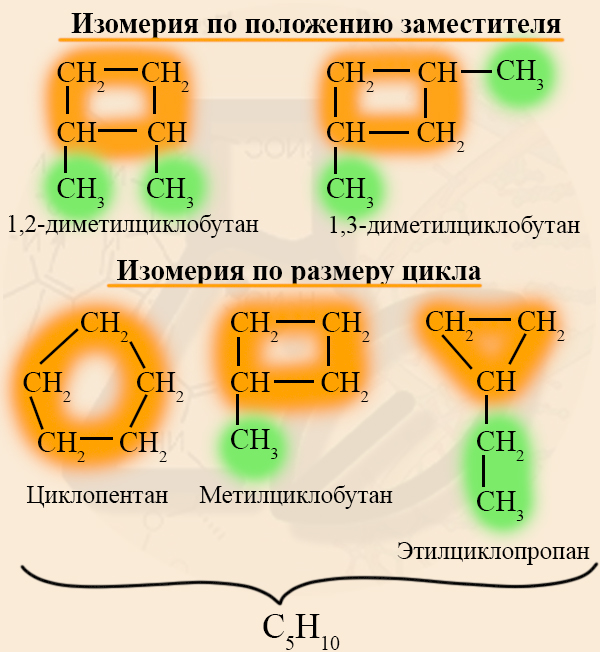
Виды структурной изомерии циклоалканов
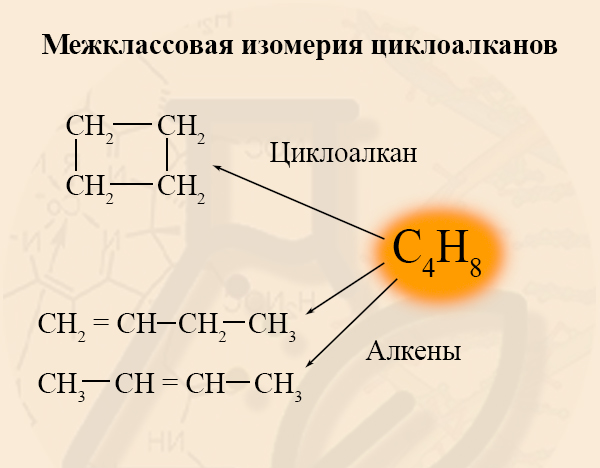
- Существование изомеров из разных классов веществ
Гомологические ряды соединений, атомный состав которых описывается одной формулой – алкены и циклоалканы – обладают межклассовой изомерией по отношению друг к другу:
- Изомерия углеродного скелета
Возникновение изомеров данного вида зависит от трех факторов.
- размер цикла:
- строение радикала:
- расположение радикалов в цикле:
Пространственная изомерия
Циклоалканы способны образовывать геометрические изомеры. Они возникают вследствие невозможности вращения углеродных атомов в цикле вокруг их валентных связей. Положение стоящих при этих атомах радикалов тем самым зафиксировано в пространстве. Заместители у различных углеродных атомов могут находиться либо с одной стороны цикла (цис-изомер), либо с разных сторон (транс-изомер).
Номенклатура
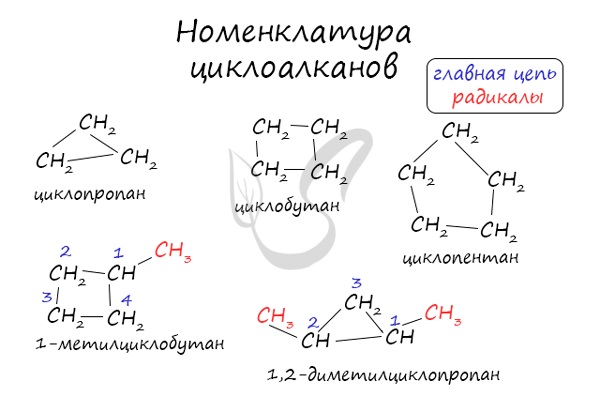
Номенклатура циклоалканов основывается на наименованиях предельных углеводородов открытого строения – алканов. Приставка «цикло-» добавляется к названию алкана с , равным количеству звеньев в кольце циклоалкана.
Число радикалов одного состава указывается с помощью приставок «ди-», «три-», «тетра-». Старший радикал обозначается первым, а углеродные атомы нумеруют по наиболее короткому расстоянию между радикалами.
Физические свойства
В целом по физическим свойствам циклоалканы сходны с ациклическими углеводородами предельного ряда. Однако плотность и значения критических температур у них выше, чем у родственных алканов.
Циклопропан и циклобутан в обычных условиях являются газами, циклопентан и последующие шесть членов ряда, включая циклоундекан – жидкости, а начиная с циклододекана
– твердые тела.
Химические свойства
Значительные различия между соединениями малых и средних циклов обусловливают разницу в химических свойствах циклоалканов:
- соединения
менее стойки и охотно участвуют в реакциях присоединения, сближаясь по свойствам с алкенами;
и следующие за ним члены гомологического ряда в проявлении химических свойств аналогичны алканам с таким характерным типом химического взаимодействия, как замещение.
Это интересно:
Окисление алкенов перманганатом калия
Циклические углеводороды
Способы получения циклоалканов
- Дегалогенирование дигалогенпроизводных предельных ациклических углеводородов. Воздействуя активным металлом, способным отнимать галоген, на дигалогеналкан, можно получить циклическое соединение заданного состава. Условие – наличие между галогенированными группами атомов в цепочке минимум одной группы
. Реакция получения циклопропана:
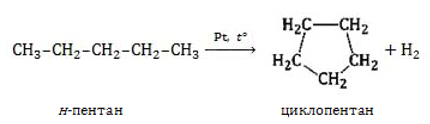
- Дегидроциклизация алканов. При нагревании алканов, содержащих пять и более углеродных атомов, на металлическом катализаторе происходит отщепление водорода (дегидрирование) на концах цепочек с ее замыканием (циклизация алканов):
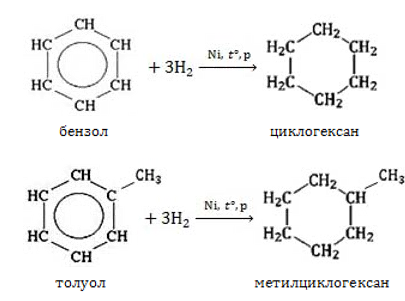
- Гидрирование ароматических углеводородов. Поскольку наименьшее количество углеродных атомов в углеводородах ряда бензола равно шести, этим методом возможно получение циклоалканов не менее чем с шестичленным циклом:
Применение циклоалканов
Наиболее широко используются циклоалканы с углеродным числом :
- Циклопропан применяется в медицинской практике как анестетик, однако из-за повышенной огнеопасности в последнее время его вытесняют другие препараты.
- Циклопентан находит применение в синтезе органических соединений, используется в качестве растворителя, вспенивателя в производстве пенополиуретанов и как заменитель фреонов.
- Циклогексан служит сырьем для производства соединений, из которых получают синтетические волокна капрон и нейлон, для получения ароматических углеводородов. Также его применяют в качестве органического растворителя.
Циклоалканы с более высокими углеродными числами – циклогептан и циклооктан – используются как промежуточные реагенты в синтезе некоторых органических веществ.
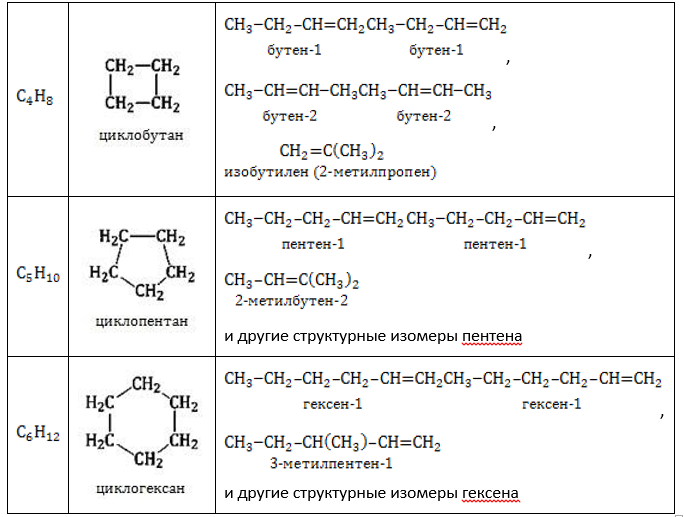
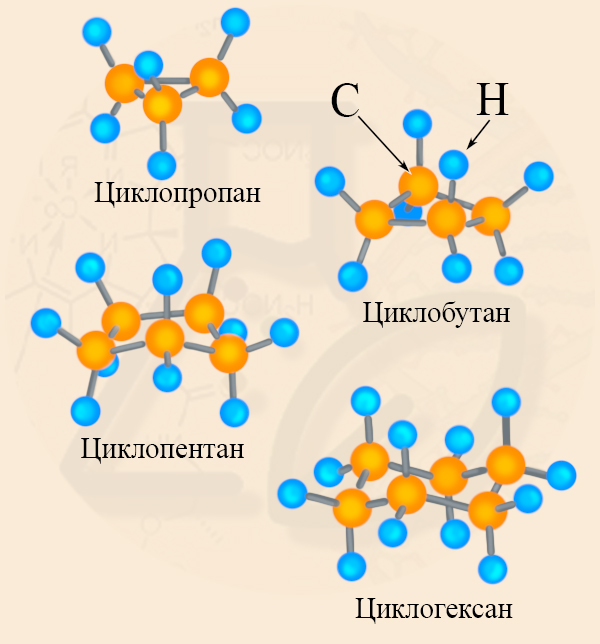
Гомологический ряд циклоалканов
Циклоалканы по размеру цикла делятся на ряд групп, из которых рассмотрим две: малые (С3, С4) и обычные (С5 — С7) циклы.
Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле.
Циклоалканы
Циклоалканы (циклопарафины, нафтены) – циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только
простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их
гомологического ряда – CnH2n.
Номенклатура и изомерия циклоалканов
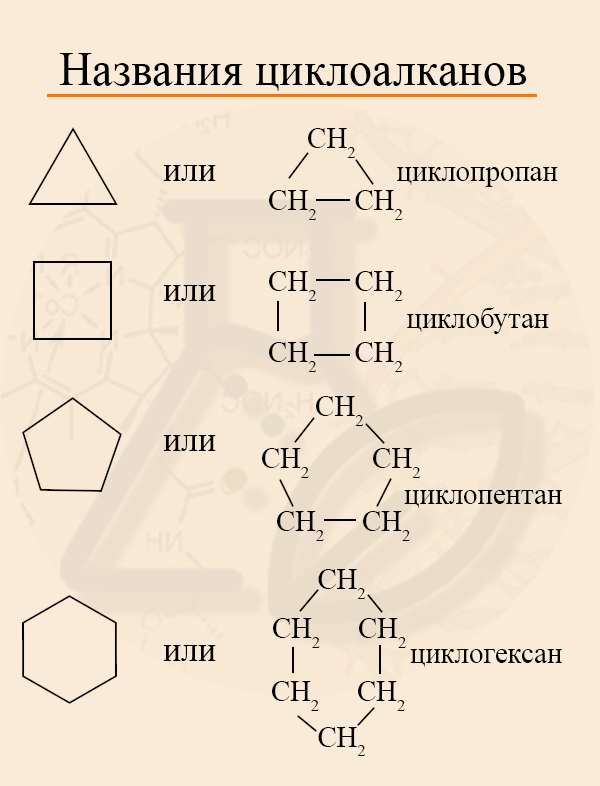
Названия циклоалканов формируются путем добавления приставки “цикло-” к названию алкана с соответствующим числом:
циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде
существования цис- и транс-изомеров.
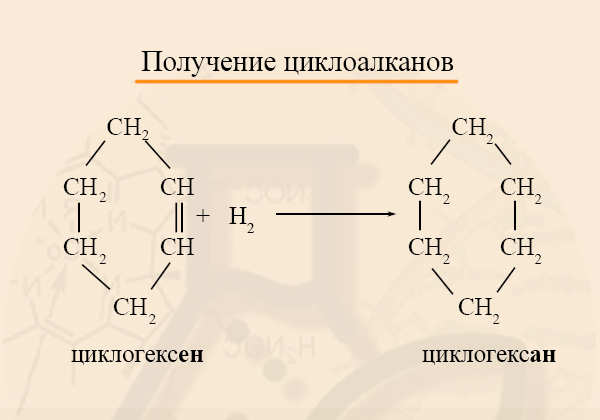
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
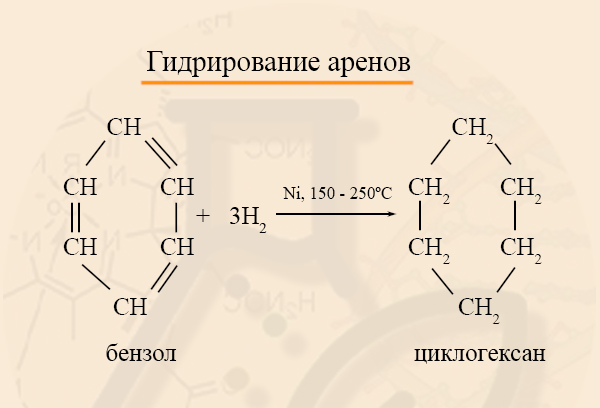
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.

При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
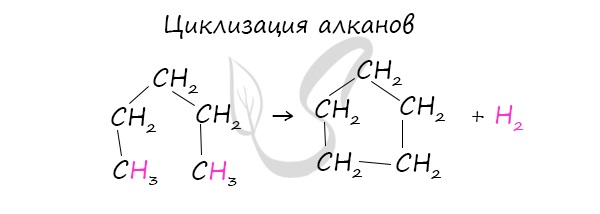
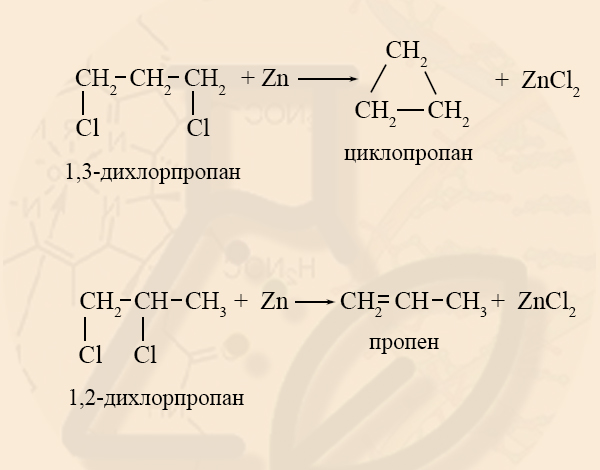
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана
реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Дегидрирование
- Изомеризация
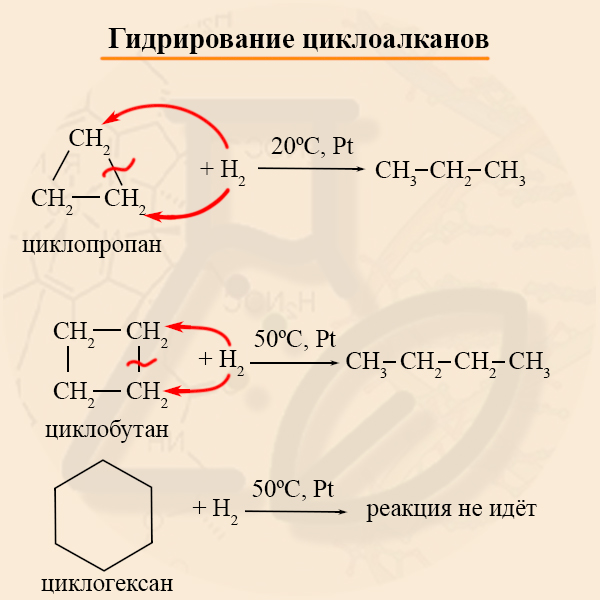
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ – не вступают, но на самом деле эти реакции идут, просто крайне затруднены).

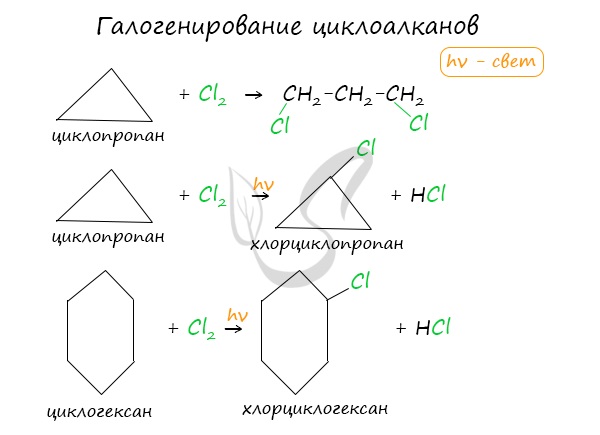
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция
идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
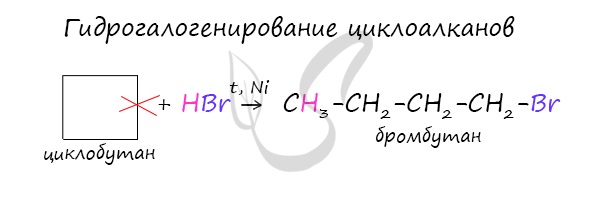
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
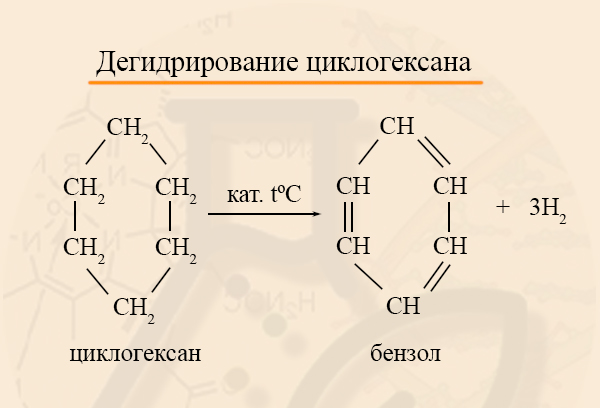
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов – гомологи бензола.

В ходе нагревания с катализатором – AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Циклоалканы
Материал по химии
- Основные характеристики циклоалканов:
- Номенклатура циклоалканов
- Малые и обычные циклоалканы
- Строение молекул циклоалканов
- Изомерия циклоалканов
- Химические свойства циклоалканов
- Таблица – Сравнение химических свойств циклоалканов с другими углеводородами
- Получение циклоалканов
- Физические свойства циклоалканов
Циклоалканы – это углеводороды, в которых атомы углерода образуют кольца (иными словами, циклы) и не имеют кратных связей. Циклоалканы в разных учебниках могут называться по-разному: алициклическими соединениями, алифатическими циклами, циклопарафинами, нафтенами (так как содержатся в нефти).
Если Вы уже знакомы с данной темой, попробуйте решить задание:
Задание в формате ЕГЭ с ответом:
Выберите три верных утверждения о свойствах и строении циклоалканов.
- В циклоалканах на одну свесь С-С больше, чем в алканах с таким же количеством углерода
- Цис- и трансизомеры легко превращаются друг в друга
- Малые циклоалканы менее устойчивы, чем нормальные
- Межклассовыми изомерами циклоалканов являются циклоалкены
- Для циклоалканов характерна sp3-гибридизация
- Циклопентан относят к малым циклам
Вернитесь к заданию после прочтения материала, если Вы пока не понимаете, о чём речь.
Основные характеристики циклоалканов:
- Предельные (не имеют кратных связей)
- Атомы находятся в sp3-гибридицазии
- Только σ-связи (однако есть так называемые «банановые», грубо говоря, это деформированные σ-связи)
- Общая формула циклоалканов CnH2n
Номенклатура циклоалканов
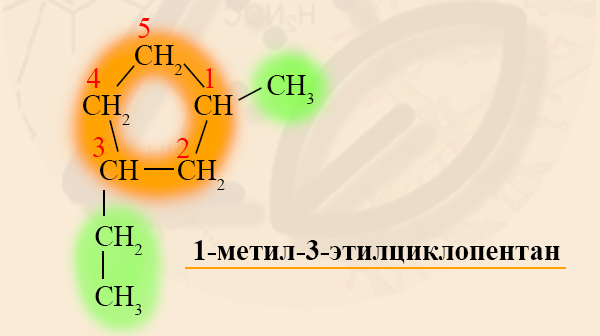
Называются циклоалканы подобно алканам, только с приставкой «цикло». Если трехуглеродный алкан называют пропаном, то трехуглеродный цикл – циклопропаном.
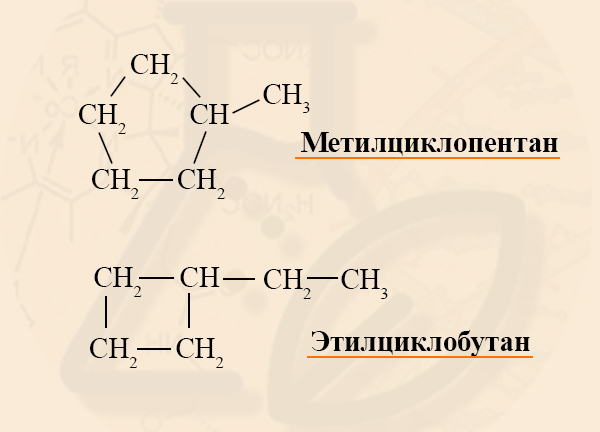
Если в кольце есть один заместитель, то его называют, не указывая номер углерода, так как в этом нет смысла. Номенклатура радикалов такая же, как в алканах, название основного вещества и радикала пишут слитно:
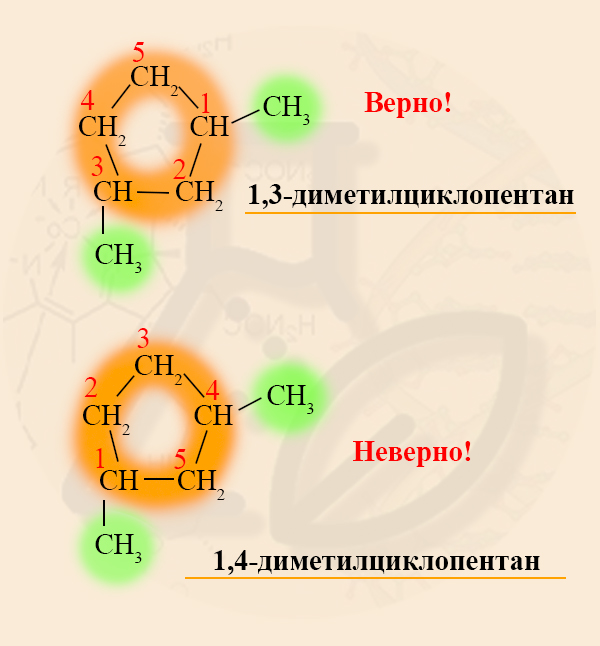
Если в кольце два или более заместителя, то при составлении названия пользуются следующими правилами:
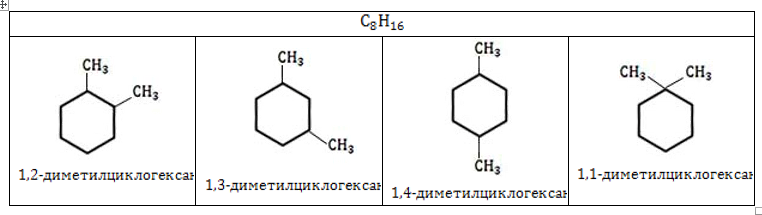
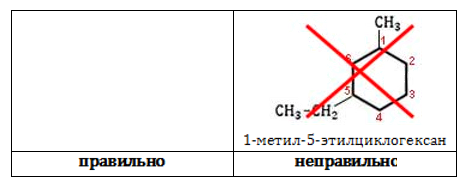
- Нумерацию углеродов кольца производят таким образом, чтобы заместители получили наименьшие номера.
- Одинаковые радикалы называют с приставкой «ди-», «три-» и так далее, как это было в номенклатуре алканов.
- Заканчивают номенклатуру названием цикла:
Разноименные радикалы называют в порядке алфавита, то есть, если в кольце есть заместитель CH3 – Метил и CH3-CH2 – Этил, то первый номер обязательно займет метил, так как буква «М» стоит в алфавите раньше, чем «Э».
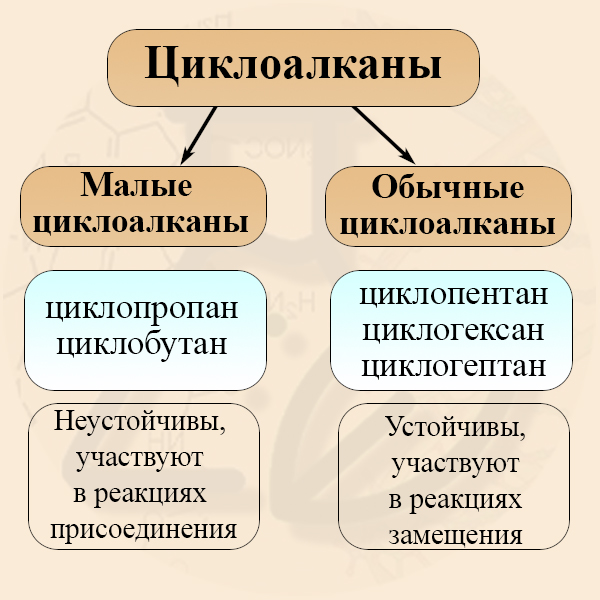
Малые и обычные циклоалканы
По размеру кольца циклоалканы принято разделять на малые и нормальные циклы (также встречается деление циклоалканов на малые, средние и большие, но такой способ их классификации встречается реже). К малым циклоалканам относят циклопропан и циклобутан, к обычным или средним циклам относят циклопентан, циклогексан и циклогептан. Малые и обычные циклы значительно отличаются друг от друга по ряду химических свойств:
Чтобы понять, в чем причина таких значительных отличий внутри одной гомологической группы, следует разобрать строение циклоалканов.
Строение молекул циклоалканов
- Строение молекулы циклопропана
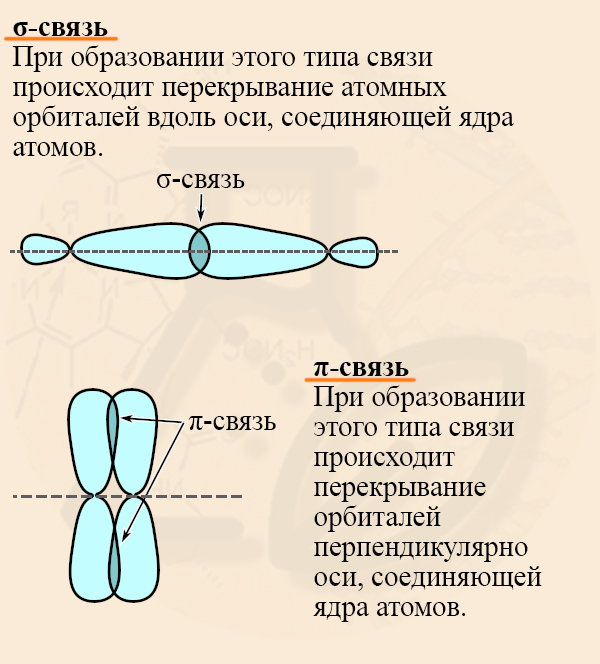
Для начала следует вспомнить особенности σ- (сигма) и π-связей (пи-связей). Для веществ с простыми (ПРЕДЕЛЬНЫМИ) связями характерна sp3-гибридизация (то есть все четыре орбитали – 1s и 3p гибридизуются, усредняются), а между атомами углерода образуются σ- связи. При образовании этого типа связи происходит перекрывание атомных орбиталей вдоль оси, соединяющей ядра атомов.
У непредельных (имеющих двойные или тройные связи) веществ гибридизованы не все орбитали, и между негибридизованными может образовываться π-связь. При образовании этого типа связи происходит перекрывание орбиталей перпендикулярно оси, соединяющей ядра атомов.
К чему же мы упоминаем π-связь, когда в циклоалканах нет непредельных связей?
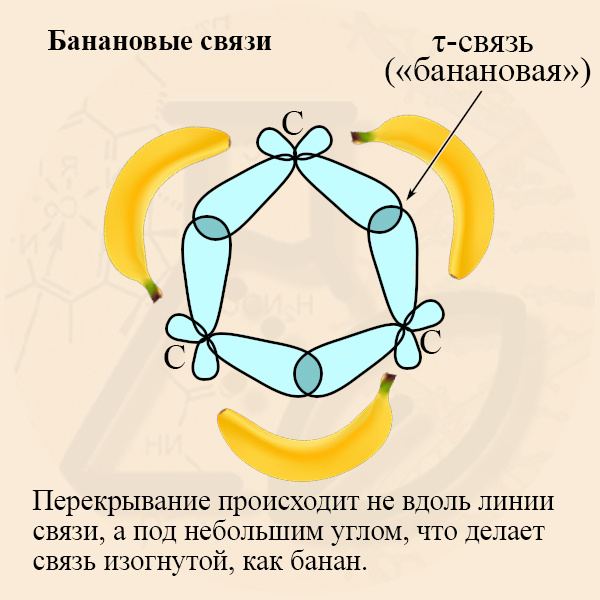
Для sp3-гибридизации характерен угол связи равный 109,5º, но как расположить три углерода в цикле, чтобы такой угол сохранился (Вы ведь помните, что у равностороннего треугольника углы равны 60º)? К сожалению, никак! Чтобы трехуглеродная молекула образовала кольцо (треугольник), углы связей придется сжать, при этом возникает угловая напряженность связи.
Скажем простыми словами: 4 электрона (ведь столько неспаренных электронов содержится у атома углерода в возбужденном состоянии, что и определяет валентность IV атома углерода в органических соединениях) способны «терпеть» друг друга, если их орбитали расположены максимально удаленно друг от друга. Такое удаление обеспечивается расположением четырех гибридных орбиталей в форме тетраэдра, угол между орбиталями в нем составляет 109,5º. Такое мы наблюдаем в алканах.
Вернемся же к малым циклоалканам. Чтобы замкнулось кольцо, две из четырех орбиталей должны находиться под меньшим углом друг к другу, из-за чего стремятся «разжаться» и прийти снова в более комфортное состояние тетраэдра, поэтому малые циклы участвуют в реакциях присоединения, при которых цикл разрывается и орбитали углеродов встают в свое наиболее устойчивое положение.
Хотелось бы добавить, что гибридизованные орбитали углеродов в малых циклах перекрываются не как обычно – по линии, когда образуется σ-связь, перекрытие получается полубоковым. Такая связь получила название τ-связи или «банановой» связи (на рисунке изображены только С – С связи, участвующие в образовании кольца):
Обобщим:
- σ – связь является прочной, если молекула имеет только такой тип связей, то для нее характерны реакции замещения.
- π – менее прочная, наличие такой связи в молекуле обеспечивает возможность осуществления реакций присоединения.
- τ-связь (тау-связь) – является промежуточной, она менее прочна, чем σ-связь, поэтому для малых циклов характерны реакции присоединения.
- Строение циклобутана
Чем больше углов в фигуре, тем больше может быть угол связи, кроме того, четырехуглеродное кольцо может быть не плоским, что также позволяет снять «напряженность» связей. Для циклобутана тоже характерны реакции присоединения, но идут они гораздо труднее, чем у циклопропана (то есть циклобутан устойчивее своего трехуглеродного гомолога).
За счет неплоской структуры циклопентану и циклогексану удается избежать углового напряжения, поэтому они более стабильны:
Изомерия циклоалканов
- Структурная изомерия циклоалканов
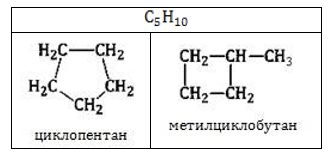
Этот тип изомерии связан положением заместителей или размером цикла. Помните, что изомерами называют вещества с одинаковым составом (одинаковой брутто-формулой), но разным строением:
- Межклассовая изомерия циклоалканов
Межклассовыми изомерами циклоалканов являются алкены. У этих двух групп одинаковая общая формула CnH2n. Так как общая формула у этих двух классов равна, Вы смело можете говорить, что циклоалкан и алкен являются изомерами, если они содержат одинаковое количество углерода.
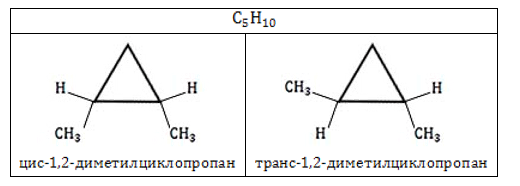
- Пространственная геометрическая изомерия (цис-транс-изомерия)
Цис- и трансизомерия – это возможность существования двух, казалось бы, совершенно одинаковых веществ в двух формах, отличающихся по некоторым физическим или даже химическим свойствам. Рассмотрим, к примеру, цис-1,2-диметилциклопропан и транс-1,2-диметилциклопропан. Если одинаковые заместители находятся либо только сверху плоскости связи, либо только снизу, то такой изомер называют «цис-…», если одинаковые заместители находятся по разные стороны от плоскости связи, то такой изомер называют «транс-…».
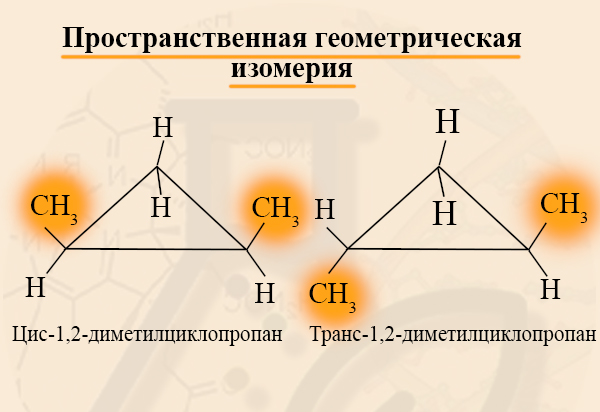
Для каких циклоалканов характерна цис-трансизомерия? Для тех, которые содержат два заместителя на РАЗНЫХ атомах углерода кольца. При этом, стоит отметить, что цис- и трансизомеры не могут переходить друг в друга, их стоит рассматривать, как две совершенно разные молекулы.
Пример задания из КИМ ЕГЭ:
Выберите все вещества, являющиеся изомерами циклопентана:
1) циклобутан; 2) метилциклобутан; 3) этилциклопропан; 4) метилциклопропан; 5) 2-метилбутен-2.
Запишите в графу ответов последовательность цифр в порядке возрастания.
Химические свойства циклоалканов
Химические свойства малых и средних (обычных) циклов в значительной степени отличаются. О причинах этого написано выше.
- Гидрирование циклоалканов
В реакцию с водородом вступают преимущественно малые циклы, реакцию проводят на никелевом или платиновом катализаторе. На примере гидрирования хорошо заметно увеличение устойчивости циклов с ростом кольца.
- Галогенирование циклоалканов
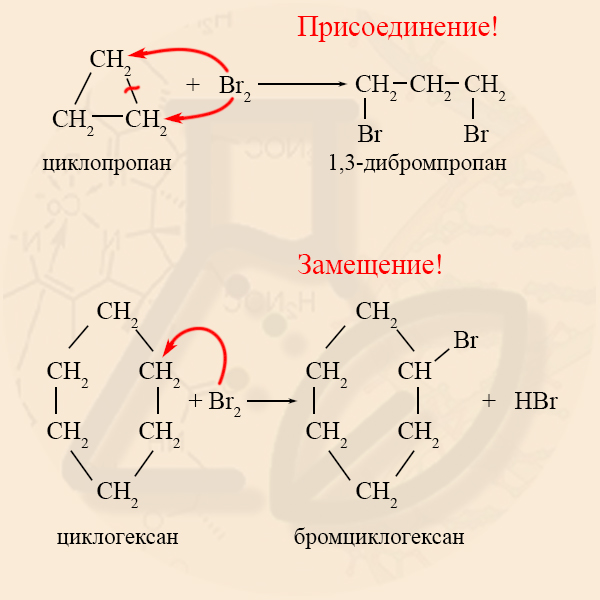
Реакции галогенирования характерны как для малых циклов, так и для нормальных, но в механизме реакций есть существенные отличия: малые циклы вступают с галогенами в реакции ПРИСОЕДИНЕНИЯ, а нормальные – в реакции ЗАМЕЩЕНИЯ.
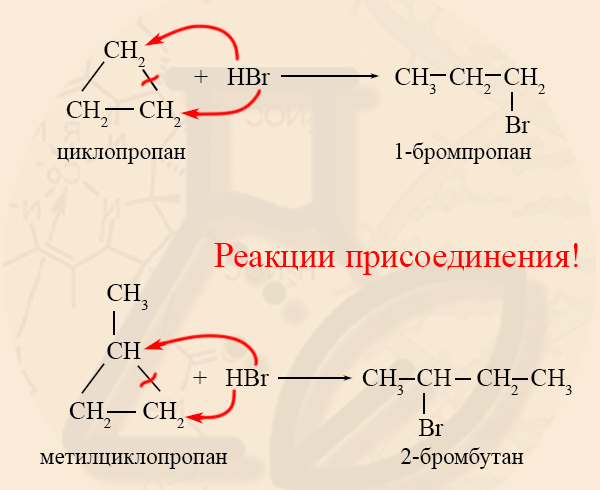
- Гидрогалогенирование циклоалканов
Гидрогалогенирование возможно только для малых циклов, причем, если циклоалкан содержит заместитель, то реакция идет по правилу Марковникова.
- Дегидрирование циклоалканов
При дегидрировании циклогексана и других его гомологов с шестью атомами углерода в кольце, образуются арены.
Задание по образцу ФИПИ:
Выберите все вещества, с которыми может реагировать циклопентан:
1) водород; 2) кислород; 3) азот; 4) хлор на свету; 5) бромоводород.
Запишите в графу ответов последовательность цифр в порядке возрастания.
Таблица – Сравнение химических свойств циклоалканов с другими углеводородами
Интересно рассмотреть циклоалканы в сравнении с алканами и алкенами
|
Реагент |
Алкан |
Малый цикл |
Нормальный цикл |
Алкен |
|
Водород |
Реакция не идет |
Присоединение с образованием алкана |
Реакция не идет |
Присоединение с образованием алкана |
|
Хлор/бром |
Реакция замещения, образуется моногалогеналкан |
Реакция присоединения, образуется дигалогеналкан |
Реакция замещения с сохранением цикла |
Реакция присоединения с образованием дигалогеналкана |
|
Хлороводород/ бромоводород |
Реакция не идет |
Реакция присоединения |
Реакция не идет |
Реакция присоединения |
Из таблицы видно, что малые циклы больше похожи на алкены, а нормальные циклы – на алканы.
Попробуйте решить задание ЕГЭ:
Выберите три верных ответа из шести. Для циклогексана, в отличие от циклопропана, характерно:
- С галогенами вступает в реакции замещения
- Реагирует с водой
- Атомы углерода, принадлежащие циклу, не образуют плоскую фигуру
- Окисляется при горении на воздухе
- Не реагирует с бромоводородом
- Реагирует с метаном
Получение циклоалканов
- Получение циклоалканов из аренов
Из бензола и его гомологов можно получить циклогексан и его гомологи:
- Получение циклоалканов из циклоалкенов
Аналогично предыдущему методу получения, исходное вещество гидрируется:
- Получение циклоалканов из дигалогеналканов
Условием образования циклоалкана из дигалогеналкана является то, что галогены должны находиться хотя бы через 1 атом углерода. Если вещество имеет заместитель на соседних атомах углерода, то образуется не циклоалкан, а алкен:
Выберите все вещества, из которых можно получить циклобутан напрямую (одной реакцией):
1) бутен-2; 2) 1,2-дибромбутан; 3) циклобутен; 4) 1,4-дихлорбутан; 5) хлорэтан.
Запишите в графу ответов последовательность цифр в порядке возрастания.
Физические свойства циклоалканов
- Физические свойства циклоалканов близки к таковым у соответствующих алканов, несколько отличаются температура кипения и плотность (у циклоалканов она выше).
- Циклоалканы нерастворимы в воде (циклоалканы неполярные, а вода – полярный растворитель).
- Но циклоалканы растворимы в эфирах и четыреххлористом углероде (это неполярные растворители, неполярное хорошо растворяется в неполярном).