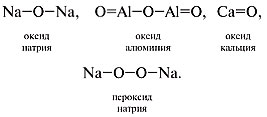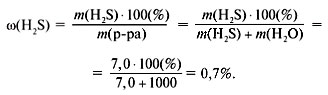Графические формулы оксидов
Графическая
формула – это схематическое изображение
пространственного расположения атомов
в молекуле. Она показывает порядок
соединения атомов и число связей между
ними .
Для
того, чтобы изобразить графическую
формулу оксида , необходимо :
-
Правильно
составить эмпирическую формулу; -
Соединить
атомы, учитывая, что атом кислорода
двухвалентен и каждая валентность,
указывая единицу связи, условно
изображается черточкой . -
Если
в молекулу кислорода входит не один, а
несколько атомов элемента, то нужно
соединить их в молекулу через атом
кислорода.
|
Оксид |
|
Na |
|
Оксид |
|
O |
|
Оксидазота |
|
O |
|
|
|
O |
Свойства оксидов
Общими
химическими свойствами основных,
кислотных и амфотерных оксидов являются
кислотно-основные взаимодействия:
Основные оксиды
Физические
свойства основных оксидов:
|
Оксиды |
Цвет |
Агрегатное |
|
MgO, |
Белый |
тв. |
|
CuO, |
Черный |
тв. |
|
Cu2O |
Красный |
тв. |
|
Ag2O |
Темно-Коричневый |
тв. |
|
Cs2O, |
Оранжевый |
тв. |
|
MnO |
Серо-Зеленый |
тв. |
|
NiO, |
Желтый |
тв. |
|
Li2O, |
Бесцветный |
тв. |
Химические свойства основных оксидов:
-
Взаимодействие с водой
Из
основных оксидов с водой взаимодействуют
только оксиды щелочных и щелочноземельных
металлов:
|
Li2O |
-
Взаимодействие с кислотными оксидами
|
MgO |
K2O |
3. Взаимодействие с кислотами
а)
Основные оксиды взаимодействуют с
кислотами с образованием соли и воды:
|
Na2O |
-
При
взаимодействии основного оксида
(избыток) (II,
III
-валентного металла) с кислотой
образуется основная
соль и вода:
|
BaO |
|
MgO |
-
При
взаимодействии основного оксида с
кислотой (избыток) (II,
III
– основная) образуется кислая соль и
вода:
|
Nа2О+ |
|
CaO |
б)
Двойные оксиды образуют две соли:
|
Fe3O4 |
|
(Fe |
4.
Оксиды щелочных и щелочноземельных
металлов при сплавлении взаимодействуют
с амфотерными гидроксидами, образуя
соли
|
Na2О |
|
K2О |
|
CaO |
5.
Оксиды с солями реагируют редко и
только при сплавлении
|
Fе2Оз |
6.
При высокой температуре более активные
металлы вытесняют (восстанавливают)
менее активные из их оксидов. На этом
основан один из способов
получения металлов, называемый
металлотермией. В качестве
металлов-восстановителей
обычно используют Аl
(алюминотермия), Мg(магнийтермия),
редко Са, К, Мn
и др. металлы
|
3(Mn |
|
UO2 |
7.
При высокой температуре реакции оксидов
с неметалламивозможны, в результате
которых происходит восстановление
металлов
|
FeO |
-
В
результате взаимодействия оксидов
щелочноземельных металлов с
углем
образуются карбиды металлов и оксид
углерода(II):
|
CaO |
-
В
результате взаимодействия оксидов
щелочноземельных металлов с водородом
(при высокой температуре) образуются
гидриды металлов и вода:
|
Са |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ГРАФИЧЕСКИЕ ФОРМУЛЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Очень часто формулы молекул оксидов, оснований, кислот, амфотерных гидроксидов и солей изображают графически. Для этого необходимо знать валентность каждого элемента, входящего в состав молекулы. Валентность элементов изображается черточками. Число черточек, отходящих от химического знака элементов, равно его валентности, например, Н , О =, Al и т.д.
Так как в молекуле свободные валентности отсутствуют, то надо так составить формулу, чтобы число черточек одного элемента соответствовало числу черточек другого элемента. Валентность разных атомов в молекуле взаимонасыщенна (отсутствуют свободные черточки), например, оксид натрия Na2O, в котором натрий одновалентен, а кислород двухвалентен.
Тогда графическая формула оксида имеет вид:
Na – O – Na
От атома кислорода отходят две черточки, от каждого атома натрия – по одной.
Графическая формула оксида алюминия Al2O3 имеет вид:
O = Al – O – Al = O
Алюминий трехвалентен, а кислород двухвалентен. От каждого атома алюминия отходят три черточки, от атома кислорода – две.
Графические формулы оснований
K – O – H H – O – Ba – O – H H – O – Al – О – Н
׀
O – H
KOH Ba(OH)2 Al(OH)3
гидроксид калия гидроксид бария гидроксид алюминия
В молекуле оснований атомы водорода связаны с кислородом.
Графические формулы кислот
В молекулах кислородосодержащих кислот атомы водорода, способные замещаться металлом, связаны с атомом неметалла через кислород:


H – O ׀׀ ׀׀
O О
HNO3 H2CO3 H3PO4
азотная кислота угольная кислота ортофосфорная кислота
В состав уксусной кислоты СН3СООН входят четыре атома водорода, но только один из них связан с кислородом, поэтому в уксусной кислоте только один атом водорода, соединенный с атомом кислорода, способен замещаться атомом металла:
Н О
׀ ׀׀
Н – С – С – О – Н
׀
Н
Графические изображения солей
Графическое изображение формул средних и особенно кислых солей часто вызывает затруднения. При их составлении нужно сначала написать графическое изображение формулы кислоты и затем заменить в ней полностью (нормальная соль) или частично (кислая соль) атомы водорода атомами металла. Если в молекулу соли входит несколько кислотных остатков, например, Mg(NO3)2, то нужно писать рядом столько формул кислоты, сколько кислотных остатков входит в молекулу соли, и заменить в них полностью атомы водорода атомами металла.
Графическая формула средней (нормальной) соли Mg(NO3)2 имеет вид:
HNO3 Mg(NO3)2
азотная кислота нитрат магния
O
׀׀
O – N = O
Mg
O – N = O
׀׀
O
O
׀׀
H – O – N = O
Mg
H – O – N = O
׀׀
O
Графическая формула кислой соли КHCO3 имеет вид:
Н2СО3 КНCO3
угольная кислота гидрокарбонат калия
К H – O – С – O – Н
׀׀
O
К – O – С – O – Н
׀׀
O
При составлении основных солей нужно сначала написать графическую формулу основания и затем заменить в ней частично гидроксогруппы ОН
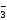
Графическая формула основной соли MgOHNO3 имеет вид:
Mg(OH)2 HNO3 MgOHNO3
гидроксид магния азотная кислота гидроксонитрат магния
O
׀׀
H – O – Mg – O – N = O
O
׀׀
H – O – Mg – O – H H – O – N = O
При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 15
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006
Оксиды
План

Определение, строение молекулы (графические
формулы).
2. Классификации (по агрегатному состоянию, по
валентности, по химическим свойствам).
3. Химические свойства кислотных и основных
оксидов.
4. Методы получения.
5. Области применения.
6. Формулы и тривиальные названия некоторых
оксидов.
Оксиды – это бинарные соединения,
содержащие кислород в степени окисления –2 (для
сравнения: пероксиды – бинарные соединения,
содержащие кислород в степени окисления –1).
Например:
–
оксид водорода,
– пероксид водорода.
При составлении графических формул оксидов
нужно учесть, что атомы кислорода соединяются
только через атомы элемента (в пероксидах атомы
кислорода соединены напрямую, образуя
пероксидную группу –О–О–). Приведем
графические формулы оксидов и пероксида:
К л а с с и ф и к а ц и и о к с и д о в
По агрегатному состоянию оксиды делятся на
твердые (CaO), жидкие (SO3) и газообразные (СО2).
По валентности различают высшие (Р2О5)
и низшие (Р2О3) оксиды.
По химическим свойствам оксиды
подразделяют на солеобразующие (например, К2О,
SO3) и несолеобразующие (безразличные, или
индифферентные, например CO, SO, NO). Солеобразующие
оксиды в свою очередь подразделяют на кислотные,
основные и амфотерные.
Кислотные оксиды – продукты полной
дегидратации кислот – сохраняют химические
свойства кислот. Примеры кислотных оксидов и
соответствующих им кислот:
Основные оксиды – продукты полной
дегидратации оснований – сохраняют химические
свойства оснований. Примеры основных
оксидов и соответствующих им оснований:
Na2O NaOH, CaO
Ca(OH)2, FeO
Fe(OH)2.
Амфотерные оксиды – продукты полной
дегидратации амфотерных гидроксидов –
сохраняют химические свойства амфотерных
гидроксидов. В зависимости от условий амфотерные
оксиды проявляют свойства основных или
кислотных оксидов. Примеры амфотерных оксидов и
соответствующих им гидратов:
Al(OH)3 Al2O3
HAlO2,
Zn(OH)2 ZnO
H2ZnO2.
Химические свойства кислотных и основных
оксидов отличаются друг от друга.
Х и м и ч е с к и е с в о й с т в а к и
с л о т н ы х о к с и д о в
Кислотные оксиды элементов, находящихся в
промежуточной степени окисления, реагируют с
кислородом:
2SO2 + O2 2SO3.
Известны примеры реакций кислотных оксидов с
активными металлами, например:
СO2 + Mg MgO +
CO.
Многие кислотные оксиды реагируют с водой,
образуя кислоты:
P2O5 + 3H2O = 2H3PO4,
СO2 + H2O H2CO3,
но:
SiO2 + H2O (нет реакции).
Реакция с основными оксидами:
СO2 + СаO CaCO3.
Взаимодействие с основаниями:
СO2 + 2NaOH = Na2CO3 + H2O.
Некоторые кислотные оксиды реагируют с солями
по типу реакции замещения:
Кислотные оксиды не реагируют с водородом,
неметаллами, другими кислотными оксидами и
кислотами-неокислителями, не действуют на
индикаторы.
Х и м и ч е с к и е с в о й с т в а о с
н о в н ы х о к с и д о в
Водород восстанавливает металлы (от цинка и
правее в ряду напряжений металлов) из их оксидов:
СuO + H2 Cu + H2O.
Оксиды металлов с меньшей валентностью
окисляются в высшие оксиды:
4FeO + O2 2Fe2O3.
Активные металлы реагируют с оксидами менее
активных металлов:
2Al + 3CuO Al2O3
+ 3Cu.
Некоторые неметаллы восстанавливают металлы
из их оксидов:
2Fe2O3 + 3С 4Fe + 3CO2.
Оксиды щелочных и щелочно-земельных металлов с
водой образуют щелочи:
Na2O + H2O = 2NaOH.
Основные оксиды реагируют с
кислотными оксидами с образованием солей:
СаО + СО2
CaCO3.
Взаимодействие с кислотами:
Na2O + 2HCl = 2NaCl + H2O,
CuO + 2HCl = CuCl2 + 2H2O.
Некоторые основные оксиды термически
неустойчивы:
2HgO 2Hg + O2
.
Основные оксиды не реагируют между собой, с
основаниями и солями, не действуют на индикаторы.
М е т о д ы п о л у ч е н и я о к с и д
о в
Окисление простых веществ:
С + О2 CO2,
4Al + 3O2 2Al2O3.
Окисление сложных веществ:
CH4 + 2O2 CO2 + 2H2O.
Разложение сложных веществ (кислот, оснований,
солей):
Н2SiO3
H2O + SiO2,
Cu(OH)2 CuO +
H2O,
2KMnO4 K2MnO4
+ MnO2 + O2.
Оксиды применяют в химическом синтезе, в
технике, в быту, в пищевой отрасли
промышленности.
Формулы и тривиальные названия оксидов,
которые необходимо запомнить:
СаО – негашеная известь;
СО – угарный газ;
СО2 – углекислый газ, твердый СО2 –
сухой лед;
Fe3O4 (FeO•Fe2O3) – смешанный
оксид железа;
SiO2 – песок, кремнезем, горный хрусталь;
N2O – веселящий газ;
SO2 – сернистый газ;
Al2O3 – глинозем.
Тест по теме «Оксиды»

Амфотерный оксид и гидроксид образует:
а) цинк; б) магний;
в) калий; г) бериллий.
2. Алюминий из глинозема в промышленности
получают:
а) термическим разложением;
б) электролизом;
в) восстановлением углем;
г) восстановлением водородом.
3. Кислотными являются оксиды:
а) оксид хрома(III) и оксид серы(II);
б) оксид серы(IV) и оксид хрома(VI);
в) оксид натрия и оксид цинка;
г) углекислый газ и речной песок.
4. Из перечисленных соединений к оксидам
относятся:
а) Na2O; б) H2O2; в) KO2; г) H2O.
5. Оксид азота(III) является ангидридом
кислоты:
а) азотной; б) азотистой; в) синильной;
г) вообще не является ангидридом.
6. Соль, при прокаливании которой нельзя
получить оксид, это:
а) перманганат калия; б) нитрат натрия;
в) карбонат кальция; г) карбонат калия.
7. Наиболее ярко выражены основные свойства
у оксида:
а) бериллия; б) магния;
в) бария; г) цинка.
8. Непосредственно друг с другом не
взаимодействуют:
а) кислород и натрий; б) кислород и медь;
в) кислород и хлор; г) кислород и аммиак.
9. Кислотный оксид можно получить в
результате реакции разложения:
а) основания; б) гидроксида;
в) кислоты; г) соли.
10. Объем (н.у.) порции сернистого газа,
содержащей 4,515•1023 атомов кислорода,
составляет
(в л):
а) 16,8; б) 22,4; в) 5,6; г) 8,4.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а, г | б | б, г | а, г | б | б, г | в | в | б, в, г |
г |
Задачи на растворимость
У р о в е н ь А

Растворимость сероводорода при 0 °С
составляет 4,62 л на 1 л воды. Какой массовой доле,
молярной и нормальной концентрации будет
соответствовать полученный раствор? (Плотность
раствора можно принять за 1 г/мл.)
Решение
Масса сероводорода:
m(H2S) = (V(H2S)/VM)•M(H2S)
= (4,62/22,4)•34 = 7,0 г.
Найдем массовую долю (в %) сероводорода:
Рассчитаем количество вещества и молярную
концентрацию сероводорода:
(H2S)
= 4,62/22,4 = 0,2 моль,
с(H2S) = (H2S)/V(р-ра) = 0,2/1,007 = 0,2 моль/л.
Определим эквивалент двухосновной
сероводородной кислоты:
Э(H2S) = М/основность = 34/2 = 17.
Число эквивалентов кислоты H2S:
N(экв.) = m/Э = 7,0/17 = 0,4125.
Нормальная концентрация (нормальность) кислоты
равна:
N(экв.)/V(р-ра) = 0,4125/1,007 = 0,4 н.
Ответ. (H2S) = 0,7%, c(H2S) = 0,2 моль/л,
нормальность = 0,4 н.
2. При 60 °С насыщенный раствор нитрата
калия содержит 52,4% соли. Найти растворимость
нитрата калия при этой температуре.
Ответ. 110 г KNO3 в 100 г воды.
3. 50 г насыщенного при 40 °С раствора
содержат 6,5 г сульфата калия. Определить массовую
долю соли в растворе и ее растворимость при этой
температуре.
Ответ. (K2SO4) = 13%,
растворимость – 14,9 г соли в 100 г воды.
4. Растворимость хлорида натрия при 25 °С
составляет 36 г в 100 г воды. Определить массовую
долю соли в насыщенном растворе при этой
температуре.
Ответ. 26,47%.
5. Массовая доля нитрата серебра в
насыщенном при 20 °С водном растворе
составляет 69,5%. Определить растворимость соли
при данных условиях (на 100 г воды).
Ответ. 228 г AgNO3 в 100 г воды.
6. При 20 °С и атмосферном давлении в одном
объеме воды растворяется 450 объемов
хлороводорода. Вычислить массовую долю вещества
в насыщенном при этой температуре растворе
(изменением объема раствора пренебречь). Как
получить более концентрированный раствор?
Ответ. (HCl) = 42,3%; повысить давление.
У р о в е н ь Б
1. В 100 г воды при 20 °С растворяется 74,5 г
хлорида кальция. Растворимость его гексагидрата
при 0 °С составляет 36,3 г на 100 г воды. Вычислить
массовую долю хлорида кальция в растворе при
0 °С и массу кристаллов, которые выделятся из 250
г насыщенного при 20 °С раствора при охлаждении
его до 0 °С.
Ответ. (CaCl2) = 13,5% (0 °С),
m(крист. CaCl2•6Н2О) = 195,9 г.
2. 99,8 г медного купороса растворено при
80 °С в 164 мл воды. Раствор охладили до 10 °С,
при этом в осадок выпало 30 г медного купороса. Был
ли сульфат меди чистым веществом или содержал
примеси? Растворимость сульфата меди при 10 °С
составляет 17,4 г.
Ответ. Купорос содержал примеси.
3. При охлаждении 300 г 15%-го раствора часть
растворенного вещества выпала в осадок, и
массовая доля для второго раствора составила 8%.
Рассчитать массу осадка.
Ответ. 22,8 г.
4. Определить массу осадка, выпавшего при
охлаждении насыщенного раствора хлорида натрия
от 80 °С до 0 °С, если масса первого раствора
600 г; растворимость хлорида натрия при 80 °С
составляет 38 г, а при 0 °С – 35,8 г на 100 г воды.
Ответ. 9,6 г.
5. Какая масса нитрата бария выделится из
раствора, насыщенного при 100 °С и охлажденного
до 0 °С, если во взятом растворе было 50 мл воды?
Растворимость нитрата бария при 0 °С
составляет
5 г, а при 100 °С – 34,2 г на 100 г воды.
Ответ. 14,6 г.
6. Для приготовления насыщенного при 50 °С
раствора нитрата никеля было взято 100 г воды.
После охлаждения раствора до 25 °С выпало 152 г
гексагидрата нитрата никеля, а концентрация соли
в растворе стала равна 50%. Определить
концентрацию исходного раствора нитрата никеля,
насыщенного при 50 °С.
Ответ. 58%.
7. При охлаждении 300 г насыщенного при 60 °С
раствора нитрата меди(II) (растворимость соли –
181,7 г на 100 г воды) до 25 °С выпало 75 г
кристаллогидрата нитрата меди, а концентрация
соли в растворе стала равна 60,1%. Установить
формулу кристаллогидрата.
Ответ. Cu(NO3)2•3H2O.
8. При охлаждении 200 г насыщенного при 40 °С
раствора фосфата натрия (растворимость соли – 23,3
г на 100 г воды) до 25 °С выпало 40,92 г
кристаллогидрата, а концентрация фосфата натрия
в растворе стала равна 12,66%. Установить формулу
кристаллогидрата.
Ответ. Na3PO4•12H2O.
9. При охлаждении 300 г насыщенного при 40 °С
раствора сульфата железа(II) (растворимость соли
– 40,1 г на 100 г воды) до 20 °С выпал гептагидрат
сульфата железа, а концентрация соли в растворе
стала равна 20,82%. Определить массу выпавшего
кристаллогидрата.
Ответ. 69,1 г.
10. В 100 г воды при 0 °С растворяется 127 г
бромида марганца. Массовая доля этой соли в
насыщенном при 40 °С растворе составляет 62,8%.
Насыщенный при 0 °С раствор массой 250 г нагрели
до 40 °С. Какую массу бромида марганца можно
дополнительно растворить в этом растворе?
Решение
В насыщенном при 0 °С растворе массовая доля
бромида марганца:
1(MnBr2)
= 127/227 = 0,56.
В 250 г этого раствора содержится:
m1(MnBr2) = 0,56•250 = 140 г.
При 40 °С для насыщения этого раствора
добавили mдоп(MnBr2), массовая доля соли
стала:
2(MnBr2)
= m2(MnBr2)/m2(р-ра) = (140 + mдоп(MnBr2))/(250
+ mдоп(MnBr2)) = 0,628.
Отсюда mдоп(MnBr2) = 45,7 г.
Ответ. 45,7 г.
Продолжение следует







 N
N