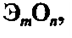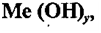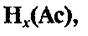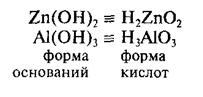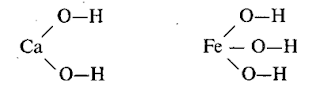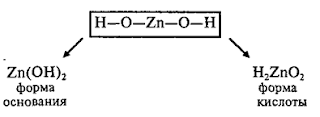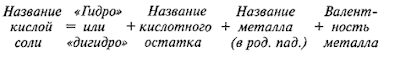При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
Для того чтобы
изобразить формулу соли графически,
следует:
1. Правильно написать
эмпирическую формулу этого соединения.
2. Учитывая, что
любая соль может быть представлена как
продукт нейтрализации соответствующих
кислоты и основания, следует изобразить
отдельно формулы кислоты и основания,
образовавших данную соль.
Например:
Ca(HSO4)2
– гидросульфат кальция можно получить
при неполной нейтрализации серной
кислоты H2SO4
гидроксидом кальция Са(ОН)2.
3. Определить, какое
количество молекул кислоты и основания
требуется для получения молекулы этой
соли.
Например:
Для получения
молекулы Ca(HSO4)2
требуется одна молекула основания (один
атом кальция) и две молекулы кислоты
(два кислотных остатка НSО4-1).
Са(ОН)2
+ 2H2SO4
= Ca(HSO4)2
+
2H2O
Построить графические
изображения формул установленного
числа молекул основания и кислоты и,
мысленно убрав, участвующие в реакции
нейтрализации и образующие воду, анионы
гидроксила основания и катионы водорода
кислоты, получить графическое изображение
формулы соли:
H
– O O H – O O
S
S
O – H
H – O O O O
Сa
+ → Ca
+ 2
H-O-H
O – H
H – O O O O
S
S
H-
O
O
H
– O
O
1.4.4. Физические свойства солей.
Соли представляют
собой твердые кристаллические вещества.
По растворимости в воде их можно
подразделить на:
1) хорошо растворимые,
2) мало растворимые,
3) практически
нерастворимые.
Большинство
солей азотной и уксусной кислот, а также
солей калия, натрия и аммония – растворимы
в воде.
Соли имеют широкий диапазон температур
плавления и термического разложения.
1.4.5. Химические свойства солей.
Химические свойства
солей характеризуют их отношение к
металлам, щелочам, кислотам и солям.
1. Соли
в растворах взаимодействуют с более
активными металлами.
Более активный
металл замещает менее активный металл
в соли (см. ряд активностей металлов).
Например:
Рb(NO3)2
+ Zn = Рb
+ Zn(NO3)2
Hg(NO3)2
+ Cu = Нg
+ Cu(NO3)2
2. Растворы
солей взаимодействуют со щелочами,
при этом получаются новое основание и
новая соль.
Например:
CuSO4
+ 2КОН = Сu(ОН)2
+ 2K2SO4
FeCl3
+3NаОН
= Fe(OH)3
+ 3NaCl
3. Соли
реагируют с растворами более сильных
или менее летучих кислот,
при этом получаются новая соль и новая
кислота.
Например:
а) в результате
реакции образуется более слабая кислота
или более летучая кислота:
Na2S
+ 2НС1 = 2NaCl
+ H2S
б) Возможны и
реакции с солей сильных кислот с более
слабыми кислотами, если в результате
реакции образуется малорастворимая
соль:
СuSО4
+ Н2S
= СuS
+ H2SO4
4. Соли
в растворах вступают в обменные реакции
с другими солями, при этом получаются
две новые соли.
Например:
NaС1
+ АgNO3
= AgCl
+ NaNO3
CaCI2
+ Na2CO3
= CaCO3
+ 2NaCl
CuSO4
+ Na2S
= CuS
+ Na2SO4
Обменные реакции
протекают практически до конца, если
один из продуктов реакции выделяется
из сферы реакции в виде осадка, газа
или, если при реакции образуется вода
или другой слабый электролит.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
25.03.201550.33 Mб46учебник элтех.PDF
- #
- #
- #
- #
- #
- #
- #
- #
ГРАФИЧЕСКИЕ ФОРМУЛЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
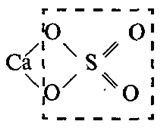
Очень часто формулы молекул оксидов, оснований, кислот, амфотерных гидроксидов и солей изображают графически. Для этого необходимо знать валентность каждого элемента, входящего в состав молекулы. Валентность элементов изображается черточками. Число черточек, отходящих от химического знака элементов, равно его валентности, например, Н , О =, Al и т.д.
Так как в молекуле свободные валентности отсутствуют, то надо так составить формулу, чтобы число черточек одного элемента соответствовало числу черточек другого элемента. Валентность разных атомов в молекуле взаимонасыщенна (отсутствуют свободные черточки), например, оксид натрия Na2O, в котором натрий одновалентен, а кислород двухвалентен.
Тогда графическая формула оксида имеет вид:
Na – O – Na
От атома кислорода отходят две черточки, от каждого атома натрия – по одной.
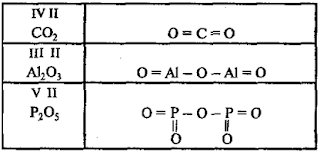
Графическая формула оксида алюминия Al2O3 имеет вид:
O = Al – O – Al = O
Алюминий трехвалентен, а кислород двухвалентен. От каждого атома алюминия отходят три черточки, от атома кислорода – две.
Графические формулы оснований
K – O – H H – O – Ba – O – H H – O – Al – О – Н
׀
O – H
KOH Ba(OH)2 Al(OH)3
гидроксид калия гидроксид бария гидроксид алюминия
В молекуле оснований атомы водорода связаны с кислородом.
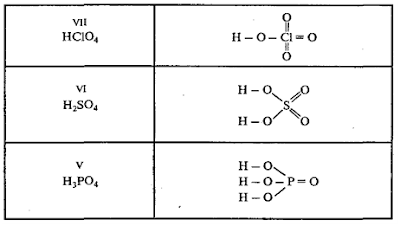
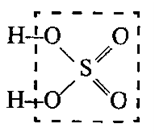
Графические формулы кислот
В молекулах кислородосодержащих кислот атомы водорода, способные замещаться металлом, связаны с атомом неметалла через кислород:


H – O ׀׀ ׀׀
O О
HNO3 H2CO3 H3PO4
азотная кислота угольная кислота ортофосфорная кислота
В состав уксусной кислоты СН3СООН входят четыре атома водорода, но только один из них связан с кислородом, поэтому в уксусной кислоте только один атом водорода, соединенный с атомом кислорода, способен замещаться атомом металла:
Н О
׀ ׀׀
Н – С – С – О – Н
׀
Н
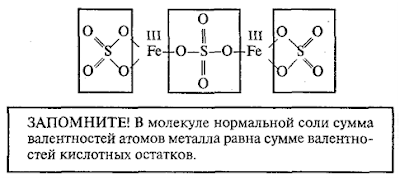
Графические изображения солей
Графическое изображение формул средних и особенно кислых солей часто вызывает затруднения. При их составлении нужно сначала написать графическое изображение формулы кислоты и затем заменить в ней полностью (нормальная соль) или частично (кислая соль) атомы водорода атомами металла. Если в молекулу соли входит несколько кислотных остатков, например, Mg(NO3)2, то нужно писать рядом столько формул кислоты, сколько кислотных остатков входит в молекулу соли, и заменить в них полностью атомы водорода атомами металла.
Графическая формула средней (нормальной) соли Mg(NO3)2 имеет вид:
HNO3 Mg(NO3)2
азотная кислота нитрат магния
O
׀׀
O – N = O
Mg
O – N = O
׀׀
O
O
׀׀
H – O – N = O
Mg
H – O – N = O
׀׀
O
Графическая формула кислой соли КHCO3 имеет вид:
Н2СО3 КНCO3
угольная кислота гидрокарбонат калия
К H – O – С – O – Н
׀׀
O
К – O – С – O – Н
׀׀
O
При составлении основных солей нужно сначала написать графическую формулу основания и затем заменить в ней частично гидроксогруппы ОН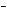
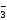
Графическая формула основной соли MgOHNO3 имеет вид:
Mg(OH)2 HNO3 MgOHNO3
гидроксид магния азотная кислота гидроксонитрат магния
O
׀׀
H – O – Mg – O – N = O
O
׀׀
H – O – Mg – O – H H – O – N = O
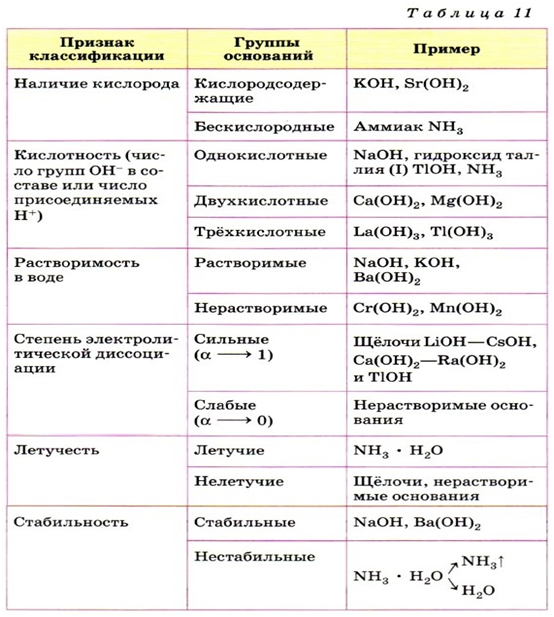
Раздел 1. Классификация неорганических веществ.
Состав, номенклатура и графические формулы оксидов, оснований, кислот и солей
1.1.
Важнейшие классы неорганических веществ
В
настоящее время известно около 400 тысяч различных неорганических веществ. Все неорганические
вещества можно разделить на классы – оксиды, кислоты, основания и соли. Каждый
класс объединяет вещества, сходные по составу и по свойствам.
Все
неорганические вещества делятся на простые
и сложные.
Простые
вещества подразделяются на металлы, неметаллы и инертные газы. Важнейшими
классами сложных неорганических веществ являются: оксиды, основания, кислоты,
амфотерные гидрокисды, соли.
Оксиды – это соединения двух элементов, один из
которых кислород. Общая формула оксидов:
где m – число атомов элемента Э; n – число атомов
кислорода.
Основания – это сложные вещества, молекулы которых
состоят из атома металла и одной или нескольких гидроксидных групп – ОН. Общая
формула оснований:
где
у – число гидроксидных групп, равное
валентности металла Ме.
Примеры
оснований:
Кислоты – это сложные
вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
Общая формула кислот:
где
Ас – кислотный остаток, х – число
атомов водорода, равное валентности кислотного остатка.
Примеры
кислот: НСl, HNO3, H2SO4, H3PO4.
Амфотерные
гидроксиды
– это сложные вещества, которые имеют свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов можно записывать в форме оснований и в
форме кислот.
Примеры
амфотерных гидроксидов:
Соли – это продукты
замещения атомов водорода в молекулах кислот атомами металла или это продукты
замещения гидроксидных групп в молекулах оснований кислотными остатками.
Например:
Состав
нормальных солей выражается общей формулой:
где
х
– число атомов металла; у –
число кислотных остатков.
Примеры
солей: К3РО4, МgSO4, FeCl3.
1.2.
Номенклатура, классификация и графические формулы оксидов
Номенклатура
Называются они просто – “оксид + название элемента”
(см. таблицу). Если валентность химического элемента переменная, то указывается
римской цифрой, заключённой в круглые скобки, после названия химического
элемента.
|
Формула |
Название |
Формула |
Название |
|
CO |
оксид |
Fe2O3 |
оксид |
|
NO |
оксид |
CrO3 |
оксид |
|
Al2O3 |
оксид |
ZnO |
оксид |
|
N2O5 |
оксид |
Mn2O7 |
оксид |
Классификация
оксидов
Все оксиды можно разделить на две группы:
солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или
безразличные.
1). Основные
оксиды – это оксиды, которым соответствуют основания. К основным
оксидам относятся оксиды металлов 1
и 2 групп, а также металлов побочных подгрупп с
валентностью I и II (кроме ZnO – оксид цинка и BeO – оксид берилия):
2). Кислотные
оксиды – это оксиды, которым соответствуют кислоты. К кислотным
оксидам относятся оксиды неметаллов (кроме
несолеобразующих – безразличных), а также оксиды металлов побочных
подгрупп с валентностью от V до VII (Например, CrO3-оксид
хрома (VI), Mn 2O7 – оксид марганца (VII)):
3). Амфотерные оксиды –
это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды
металлов главных и побочных подгрупп с
валентностью III, иногдаIV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие
оксиды – это оксиды безразличные к кислотам и основаниям. К ним
относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Вывод: характер
свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO (II – основный);
Cr 2O3 (III – амфотерный);
CrO3 (VII – кислотный).
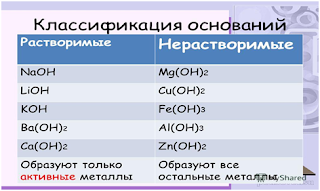
Классификация
оксидов
(по растворимости в воде)
|
Кислотные оксиды |
Основные оксиды |
Амфотерные оксиды |
|
Растворимы в воде. Исключение –SiO2 (не растворим |
В воде растворяются (это металлы I «А» и II «А» групп, исключение Be ,Mg) |
С водой не В воде не растворимы |
Графические
формулы
В
оксидах атомы кислорода связаны только с атомами другого элемента и не связаны
друг с другом. Например:
1.3.
Номенклатура, классификация и графические формулы оснований
Номенклатура
По номенклатуре основания называют гидроксидами. Если
валентность химического элемента переменная, то указывается римской цифрой,
заключённой в круглые скобки, после названия химического элемента:
|
Формула |
Название |
Формула |
Название |
|
LiOH |
гидроксид |
Ca(OH)2 |
гидроксид |
|
NaOH |
гидроксид |
Cu(OH)2 |
гидроксид |
|
KOH |
гидроксид |
Fe(OH)3 |
гидроксид |
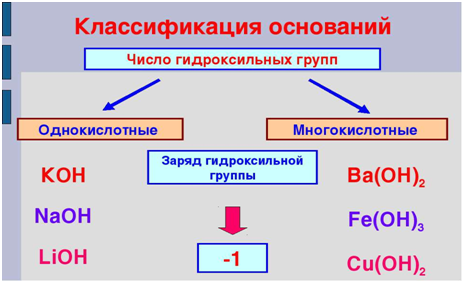
Классификация оснований
Графические
формулы
В молекуле
основания атом металла соединяется с атомами кислорода гидроксидных групп.
Например:
1.4.
Номенклатура, классификация и графические формулы кислот.
Понятие об амфотерных гидроксидах
Номенклатура
Названия кислородных
кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической
системы, и слова «кислота». По мере понижения
степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например,
HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O – хлорноватистая кислота.
Если элемент в одной и
той же степени окисления образует несколько кислородсодержащих кислот, то к
названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.
Например,
HBO2 – метаборная кислота, H3BO3 – ортоборная кислота; HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота.
Названия бескислородных
кислот образуются от названия элемента с окончанием на –о и прибавлением слова «водородная».
Например, HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная.
Помимо этих названий, в
русском языке применяются традиционные названия для некоторых важных и часто
применяемых соединений.
Например, HСl – соляная кислота;
HF – плавиковая кислота;
HCN – синильная кислота и др.
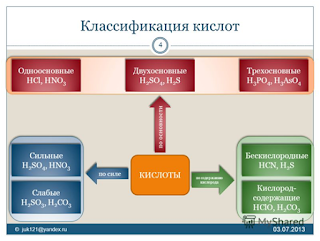
Классификация кислот
Графические
формулы
В
оксокислотах атомы водорода связаны с атомами кислорода, но не с атомами
кислотообразующего элемента. Например:
В
оксокислотах, молекулы которых содержат 2 и более атомов кислотообразующего
элемента, эти атомы соединяются через атомы кислорода. Например:
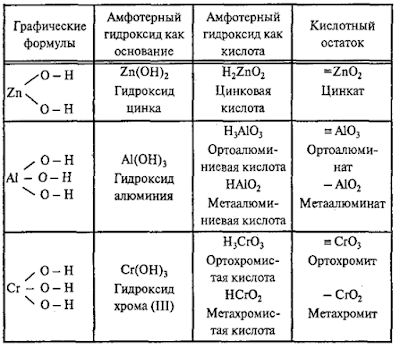
Амфотерные гидроксиды
Молекулярная
формула любого амфотерного гидроксида может быть записана в форме основания и в
форме кислоты:
Каждому
амфотерному гидроксиду можно дать название как основанию и как кислоте:
1.5.
Номенклатура, классификация и графические формулы солей
Номенклатура
Названия солей
для средней
соли –
название кислотного
остатка + название металла + указываем валентность для металла с переменной
валентностью
Na2SO4– сульфат натрия,
CuSO4–
сульфат меди (II)
для кислой соли
–
«гидро» или
«дигидро» + название кислотного остатка + название металла +
указываем валентность для металла с переменной валентностью
NaHSO4 –
гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название
металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl – гидроксохлорид магния
Классификация солей
Нормальные (средние) соли
Нормальные
(средние) соли – это продукты полного замещения атомов водорода в молекуле
кислоты атомами металла, или продукты полного замещениягидроксидных групп в
молекуле основания кислотными остатками. Например:
Графические
формулы
При
составлении графических формул нормальных солей следует в графических формулах
соответствующих кислот замещать атомы водорода атомами металла с учетом
валентности металла.
Составим
графическую формулу сульфата кальция СаSO4. Эта соль
содержит кислотный остаток серной кислоты Н2SO4:
Валентность
Са равна двум, поэтому один атом кальция замещает два атома водорода:
Составим
графическую формулу сульфата железа (III) Fe2(SO4)3.
Одна молекула этой соли содержит 3 кислотных остатка серной кислоты; один атом
трехвалентного железа замещает 3 атома водорода:
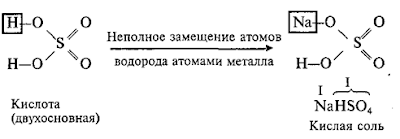
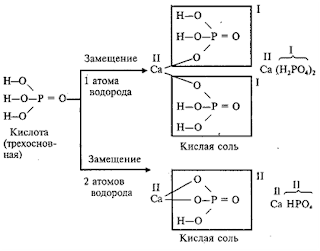
Кислые соли
Кислые
соли – это продукты неполного замещения атомов водорода в молекулах
многоосновных кислот атомами металла.
Например:
Двухосновная
кислота с любым металлом образует одну нормальную и одну кислую соль.
Трехосновная кислота с любым металлом образует одну нормальную и две кислые
соли.
Молекулы
кислых солей содержат атомы водорода, латинское название которого
«гидрогениум»:
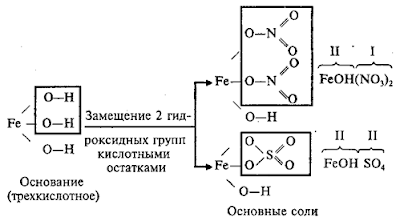
Основные соли
Основные
соли – это продукты неполного замещения гидроксидных групп в молекулах
многокислотных оснований кислотными остатками. Например:
Двухкислотное
основание образует одну нормальную и одну основную соль с данным кислотным
остатком.
Трехкислотное
основание образует одну нормальную и две основные соли с данным кислотным
остатком.
Молекулы
основных солей содержат гидроксидные группы:
УПРАЖНЕНИЯ
1.
Классифицируйте
следующие кислоты по основности и по содержанию атомов кислорода: Н3РО4, НNO2, H2S,
HCN, HClO3,
H2CO3,
HF.
Решение:
Одноосновные
кислоты: НNO2, HCN,
HF, HClO3
Двухосновные
кислоты: H2S, H2CO3
Трехосновные
кислоты: Н3РО4
Бескислородные
кислоты: H2S, HCN, HF
Кислородсодержащие
кислоты: Н3РО4, НNO2, HClO3, H2CO3
____________________________________________________________
2.
Классифицируйте
и назовите следующие соли: BaSO4,
(CuOH)2SO4, NaH2PO4, Ca(HS)2, FeOHCl2, AlPO4, MnOHNO3.
Решение:
Нормальные
соли: BaSO4
– сульфат бария, AlPO4
–
фосфат алюминия.
Кислые
соли: NaH2PO4
– дигидрофосфат натрия, Ca(HS)2 – гидросульфид
кальция.
Основные
соли: (CuOH)2SO4 –
гидроксосульфат меди (II),
FeOHCl2
–
гидроксохлорид железа (III),
MnOHNO3
–
гидроксонитрат марганца (II).
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
2.
Составьте формулы
предложенных веществ:
Оксид калия, оксид серы (VI), гидроксид
магния, гидроксид меди (II), оксид бария, оксид азота (II), оксид цинка,
гидроксид натрия, оксид фосфора (III), оксид углерода (II), оксид
углерода (IV), оксид алюминия.
3.
Классифицируйте соли (средние
(нормальные), кислые, основные):
Na2CO3; K2SO4; AI(OH)CI;
NaHCO3; Ba(NO3)2; Ca(HCO3)2;
K3PO4; Ca(OH)CI; KH2PO4.
4.
Классифицируйте следующие
кислоты по основности и по содержанию атомов кислорода:
HI, H2S, HNO2, HMnO4, H2CO3.
5.
Напишите формулы и названия
оксидов, гидратами которых являются следующие кислоты: H2SiO3, HNO2, H2CrO4, H3PO4, H2MnO4.
6.
Определите валентность
кислотообразующих элементов в следующих кислотах и напишите графические формулы
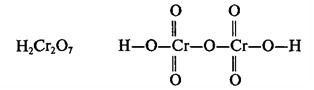
этих кислот: HClO, H2Cr2O7,
H4P2O7.
7.
Напишите формулы следующих
амфотерных гидроксидов в форме кислот и определите валентность кислотных
остатков в этих кислотах: Cr(OH)3, Sn(OH)2, Pb(OH)2.
8.
Классифицируйте и назовите
следующие соли:
9.
Напишите молекулярные и графические
формулы следующих солей: а) дигидрофосфат натрия; б) сульфат алюминия; в) гидроксосульфат цинка; г) бромид железа (III);
д) перманганат калия.
10.
Напишите молекулярные и графические формулы
нормальных солей, которые могут быть получены в результате замещения в молекуле
амфотерного гидроксида Zn(OH)2: а) гидроксидных групп кислотными остатками
азотной кислоты; б) атомов водорода
атомами натрия. Назовите эти соли.
|
1. К амфотерным |
|
|
1. а) CuO |
2. б) P2O3 |
|
3. в) Cr2O3 |
4. г) CrO3 |
|
2. Среди перечисленных веществ |
|
|
1. а) гидрид магния |
2. б) гидрокарбонат натрия |
|
в) гидроксид |
3. г) гидроксокарбонат меди |
|
3. Какой из элементов может |
|
|
1. а) Стронций |
2. б) марганец |
|
3. в) кальций |
г) магний |
|
4. Оксид серы (VI) взаимодействует с |
|
|
1. а) водой и соляной кислотой; 2. |
3. б) кислородом и оксидом магния |
|
4. в) оксидом кальция и гидроксидом |
5. г) водой и медью |
|
5. Гидроксид железа (III) образуется |
|
|
1. а) оксид железа (II); |
б) оксид |
|
в) растворы |
г) растворы |
|
6. Хлорид железа (II) реагирует с |
|
|
1. а) MgO , HCl |
2. б) Zn , AgNO3 |
|
3. в) HNO3, CO2 |
г) CaO, CO2 |
|
7. В схеме превращений CaCO3 → X1 → X2 + NaCl |
|
|
1. а) CaCO3 |
2. б) CaCl2 |
|
3. в) CaO |
4. г) Ca(OH)2 |
|
8. К основным оксидам относится: |
|
|
1. а) ZnO |
2. б) SiO2 |
|
3. в) BaO |
4. г) l2O3 |
|
9. Высший оксид элемента с |
|
|
1. а) основным |
2. б) кислотным |
|
3. в) амфотерным |
4. г) несолеобразующим |
|
10. Оксид углерода (IV) |
|
|
1. а) водой и оксидом кальция |
2. б) кислородом и оксидом серы (IV) |
|
3. в) сульфатом калия и гидроксидом |
4. г) фосфорной кислотой и водородом |
Ответы:
|
1 |
в |
|
2 |
б |
|
3 |
б |
|
4 |
в |
|
5 |
г |
|
6 |
б |
|
7 |
а |
|
8 |
в |
|
9 |
б |
|
10 |
а |