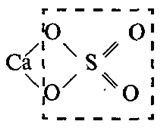
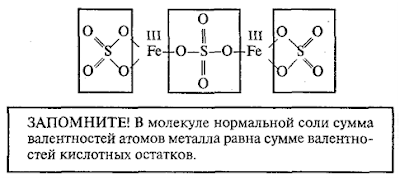
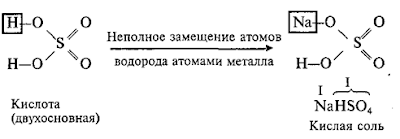
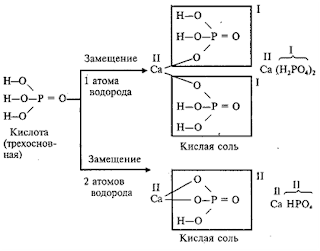
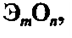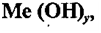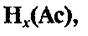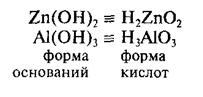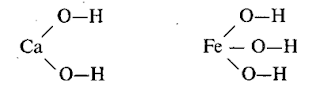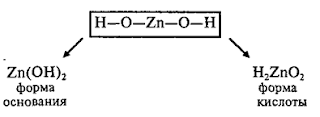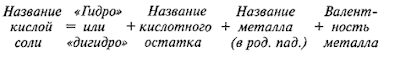При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
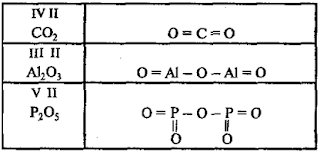
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
ГРАФИЧЕСКИЕ ФОРМУЛЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Очень часто формулы молекул оксидов, оснований, кислот, амфотерных гидроксидов и солей изображают графически. Для этого необходимо знать валентность каждого элемента, входящего в состав молекулы. Валентность элементов изображается черточками. Число черточек, отходящих от химического знака элементов, равно его валентности, например, Н , О =, Al и т.д.
Так как в молекуле свободные валентности отсутствуют, то надо так составить формулу, чтобы число черточек одного элемента соответствовало числу черточек другого элемента. Валентность разных атомов в молекуле взаимонасыщенна (отсутствуют свободные черточки), например, оксид натрия Na2O, в котором натрий одновалентен, а кислород двухвалентен.
Тогда графическая формула оксида имеет вид:
Na – O – Na
От атома кислорода отходят две черточки, от каждого атома натрия – по одной.
Графическая формула оксида алюминия Al2O3 имеет вид:
O = Al – O – Al = O
Алюминий трехвалентен, а кислород двухвалентен. От каждого атома алюминия отходят три черточки, от атома кислорода – две.
Графические формулы оснований
K – O – H H – O – Ba – O – H H – O – Al – О – Н
׀
O – H
KOH Ba(OH)2 Al(OH)3
гидроксид калия гидроксид бария гидроксид алюминия
В молекуле оснований атомы водорода связаны с кислородом.
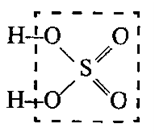
Графические формулы кислот
В молекулах кислородосодержащих кислот атомы водорода, способные замещаться металлом, связаны с атомом неметалла через кислород:


H – O ׀׀ ׀׀
O О
HNO3 H2CO3 H3PO4
азотная кислота угольная кислота ортофосфорная кислота
В состав уксусной кислоты СН3СООН входят четыре атома водорода, но только один из них связан с кислородом, поэтому в уксусной кислоте только один атом водорода, соединенный с атомом кислорода, способен замещаться атомом металла:
Н О
׀ ׀׀
Н – С – С – О – Н
׀
Н
Графические изображения солей
Графическое изображение формул средних и особенно кислых солей часто вызывает затруднения. При их составлении нужно сначала написать графическое изображение формулы кислоты и затем заменить в ней полностью (нормальная соль) или частично (кислая соль) атомы водорода атомами металла. Если в молекулу соли входит несколько кислотных остатков, например, Mg(NO3)2, то нужно писать рядом столько формул кислоты, сколько кислотных остатков входит в молекулу соли, и заменить в них полностью атомы водорода атомами металла.
Графическая формула средней (нормальной) соли Mg(NO3)2 имеет вид:
HNO3 Mg(NO3)2
азотная кислота нитрат магния
O
׀׀
O – N = O
Mg
O – N = O
׀׀
O
O
׀׀
H – O – N = O
Mg
H – O – N = O
׀׀
O
Графическая формула кислой соли КHCO3 имеет вид:
Н2СО3 КНCO3
угольная кислота гидрокарбонат калия
К H – O – С – O – Н
׀׀
O
К – O – С – O – Н
׀׀
O
При составлении основных солей нужно сначала написать графическую формулу основания и затем заменить в ней частично гидроксогруппы ОН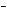
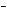
Графическая формула основной соли MgOHNO3 имеет вид:
Mg(OH)2 HNO3 MgOHNO3
гидроксид магния азотная кислота гидроксонитрат магния
O
׀׀
H – O – Mg – O – N = O
O
׀׀
H – O – Mg – O – H H – O – N = O
Раздел 1. Классификация неорганических веществ.
Состав, номенклатура и графические формулы оксидов, оснований, кислот и солей
1.1.
Важнейшие классы неорганических веществ
В
настоящее время известно около 400 тысяч различных неорганических веществ. Все неорганические
вещества можно разделить на классы – оксиды, кислоты, основания и соли. Каждый
класс объединяет вещества, сходные по составу и по свойствам.
Все
неорганические вещества делятся на простые
и сложные.
Простые
вещества подразделяются на металлы, неметаллы и инертные газы. Важнейшими
классами сложных неорганических веществ являются: оксиды, основания, кислоты,
амфотерные гидрокисды, соли.
Оксиды – это соединения двух элементов, один из
которых кислород. Общая формула оксидов:
где m – число атомов элемента Э; n – число атомов
кислорода.
Основания – это сложные вещества, молекулы которых
состоят из атома металла и одной или нескольких гидроксидных групп – ОН. Общая
формула оснований:
где
у – число гидроксидных групп, равное
валентности металла Ме.
Примеры
оснований:
Кислоты – это сложные
вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
Общая формула кислот:
где
Ас – кислотный остаток, х – число
атомов водорода, равное валентности кислотного остатка.
Примеры
кислот: НСl, HNO3, H2SO4, H3PO4.
Амфотерные
гидроксиды
– это сложные вещества, которые имеют свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов можно записывать в форме оснований и в
форме кислот.
Примеры
амфотерных гидроксидов:
Соли – это продукты
замещения атомов водорода в молекулах кислот атомами металла или это продукты
замещения гидроксидных групп в молекулах оснований кислотными остатками.
Например:
Состав
нормальных солей выражается общей формулой:
где
х
– число атомов металла; у –
число кислотных остатков.
Примеры
солей: К3РО4, МgSO4, FeCl3.
1.2.
Номенклатура, классификация и графические формулы оксидов
Номенклатура
Называются они просто – “оксид + название элемента”
(см. таблицу). Если валентность химического элемента переменная, то указывается
римской цифрой, заключённой в круглые скобки, после названия химического
элемента.
|
Формула |
Название |
Формула |
Название |
|
CO |
оксид |
Fe2O3 |
оксид |
|
NO |
оксид |
CrO3 |
оксид |
|
Al2O3 |
оксид |
ZnO |
оксид |
|
N2O5 |
оксид |
Mn2O7 |
оксид |
Классификация
оксидов
Все оксиды можно разделить на две группы:
солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или
безразличные.
1). Основные
оксиды – это оксиды, которым соответствуют основания. К основным
оксидам относятся оксиды металлов 1
и 2 групп, а также металлов побочных подгрупп с
валентностью I и II (кроме ZnO – оксид цинка и BeO – оксид берилия):
2). Кислотные
оксиды – это оксиды, которым соответствуют кислоты. К кислотным
оксидам относятся оксиды неметаллов (кроме
несолеобразующих – безразличных), а также оксиды металлов побочных
подгрупп с валентностью от V до VII (Например, CrO3-оксид
хрома (VI), Mn 2O7 – оксид марганца (VII)):
3). Амфотерные оксиды –
это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды
металлов главных и побочных подгрупп с
валентностью III, иногдаIV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие
оксиды – это оксиды безразличные к кислотам и основаниям. К ним
относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Вывод: характер
свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO (II – основный);
Cr 2O3 (III – амфотерный);
CrO3 (VII – кислотный).
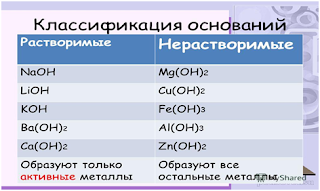
Классификация
оксидов
(по растворимости в воде)
|
Кислотные оксиды |
Основные оксиды |
Амфотерные оксиды |
|
Растворимы в воде. Исключение –SiO2 (не растворим |
В воде растворяются (это металлы I «А» и II «А» групп, исключение Be ,Mg) |
С водой не В воде не растворимы |
Графические
формулы
В
оксидах атомы кислорода связаны только с атомами другого элемента и не связаны
друг с другом. Например:
1.3.
Номенклатура, классификация и графические формулы оснований
Номенклатура
По номенклатуре основания называют гидроксидами. Если
валентность химического элемента переменная, то указывается римской цифрой,
заключённой в круглые скобки, после названия химического элемента:
|
Формула |
Название |
Формула |
Название |
|
LiOH |
гидроксид |
Ca(OH)2 |
гидроксид |
|
NaOH |
гидроксид |
Cu(OH)2 |
гидроксид |
|
KOH |
гидроксид |
Fe(OH)3 |
гидроксид |
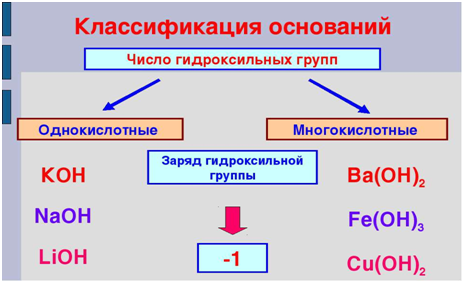
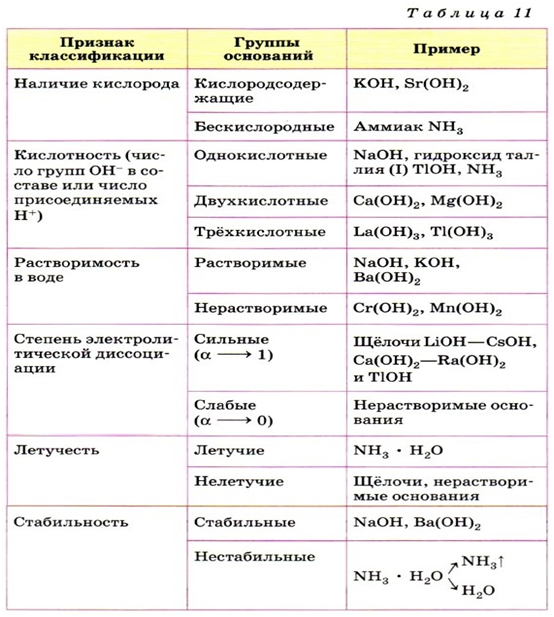
Классификация оснований
Графические
формулы
В молекуле
основания атом металла соединяется с атомами кислорода гидроксидных групп.
Например:
1.4.
Номенклатура, классификация и графические формулы кислот.
Понятие об амфотерных гидроксидах
Номенклатура
Названия кислородных
кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической
системы, и слова «кислота». По мере понижения
степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например,
HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O – хлорноватистая кислота.
Если элемент в одной и
той же степени окисления образует несколько кислородсодержащих кислот, то к
названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.
Например,
HBO2 – метаборная кислота, H3BO3 – ортоборная кислота; HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота.
Названия бескислородных
кислот образуются от названия элемента с окончанием на –о и прибавлением слова «водородная».
Например, HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная.
Помимо этих названий, в
русском языке применяются традиционные названия для некоторых важных и часто
применяемых соединений.
Например, HСl – соляная кислота;
HF – плавиковая кислота;
HCN – синильная кислота и др.
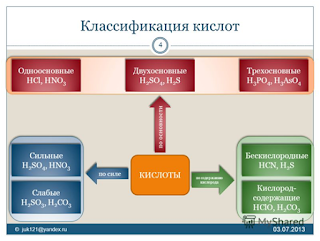
Классификация кислот
Графические
формулы
В
оксокислотах атомы водорода связаны с атомами кислорода, но не с атомами
кислотообразующего элемента. Например:
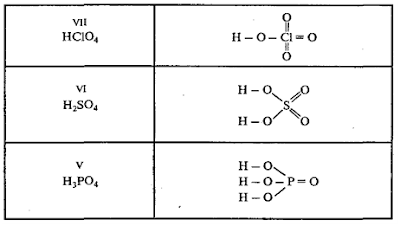
В
оксокислотах, молекулы которых содержат 2 и более атомов кислотообразующего
элемента, эти атомы соединяются через атомы кислорода. Например:
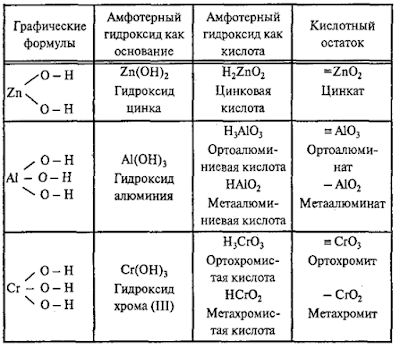
Амфотерные гидроксиды
Молекулярная
формула любого амфотерного гидроксида может быть записана в форме основания и в
форме кислоты:
Каждому
амфотерному гидроксиду можно дать название как основанию и как кислоте:
1.5.
Номенклатура, классификация и графические формулы солей
Номенклатура
Названия солей
для средней
соли –
название кислотного
остатка + название металла + указываем валентность для металла с переменной
валентностью
Na2SO4– сульфат натрия,
CuSO4–
сульфат меди (II)
для кислой соли
–
«гидро» или
«дигидро» + название кислотного остатка + название металла +
указываем валентность для металла с переменной валентностью
NaHSO4 –
гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название
металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl – гидроксохлорид магния
Классификация солей
Нормальные (средние) соли
Нормальные
(средние) соли – это продукты полного замещения атомов водорода в молекуле
кислоты атомами металла, или продукты полного замещениягидроксидных групп в
молекуле основания кислотными остатками. Например:
Графические
формулы
При
составлении графических формул нормальных солей следует в графических формулах
соответствующих кислот замещать атомы водорода атомами металла с учетом
валентности металла.
Составим
графическую формулу сульфата кальция СаSO4. Эта соль
содержит кислотный остаток серной кислоты Н2SO4:
Валентность
Са равна двум, поэтому один атом кальция замещает два атома водорода:
Составим
графическую формулу сульфата железа (III) Fe2(SO4)3.
Одна молекула этой соли содержит 3 кислотных остатка серной кислоты; один атом
трехвалентного железа замещает 3 атома водорода:
Кислые соли
Кислые
соли – это продукты неполного замещения атомов водорода в молекулах
многоосновных кислот атомами металла.
Например:
Двухосновная
кислота с любым металлом образует одну нормальную и одну кислую соль.
Трехосновная кислота с любым металлом образует одну нормальную и две кислые
соли.
Молекулы
кислых солей содержат атомы водорода, латинское название которого
«гидрогениум»:
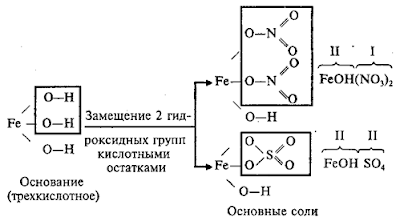
Основные соли
Основные
соли – это продукты неполного замещения гидроксидных групп в молекулах
многокислотных оснований кислотными остатками. Например:
Двухкислотное
основание образует одну нормальную и одну основную соль с данным кислотным
остатком.
Трехкислотное
основание образует одну нормальную и две основные соли с данным кислотным
остатком.
Молекулы
основных солей содержат гидроксидные группы:
УПРАЖНЕНИЯ
1.
Классифицируйте
следующие кислоты по основности и по содержанию атомов кислорода: Н3РО4, НNO2, H2S,
HCN, HClO3,
H2CO3,
HF.
Решение:
Одноосновные
кислоты: НNO2, HCN,
HF, HClO3
Двухосновные
кислоты: H2S, H2CO3
Трехосновные
кислоты: Н3РО4
Бескислородные
кислоты: H2S, HCN, HF
Кислородсодержащие
кислоты: Н3РО4, НNO2, HClO3, H2CO3
____________________________________________________________
2.
Классифицируйте
и назовите следующие соли: BaSO4,
(CuOH)2SO4, NaH2PO4, Ca(HS)2, FeOHCl2, AlPO4, MnOHNO3.
Решение:
Нормальные
соли: BaSO4
– сульфат бария, AlPO4
–
фосфат алюминия.
Кислые
соли: NaH2PO4
– дигидрофосфат натрия, Ca(HS)2 – гидросульфид
кальция.
Основные
соли: (CuOH)2SO4 –
гидроксосульфат меди (II),
FeOHCl2
–
гидроксохлорид железа (III),
MnOHNO3
–
гидроксонитрат марганца (II).
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
2.
Составьте формулы
предложенных веществ:
Оксид калия, оксид серы (VI), гидроксид
магния, гидроксид меди (II), оксид бария, оксид азота (II), оксид цинка,
гидроксид натрия, оксид фосфора (III), оксид углерода (II), оксид
углерода (IV), оксид алюминия.
3.
Классифицируйте соли (средние
(нормальные), кислые, основные):
Na2CO3; K2SO4; AI(OH)CI;
NaHCO3; Ba(NO3)2; Ca(HCO3)2;
K3PO4; Ca(OH)CI; KH2PO4.
4.
Классифицируйте следующие
кислоты по основности и по содержанию атомов кислорода:
HI, H2S, HNO2, HMnO4, H2CO3.
5.
Напишите формулы и названия
оксидов, гидратами которых являются следующие кислоты: H2SiO3, HNO2, H2CrO4, H3PO4, H2MnO4.
6.
Определите валентность
кислотообразующих элементов в следующих кислотах и напишите графические формулы
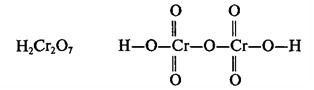
этих кислот: HClO, H2Cr2O7,
H4P2O7.
7.
Напишите формулы следующих
амфотерных гидроксидов в форме кислот и определите валентность кислотных
остатков в этих кислотах: Cr(OH)3, Sn(OH)2, Pb(OH)2.
8.
Классифицируйте и назовите
следующие соли:
9.
Напишите молекулярные и графические
формулы следующих солей: а) дигидрофосфат натрия; б) сульфат алюминия; в) гидроксосульфат цинка; г) бромид железа (III);
д) перманганат калия.
10.
Напишите молекулярные и графические формулы
нормальных солей, которые могут быть получены в результате замещения в молекуле
амфотерного гидроксида Zn(OH)2: а) гидроксидных групп кислотными остатками
азотной кислоты; б) атомов водорода
атомами натрия. Назовите эти соли.
|
1. К амфотерным |
|
|
1. а) CuO |
2. б) P2O3 |
|
3. в) Cr2O3 |
4. г) CrO3 |
|
2. Среди перечисленных веществ |
|
|
1. а) гидрид магния |
2. б) гидрокарбонат натрия |
|
в) гидроксид |
3. г) гидроксокарбонат меди |
|
3. Какой из элементов может |
|
|
1. а) Стронций |
2. б) марганец |
|
3. в) кальций |
г) магний |
|
4. Оксид серы (VI) взаимодействует с |
|
|
1. а) водой и соляной кислотой; 2. |
3. б) кислородом и оксидом магния |
|
4. в) оксидом кальция и гидроксидом |
5. г) водой и медью |
|
5. Гидроксид железа (III) образуется |
|
|
1. а) оксид железа (II); |
б) оксид |
|
в) растворы |
г) растворы |
|
6. Хлорид железа (II) реагирует с |
|
|
1. а) MgO , HCl |
2. б) Zn , AgNO3 |
|
3. в) HNO3, CO2 |
г) CaO, CO2 |
|
7. В схеме превращений CaCO3 → X1 → X2 + NaCl |
|
|
1. а) CaCO3 |
2. б) CaCl2 |
|
3. в) CaO |
4. г) Ca(OH)2 |
|
8. К основным оксидам относится: |
|
|
1. а) ZnO |
2. б) SiO2 |
|
3. в) BaO |
4. г) l2O3 |
|
9. Высший оксид элемента с |
|
|
1. а) основным |
2. б) кислотным |
|
3. в) амфотерным |
4. г) несолеобразующим |
|
10. Оксид углерода (IV) |
|
|
1. а) водой и оксидом кальция |
2. б) кислородом и оксидом серы (IV) |
|
3. в) сульфатом калия и гидроксидом |
4. г) фосфорной кислотой и водородом |
Ответы:
|
1 |
в |
|
2 |
б |
|
3 |
б |
|
4 |
в |
|
5 |
г |
|
6 |
б |
|
7 |
а |
|
8 |
в |
|
9 |
б |
|
10 |
а |
Соли – это продукты
полного или неполного замещения атомов
водорода кислоты на атомы металла или
гидроксильных групп основания на кислоты
остаток.
Основная реакция
препаротивного получения солей –
взаимодействие кислоты и основания. По
полноте этой реакции соли делятся на
нормальные (или средние), кислые и
основные.
К нормальным, или
средним, солям относятся продукты
полного замещения атомов водорода
кислоты на атомы металла или гидроксильных
групп основания на кислотный остаток.
Например:
Ca
(OH)2+2HNO3=Ca
(NO3)2+H2O
Ca
(OH)2+2H++2NO3–
+2H2O
Здесь все (две, а
не одна)гидроксильные группы основания
Ca
(OH)2
замещены на кислотный остаток NO3–.
2NaOH +
H2CO3
= Na2CO3
+ H2O
2Na+
+2OH–
+H2CO3
=2Na+
+CO2-3
+ H2O
Здесь все (два, а
не один ) атомы водорода кислоты H2CO3
замещены на атомы металла Na.
Изображение
графических
формул
нормальных солей (как и вообще солей)
удобнее начинать с построения кислотного
остатка. Например, для силиката бария
BaSiO3
кислотный остаток имеет вид:
— O
—
O
= Si
— O
—
В отличие от
электронейтральной молекулы кислоты
он потерял два атома водорода. Этот
кислотный остаток обеими своими
свободными связями в молекуле BaSiO3
связан с атомом бария, который имеет
степень окисления 2+:
— O
—
O
= Si
Ва
— O
—
Кислотные соли
являются продуктом не полного замещения
атомов водорода кислоты на металл. Их
могут образовывать лишь многоосновные
кислоты. В состав кислой соли будет
входить кислотный остаток, содержащий
хотя бы один атом водорода. Например:
H2SO4
-серная кислота, Na2SO4–
нормальная соль, NaHSO4
– кислая соль. Кислотный остаток HSO4
– образовался при отщеплении от кислоты
одного атома водорода. Если кислота
трехосновная, она может образовывать
два ряда кислых солей , соответствующих
замене на атомы металла одного или двух
атомов водорода. Например, фосфорная
кислота Н3РО4
может образовывать кислые соли с
различными кислотными остатками:
NaH2SO4
и NaHSO4
, Са (Н2РО4)2,Са
НРО4,
При графическом
изображении
кислых солей удобно сначало представить
кислотный остаток, учитывая что в него
входит незамещенный атом водорода, а
затем к свободной валентности присоединить
атом металла.
H
– O
–
C
= O
Na
– O
–
Основные соли
занимают промежуточное положение между
основаниями и солями, а значит содержат,
кроме атомов металла и кислотных
остатков, гидроксильные группы, «вязанные
с металлом. Они являются продуктом
неполного замещения гидроксильных
групп гидроксида (двух- и более) кислотным
остатком. Например: СаОНСl, СuОНNО и т. д.
В этих солях количество кислотных
остатков равно количеству замещенных
ОН¯ — групп, так как это соли одноосновных
кислот.
Если гидроксид
трехкислый, то он может образовывать
два основных остатка . Например, Al
(OH)3
образует Al
(OH)1+2
и Al
OH2+.
Заряды этих ионов равны количеству
гидроксильных групп, недостающих до
электронейтральной молекулы гидроксида.
С любой кислотой в этом случаи может
образовываться два ряда солей, формулы
которых будут зависеть от заряда
кислотного остатка HNO3
и H2CO3
получим: Al
(OH)2
NO3
и [Al
(OH)2
]2CO3,
Al
OH
(NO3)2,
и Al
OH
CO3
При изображении
графических формул основных солей надо
четко представить, из каких и скольких
основных и кислотных остатков состоит
данная соль. Например, гидроксо-карбонат
кальция имеет формулу (СаОН)2СО3
и состоит из двух основных остатков
—Са—О—Н и одного кислотного.
– О –
О = С
– О –
Сочетая их вместе
,получаем правильную графическую
формулу:
–
О – Са -О – Н
О = С
–
О -Са – О – Н
Мы выяснили
особенности строения молекул трех
основных типов солей. Однокислотное
основание может с одноосновной кислотой
образовывать лишь одну среднюю
(нормальную) соль, с двухосновной кислотой
– одну среднюю и одну кислую соль, с
трехосновной – одну среднюю и две
кислых и. т. д. Например, в зависимости
от взятых соотношений Na OH и H3PO4,
можно получить:
3 Na OH +
H3PO
4
= Na3PO4
+ 3H2O
2 Na OH +
H3
PO4
= Na 2HppPO4+2H2O
Na OH + H3PO4
= NaH2PO4
+ H2O
Аналогично,
одноосновная кислота может образовать
с двухкислотным основанием одну среднюю
и одну основную соль, с трехкислотным
– одну среднюю и две основные соли
и.т.д. Пример:
Al ( OH)3
+3HCl = AlCl3
+ 3 H2O
Al (OH)3
+ 2HCl + AlHCl2
+ 2H2O
Al(OH)3
+ HCl = Al(OH)2Cl
+ H2O
МНОГООСНОВНЫЕ
КИСЛОТА ИОСНОВАНИЕ МОГУТ ДАТЬ, КРОМЕ
СРЕДНЕЙ СОЛИ, И КИСЛЫЕ, И ОСНОВНЫЕ. Так
при взаимодействии Са (ОН)2
и Р3Ро4
могут быть получены : одна нормальная
соль Са3
,(РО4)2,две
кислые соли Са(Н2РО4)2
и СаНро4,одна
основная соль (СаОн)3РО4.
Схема образованиявания
кислых и основных солей дана приложении.
Пример: 3. Составить
формулы всех возможных солей, образуемых
Fe(OH)3
и H3PO4.
Привести их названия.
Поскольку соль
образуется соединением двух остатков
(кислоты и основания), то целесообразно
использовать заряды этих остатков
целиком, а не рассматривать отдельные
элементы. Тогда задача сводится просто
к подбору в молекулах индексов,
обеспечивающих электронейтральность.
Фосфорная кислота
способна дать при остатке H2PO4
-HPO2-4,
и PO3-4
(их отрицательные заряды удобно подсчитать
по числу положительных ионов водорода,
отщепившихся от нейтральной молекулы
H3PO4).
Электронейтральнось молекул, образованных
этими остатками с Fe3+,обеспечивается
соответствующими индексами в формулах.
Fe3=
(H2PO4)3-Fe3+2
(HPO4)2-3
и
Fe3+PO3-4
Гироксид железа
(111) способен дать при остатке Fe (OH)2FeOH2+
и Fe3+(их
положительные заряды удобно подсчитать
по числу отрицательных ионов гидроксила
(OH),отщепившихся от нейтральной молекулы
Fe(OH)3.
Электронейтральность молекул, образованных
этими остатками с РО3-4,обеспечивается
соответствующими индексами в формулах:
[Fe
(OH)2]3+
PO3-4,(Fe
OH)2+3
(PO)3-2,Fe3+PO3-4
Последняя формула
совпадает с раннее полученной в предыдущем
ряду.
В соответствии с
приложением 1,составляем название
полученных солей:
Fe PO4
фосфат железа
Fe2
(HPO4)3
гадрофосфатжелеза
Fe2(H2PO4)3
дигидрофосфат железа
(FeOH)3
(PO4)2
гидроксофосфат железа
[Fe (OH)2]3PO4
дигидроксофосфат железа
Контрольные
задания:
10. Составьте формулы
высших оксидов элементов, являющихся
макроэлементами в питании растений, и
формулы высших оксидов для микроэлементов.
Изобразите их графически. Укажите
характер этих оксидов (кислотный,
основной, амфотерный). Напишите возможные
реакции их взаимодействия с водой.
11-20. Составьте
формулы всех солей, соответствующих
кислотам и основаниям, приведенным для
вашего задания в таблице 2. Написать
уравнения реакций их получения из
кислоты и основания в молекулярной и
ионной форме. Для амфотерных гидроксидов
необходимо составлять формулы их солей,
образованных как при реакциях с кислотами,
так и с основаниями.
При написании
уравнений руководствоваться таблицей
растворимости и таблицей степеней
диссоциации.
Таблица 2
|
№ задания |
Исходные вещества |
|
11 12 13 14 15 16 17 18 19 20 |
NaOH CsOH LiOH NH4OH KOH Sr Ba(OH)2 Ca(OH)2 Fe(OH)2 Ca(OH)2 |
Смотрите свой
вариант в таблице на с. 8.
1.2. Строение атома
и периодический закон Д. И. Менделеева
ЛИТЕРАТУРА: 1, гл.
II,
$ 1—12, с. 26—73.
Методические
советы
При изучении этого
материала следует усвоить современные
взгляды на «корпускулярно-волновое
состояние» электрона в атоме, вероятностный
характер распределения плотности
электронного облака и квантование
поведения электрона по энергии, формам
орбиталей и их положению в пространстве.
Поскольку каждый электрон в атоме
характеризуется собственным набором
квантовых чисел, то они помогают показать
распределение электронов в атоме.
Конечным результатом
изучения этой темы является умение
составить электронную формулу любого
атома, выявить его валентность и возможные
степени окисления.
Вопросы для
самопроверки:
1. Какие вы знаете
элементарные частицы? Укажите их основные
характеристики.
2. Что такое
радиоактивность? Какие виды радиоактивных
излучений
3. Укажите средние
размеры атома. Во сколько раз отличаются
размеры ядер от размеров атомов?
4. Какие квантовые
числа характеризуют энергию электрона
в атоме в отсутствие внешних электрических
и магнитных полей?
5. Каков порядок
заполнения орбиталей? Сформулируйте
правило Тунда. Какова форма з- и
р-электронных облаков?
6. Какое максимальное
количество электронов может размещаться
на 1з, 2з, Зз -подуровнях? Чему равен угол
между р – орбиталями в атоме?
7. Дайте современную
формулировку периодического закона Д.
И. Менделеева. Как его формулировал сам
Д. И. Менделеев?
8. Что такое
периодичность? В чем причина периодического
изменения свойств элементов? Какие
главнейшие свойства элементов меняются
периодически?
9. Каков физический
смысл номера периода, номера группы?
Дайте определение понятиям группа,
период, семейство.
10. Что такое
потенциал ионизации, сродство к электрону,
электроотрицательность?
Контрольные
задания:
21-30. Составте
электронные формулы и представьте
графически размещения электронов по
квантовым ячейкам для указанных в
таблице 3 элементов. Соответствующих
вашему заданию. Воспользуйтесь схемами
из учебника (1 гл.2 §8 с.49-53). Проанализируйте
возможности разъединения спаренных
электронов при возбуждении атомов с
образованием валентных электрононов
в соответствии с теорией спин-валентности.
Таблица3
-
№ задания
Элементы
21
22
23
24
25
26
27
28
29
30
Кремний,скандий
азот,титан
углерод,ванадий
фтор,хром
алюминий,мышьяк
кремний,бром
фосфор,калий
сера,кальций
хлор.бериллий
аргон,железо
31-40. Проанализируйте
изменения величины зарядов ядер, радиусов
атомов, электроотрицательностей и
степеней окисления элементов в
соответствии с вашим вариантом (см.
таблицу 4). Каковы закономерности этих
изменений при движении по группе сверху
вниз или по периоду слева на право. Как
изменяется в этом направлении металличность
элементов и характер их оксидов и
гидроксидов.
Таблица
-
№ задания
задание
1
2
31
32
33
34
35
36
37
38
39
40
Элементы 2 периода
элементы
3 периодаэлементы
4 периодаэлементы
5 периодаэлементы
4В группыэлементы
2А группыэлементы
2В группыэлементы
5А группыэлементы
6В группыэлементы
7В группы
1.3. Химическая
связь и строение молекул
ЛИТЕРАТУРА: 1, гл.
III,
§ 1—12, с. 76—107.
Напоминаем, что
вопросы для самопроверки являются
планом изучения темы «Химическая связь
и строение молекул».
Вопросы для
самопроверки:
-
Ионная и ковалентная
связь. Электронно-точечные представления.
Примеры. -
Металлическая
связь. Обоснование общности физических
и химических свойств металлов. -
Донорно-акцепторная
связь. Необходимые условия ее
образования. Перспективы химии
комплексных соединений. -
Водородная связь,
ее природа и особенности, ее роль в
молекулярной биологии. -
Влияние типа
химической связи в молекуле на физические
свойства веществ. -
Способы перекрывания
атомных орбиталей, отвечающие образованию
а и л-связей. Их относительная прочность.
Геометрия молекул. -
Орбитальные модели
молекул на примере Н23, РС1з. -
Гибридизация
атомных орбиталей и геометрия молекул
ВеР2, ВН3, СН4. -
Валентность и
степень окисления. Всегда ли совпадают
они по величине?
Примеры.
Контрольные
задания:
41-50. Для предложенного
в вашем задании (табл. 5) соединения
постройте графическую формулу и укажите
виды химической связи в этой молекуле:
ионная, ковалентная полярная, ковалентная
неполярная, координативная, металлическая,
водородная.
ПРИМЕР: Графическая
формула сульфата натрия.
Na—O–
=O
S
Na—O–
=O
Связь Na-
O
ионная; связь O-S
ковалентная полярная
Номенклатуру солей
см. приложение 1.
Таблица 5
|
№ задания |
Соединения |
|
41 |
Гидросульфат |
|
42 |
Карбонат кальция |
|
43 |
Тиосульфат |
|
44 |
Гидрокарбонат |
|
45 |
Гидросульфат |
|
46 |
Дигидрофосфат |
|
47 |
Гидрофосфат |
|
48 |
Нитрат аммония |
|
49 |
Гидроксонитрат |
|
50 |
Фосфат алюминия |
1.4. Основные законы
химических превращений
ЛИТЕРАТУРА:
1, гл. IV,
§
1—10, с. 111—127
Методические
советы
Химические
реакции осуществляют для получения
необходимых веществ или энергии за счет
их протекания. Рассмотрение реальности
протекания химического процесса следует
проводить с двух позиций — энергетической
и кинетической. Сначала необходимо
оценить, возможна ли вообще данная
реакция в заданных условиях. Анализ
энергетических соотношений показывает,
что самопроизвольно протекают процессы
в сторону наиболее вероятного состояния
систем. В частности, в результате таких
процессов энергия выделяется и система
переходит в состояние с меньшей энергией.
В практике, однако, обнаруживается, что
некоторые из таких процессов протекают
настолько медленно, что их невозможно
использовать. Поэтому рассмотрение
способов и путей влияния на скорость
процесса существенно для его практической
реализации.
Предлагаемые ниже
вопросы для самопроверки могут служить
одновременно и планом изучения данной
темы.
Вопросы
для самопроверки:
-
Дайте определение
понятию «скорость химической реакции».
В каких единицах она измеряется? Какие
факторы влияют на скорость химической
реакции? -
Сформулируйте
закон действия масс. Приведите примеры
того, как аналитически (уравнением)
можно записать закон действия масс для
реакций, протекающих в гомогенной и
гетерогенной системах. -
Что
такое константа скорости химической
реакции, от каких факторов она зависит? -
Сформулируйте
правило Вант-Гоффа. Дайте пример расчета
изменений скорости реакции при повышении
или понижении температуры с использованием
этого правила. -
Почему часть
столкновений между молекулами не
приводит к протеканию реакции? Что
такое энергия активации? -
Как
можно объяснить механизм действия
катализаторов при гомогенном катализе,
гетерогенном катализе? -
Чем
характеризуется состояние химического
равновесия? Какие, величины, характеризующие
прямую и обратную реакции при химическом
равновесии, равны друг другу? -
Приведите примеры
обратимых и необратимых процессов. Как
связана константа равновесия с
константами скоростей прямого и
обратного процесса? -
Какие факторы
влияют на положение равновесия в
гомогенных жидких и газообразных
системах? Как они влияют?
10.
Сформулируйте принцип Ле-Шателье. Как
влияет изменение давления, температуры
и концентрации реагирующих веществ на
положение равновесия в системе 25О2
+ О2
= 25Оз?
Контрольные
задания:
51-55. Дайте определение
понятию скорость химической реакции.
Опишите количественно (где это можно),
как влияют на скорость реакции внешние
условия (концентрация, температура,
давление). Рассчитайте, во сколько раз
изменится скорость реакции при изменении
указанных в таблице (табл. 6) условий.
Таблица 6
|
№ задания |
Реакция |
Наименование |
Температурный |
Изменение давления |
|
51 52 53 54 55 |
– – H2+Cl2=2HCl 2Fe+O2=2FeO CaO+CO2=CaCO3 |
Уменьшение на
Увеличение на – – – |
2 3 – – – |
– –
Увеличение в 3
Уменьшение в 2 Увеличение |
56-60.
Чем характеризуется состояние химического
равновесия? От каких факторов зависит
константа равновесия, положение
равновесия? Предскажите в соответствии
с принципом Ле-Шателье смещение равновесия
в соответствии с изменением внешних
условий (отдельно для разных факторов)
по данным таблицы 7
Таблица 7
|
№ задания |
Реакция |
Изменение |
Изменение давления |
Изменение |
|
56 |
CO2+CaCO3+H2O |
Понижение |
Понижение |
Увеличение |
|
57 |
NH3+H2O=NH4OH+Q |
Повышение |
Понижение |
Уменьшение |
|
58 |
N2O4=2NO2-Q |
Повышение |
Понижение |
Увеличение |
|
59 |
4NH3+5NO2=4NO+6H2O(пар)+Q |
Повышение |
Понижение |
Уменьшение |
|
60 |
2CO+O2=2CO2+Q |
повышение |
повышение |
Увеличение |
1.5. Растворы
Литература:
1, гл. V
& 1-11, с.138-189.
Методические
советы
Изучение
этой темы целесообразно разбить на три
этапа. Сначала изучите материал по
учебнику и попробуйте ответить на
контрольные вопросы 61-70, являющиеся
одновременно вопросами для самопроверки.
Затем следует выполнить задачи –
упражнения на нахождение концентраций
растворов (№ 71-80) и после этого разобраться
с гидролизом солей в соответствии с
настоящими методическими указаниями.
Контрольные вопросы
61. Какие системы
называются растворами? Что у них общего
со смесями?
62.
Водные растворы и их значение в жизни
растений и животных.
63.
Каковы причины образования растворов?
Какова природа взаимодействия веществ
в растворах?
64. Что
такое электрическая диссоциация? Какова
роль растворителя в процессе электрической
диссоциации? Какие вещества называются
электролитами, неэлектролитами?
65. Что называется
степенью электролитической диссоциации
от концентрации и температуры раствора?
66. Что такое
константа диссоциации? От каких факторов
она зависит? Какова взаимосвязь между
степенью диссоциации и константой
диссоциации? Активность и коэффициент
активности иона.
67. Какие соединения
называются кислотами и основаниями с
точки зрения электрической диссоциации?
Чем обуславливается сравнительная сила
кислот и оснований?
68.
Какие гидроксиды называются амфотерными?
Напишите примеры уравнений их диссоциации
в кислой и щелочной средах.
69. Что
называется ионным произведением воды?
Чему оно равно? Дайте вывод выражения
ионного произведения воды (Кв). Как
влияет температура на ионное произведение
воды?
70. Что такое рН,
рОН? Какими величинами рН характеризуется
нейтральная, кислая и щелочная среда?
Как рассчитывать рН растворов сильных
и слабых кислот и оснований?
1.5.1. Концентрация
растворов
Методические
советы
В химических
расчетах используется в основном три
вида концентрации:
-
процентная
концентрация показывает, сколько
граммов растворенного вещества находится
в 100 г раствора, -
молярная
концентрация показывает, сколько молей
растворенного вещества находится в 1
л (1000 мл) раствора, -
нормальная
концентрация показывает, сколько молей
эквивалентов растворенного вещества
находится в 1 л (1000 мл) раствора.
При решении задач
по переходу от одного вида концентрации
к другому важно четко разграничить
количество растворенного вещества и
растворителя, массу и объем и т. д.
Контролируется это согласованием единиц
измерения в «столбиках» составляемых
пропорций.
Количество
растворенного вещества выражают в
граммах гпг, в молях пм, в молях эквивалентов
пэ.
Количество
раствора выражают в граммах G,
в миллилитрах V,
Связь между этими
величинами:
m
m
G
Пм=—–
Пэ=——- p=——–
М
(1) Э (2) V
(3)
Где М и Э –
молекулярная и эквивалентная масса
соответственно.
р – плотность
раствора.
Задачи на пересчет
из одной концентрации в другую являются
составным этапом большинства задач,
включающих свойства растворов.
ПРИМЕР
4. Найти молярную концентрацию 10% раствора
сахарозы. Плотность раствора 1,08 г/мл.
Формула сахарозы –C12H22O11
Запишем условия
задачи так, чтобы было ясно, какие
количества вещества нам даны.
Количество
растворенного вещества
Количество
раствора
Хм
——————-1000мл
10г
——————-
100г
«Столбики» этой
записи сознательно отклонены от
«вертикалей» вследствие различия единиц
измерения. Это сразу определяет
необходимость дополнительных
предварительных действий:
а) выясним, каково
количество молей в 10 г сахарозы (можно
использовать формулу 1)
m
10
nm
= —-=—– моль
M
342
б) вычислим массу
1000 мл раствора (можно использовать
формулу
3):
G=1.08*1000
г
Пропорция для
решения задачи будет иметь вид:
Хм
——————1000мл=1,08*1000г
10
—– моль=10г
—————— 100г
342
Решаем ее, используя
строгие «вертикали» с совпадающими
единицами измерения:
H2SO4 (p=1.03).
Исходная пропорция:
Хг
———————–100г
0,1 моль экв.
———————– 1000мл
С
учетом эквивалента H2SO4
(49) и плотности:
Хг
———————- 100г
49*0,1 г = 0,1 моль экв.
—————— 1,03*1000 г = 1000мл
Получаем:
49*0,1*100
Х=
——————–=0,475 г
1,03*1000
Контрольные
задания
71-80. В соответствии
с номером вашего задания заполните
пропуски в таблице 8. Например, в задаче
76 надо найти молярную
и нормальную концентрацию 10%-ного
раствора СиЗО4
(плотность раствора 1,1 г/мл).
Таблица 8
|
№ задания |
Растворенное |
Концентрация |
Плотность раствора |
||
|
Процент. |
молярная |
нормальная |
|||
|
71 |
12 |
1,05 |
|||
|
72 |
1,3 |
1,02 |
|||
|
73 |
7 |
1,05 |
|||
|
74 |
0,3 |
1,01 |
|||
|
75 |
0,5 |
1,027 |
|||
|
76 |
15 |
Принять 1,1 |
|||
|
77 |
0,1 |
Принять 1,0 |
|||
|
78 |
4 |
1,01 |
|||
|
79 |
0,8 |
Принять 1,0 |
|||
|
80 |
0,2 |
Принять 1,0 |
1.5.2. Гидролиз солей
Методические
советь/
Ввиду особой
важности гидролиза солей в регулировании
биологических процессов следует четко
отработать навыки написания уравнений
гидролиза после проработки по учебнику
(§ 9 с. 170—173).
Поставим себе
задачу составления уравнений гидролиза
только по первой ступени (наиболее
реальной в обычных условиях). Рекомендуемая
последовательность действий:
а) составить
уравнения диссоциации соли;
б) выяснить, по
какому иону идет гидролиз.
Это и есть сугубо
химический аспект гидролиза. Здесь
используются справочные данные для
определения «слабости» электролита,
таблица растворимости (приложение 2),
таблица степеней диссоциации (приложение
3).
в) составить для
этого иона уравнение реакции взаимодействия
с водой (с одной молекулой, т. к. речь
идет о первой ступени). Это уравнение и
будет сокращенным ионным уравнением
гидролиза, оно определяет наступающее
в растворе равновесие и характеризуется
собственной константой.
г) записать уравнение
гидролиза в молекулярном виде. При этом
в основу берется ионное уравнение (пункт
в), а для составления нейтральных молекул
используются противоионы из уравнения
диссоциации соли (пункт а).
ПРИМЕР 6. Составить
уравнение гидролиза сульфата меди.
а)
CuSO4
= Cu2++SO42-
б) из
приложений 3 выясняем, что иону Сu2+
соответствует слабое основание, а иону
SO42-—
сильная кислота, значит, гидролиз идет
по катиону:
в)
Cu2+
+H2O
= (CuHO)++H+
Естественно,
что положительный ион Сu2+
«вырвет» из воды отрицательную часть
OH-
Заряд образовавшегося иона СuОН+
определяем суммированием зарядов Си2+
и ОН~. Не забудьте, что связывание ионов
ОН–
ведет к избытку в растворе ионов Н+,
что определит кислую реакцию среды.
Выражение для
константы гидролиза имеет вид:
(CuOH+)*(H+)
Kr= ———————–
(Cu2+)
г) при
составлении уравнения в молекулярной
форме констатируем, что всем положительным
ионам уравнения (2) соответствуют
имеющиеся в свободном виде (уравнение
1) отрицательные ионы SO42-
С учетом зарядов ионов составляем
электронейтральные молекулы:
CuSO4+H2O=(CuOH)2SO4+Н2SО4
а затем подбираем
необходимые коэффициенты:
2CuSО4+2H2O=
(CuOH)2SO4+H2SO4
Напоминаем,
что в растворе реально существуют ионы
НзО+
а не Н+.
Контрольные
задания:
81-90.
Составьте ионные и молекулярные уравнения
гидролиза приведенных в вашем задании
солей. Укажите реакцию среды в растворе
соли. Напишите выражения для константы
гидролиза.
81. Нитрат магния,
сульфит натрия.
82. Нитрат меди,
карбонат калия.
83. Сульфат алюминия,
силикат калия
84.
Хлорид железа (III),
сульфид натрия.
85. Сульфат аммония,
цианид калия.
86. Хлорид аммония,
сульфид бария.
87.
Сульфат магния (II),
карбонат калия.
88.
Нитрат алюминия, ацетат кальция
89. Хлорид цинка,
силикат калия.
90.
Сульфат железа (II)?
Фосфат калия.
1.6. Комплексные
соединения
Литература
:1, гл .VI,
& 1 -8, с.193 – 207
Методические
указания
При
изучении этой темы обратите внимание
на отсутствие строгого определения
понятия «комплексное соединение».
Комплексным соединением можно называть
соединения сложного состава, в которых
выделяют центральный атом
(комплексообразователь) и непосредственно
связанные с ним молекулы или ионы
(лиганды). Проанализируйте, какие частицы
из ниже перечисленных можно называть
комплексными с этой точки зрения: NO3-;
NH4+
; (Cu
(NH3)4)2+;
CaCl2;
K3(Fe(CN)6)
; H2S
В
некоторых случаях указывают, что
комплексообразователь должен быть
связан с лигандами донорно- акцепторной
связью. Учитывая этот факт, проанализируйте
еще раз приведенный перечень. Какие
частицы являются комплексными с учетом
этой второй точки зрения?
Названия
комплексных частиц дают, указывая
сначала названия лигандов, затем
комплексообразователя с указанием
степени окисления.
CN-
(и др. галогены) – хлоро;, H2O
– акво = ; NH3
– амин; CN-
_ циано = (и др.)
Количество
лигандов указывают приставками: ди,
три, тетра, пента, гекса.
Названия
соединений с комплексным анионом
оканчиваются суффиксом «-ат», в комплексных
катионах название комплексообразователя
дается без специальных окончаний,
Примеры:
Ca2(Fe(CN)6)
– гексацианоферрат (II)
кальция,
(Fe(Н2O6)SO4
– сульфат гексааквожелеза (II)
Вопросы
для самопроверки:
1.
Основные положения координационной
теории Вернера.
2. Что
такое лиганды? Комплексообразователь?
Координационное число? Внутренняя и
внешняя сфера комплекса?
3.
Номенклатура комплексных соединений.
4. Как
происходит диссоциация комплексных
электроситов?
5. Что
такое константы устойчивости комплексных
соединений?
Контрольные
задания:
91-100.
Заполните таблицу 9 в соответствии с
вашим вариантом, указав комплексообразователь
лиганды, координационное число, внутреннюю
и внешнюю среду по формуле комплексного
соединения, или составив соответствующую
формулу по указанному комплексообразователю,
лигандам и координационному числу.
Дайте название этим веществам.
Таблица 9
|
№ задания |
Комплексообразователь |
Лиганд |
Координационное число |
Внутренняя сфера комплекса |
Ионы внешней сферы |
Формула комплексного |
Выражение для общей константы |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
91 |
Zn2+ |
OH- |
4 |
Na+ |
K2(PtCl6) |
||
|
92 |
Al3+ |
OH- |
6 6 |
K+ K+ |
K4(Fe(CN)6) |
||
|
93 |
Cr3 |
OH- |
6 |
K+ |
K3(Fe(CN)6) |
||
|
94 |
Pt4+ |
NH3 |
4 |
(Cu(H2O)52+ |
SO42- Cl- |
||
|
95 |
NO2– |
(Co(No2)6)3+ |
Na+ |
(Cu(NH3)4)SO4 |
|||
|
96 |
(PtBr6)2– |
Na+ |
Fe3(Fe(CN)6)4 |
||||
|
97 |
Co3+ |
NO2– |
6 |
K+ |
(Cr(H2O)6)Cl3 |
||
|
98 |
(SiF6)2– |
Na+ |
(Ca(NH3)8)Cl2 |
||||
|
99 |
Ag+ |
CN- |
2 |
Na+ |
K2(PtCl4) |
||
|
100 |
Co2+ |
CNS- |
4 |
NH4+ |
(Ag(NH3)2)Cl |
1.7. Реакции
окисления-восстановления
ЛИТЕРАТУРА:
1, гл. VI,
§ 1—6, с. 209-253
Методические
советы
Тщательно
проработайте по учебнику (1, гл. VI,
§ 3) метод электронного баланса с целью
выработки умения подбора коэффициентов
в окислительно-восстановительных
реакциях. Вопросы контрольных заданий
могут послужить вам в качестве упражнений.
Контрольные
задания:
101-110. Составьте
электронные уравнения и подберите
коэффициенты в реакциях, соответствующих
вашему заданию. Рассчитайте, сколько
граммов окислителя требуется для
восстановления 10 г соответствующего
реакции восстановителя.
101.
KMnO4+Na2S+H2SO4=K2SO4+MnSO4+Na2SO4+H2O
102.
KMnO4+H2O2+H2SO4
= K2SO4
+MnSo4+O2+H2O
103.
MnO2+HCl
= MnCl2+Cl2
+H2O
104.
Cu+HNO3
= Cu (NO3)2+No+H2O
105.
K2Cr2O7+Na2SO3+H2SO4=K2SO4+Cr2(SO4)3+Na2SO4+H2O
106.
KMnO4+H3PO3+H2SO4
=MnSO4+H3PO4+K2SO4+H2O
107.
K2Cr2O7+HCl
= Cl2+CrCl3+KCl+H2O
108.
KMnO4+KNO2+H2SO4
= K2SO4+MnSO4+KNO3+H2O
109.
Na2S+K2Cr2O7+H2SO4
=Na2SO4+K2SO4+Cr2(SO4)3+H2O
110.
KMnO4+HCl+HCl
= Cl2+KCl+MnCl2+H2O
чувак, а что ты плохого сделал своему учителю химии?
было 2 молекулы ортофосфорной кислоты Н3РО4, т. е. О=Р (ОН) 3
её формулу я тебе покажу http://ru.wikipedia.org/wiki/Ортофосфорная_кислота а дальше включай воображение
у одной молекулы у одного гидроксила убрали только водород, а у другой гидроксил и образовавшейся на его месте свободной связью прицепили на место водорода к первой молекуле. МОЖЕТЕ РЖАТЬ!! !а как я ещё это объясню на пальцах?? ?
получили O=P(OH)(ОН) -O-(OH)(ОН) P=O гидроксилы в скобках рисуешь вверх и вниз от атома фосфора.
Ba(H3P2O7)2 – рисуешь одну под другой две молекулы пирофосфорной кислоты у одного из гидроксилов у каждой молекулы убираешь водород O=P(OH)(ОН) -O-(OH)(О-)P=O и соединяешь молекулы через атом бария Р-О-Ва-О-Р
Ba(H3P2O7)2 – здесь не знаю.. .
то ли водород замещается у двух гидроксилов у одного атома фосфора и получается O=P(O-)(О-)-O-(OH)2P=O,
то ли по водороду у одного из гидроксилов у разных атомов фосфора O=P(OН) (О-)-O-(OH)(О-)P=O и вместо водорода рисуешь по связи к барию (я за этот вариант. но понятия не имею почему) .
(BaOH)4P2O7 это просто. замещаешь все водороды на (ВаОН)
O=P(ОВаOH)(ОВаОН) -O-(ОВаOH)(ОВаОН) P=O
каждый из них выглядит Р-О-Ва-О-Н
Ba3(HP2O7)2 это самое интересное и весёлое.
я думаю, что рисуешь одну под другой две молекулы BaH2P2O7. затем у каждой из молекул у одного из гидроксилов убираешь водород и молекулы соединяешь через ещё один атом бария.
в каждом из соединений фосфор должен иметь 5 связей, кислород и барий по 2, водород разумеется одну.
извини. как смог, так и объяснил…