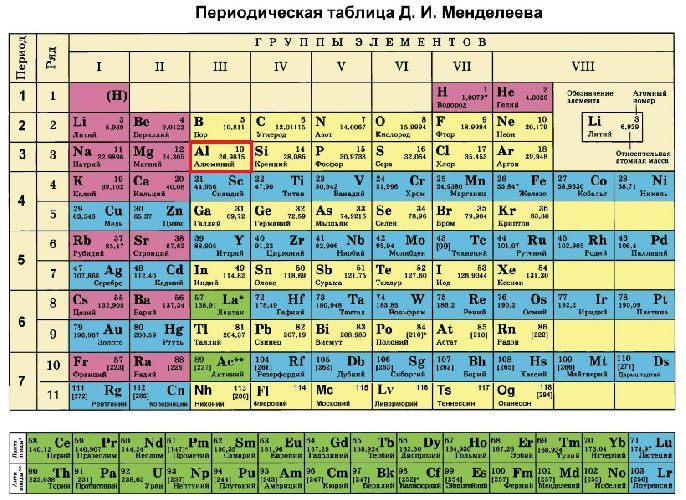
Al (алюминий) – элемент с прядковым номером 13 в периодической системе.
Находится в III периоде. Температура плавления: 660.5 ℃. Плотность: 2.7 г/см3.
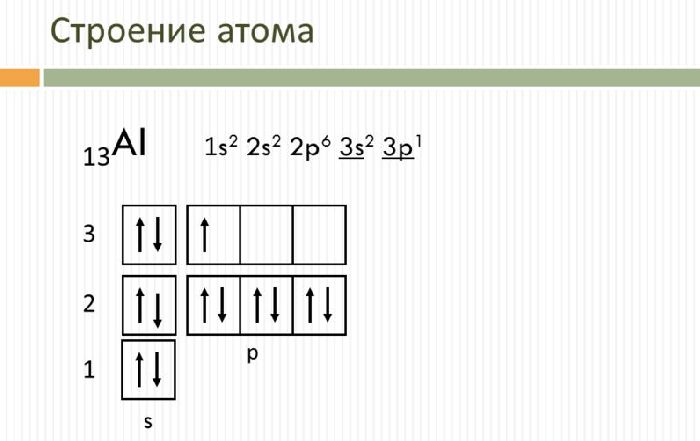
Электронная формула атома алюминия:
1s2 2s2 2p6 3s2 3p1
Сокращенная электронная конфигурация Al:
[Ne] 3s2 3p1
Ниже приведена электронно-графическая схема атома алюминия

Распределение электронов по энергетическим уровням в атоме Al
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 3

Валентные электроны алюминия
Количество валентных электронов в атоме алюминия – 3.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
Степени окисления, которые может проявлять алюминий: +3
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Электронное строение атома алюминия
Электронное строение нейтрального атома алюминия в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме алюминия.
Al
+13
2
8
3
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме алюминия.
| 3 | ↑↓ | ↑ | ||||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома алюминия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома алюминия.
13Al 1s2 2s2 2p6 3s2 3p1
Сокращённая электронная конфигурация атома алюминия.
13Al [Ne] 3s2 3p1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома алюминия.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ | ||||
| 3p | 3 | 1 | -1 | +½ |
| 1 | +½ | |||
| 2 | +½ |
Строение атома алюминия


4.6
Средняя оценка: 4.6
Всего получено оценок: 479.
4.6
Средняя оценка: 4.6
Всего получено оценок: 479.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.

Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
|
Взаимодействие |
Ход реакции |
Пример |
|
С водой |
Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия |
2Al + 6H2O → 2Al(OH)3 + 3H2 |
|
С кислородом |
Образуется оксид алюминия |
4Al + 3O2 → 2Al2O3 + Q |
|
С галогенами |
При комнатной температуре. С йодом – в присутствии катализатора |
2Al + 3Cl2 → 2AlCl3 |
|
С серой |
При температуре выше 200°С, образуется сульфид алюминия |
2Al + 3S → Al2S3 |
|
С фосфором |
При температуре 500°С, образуется фосфид алюминия |
Al + P → AlP |
|
С азотом |
При температуре 800°С, образуется нитрид алюминия |
2Al + N2 → 2AlN |
|
С углеродом |
При температуре 2000°С, образуется карбид алюминия |
4Al + 3C → Al4C3 |
|
С кислотами |
При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли |
– 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
|
Со щелочами |
Реагируют растворы и сплавы |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
|
С оксидами |
Вытесняет металлы |
2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.

Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

El’nore Christopher
5/5
-

Александр Котков
5/5
-

Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 479.
А какая ваша оценка?
Электронная формула Алюминия Al (графическая схема строения атома)
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,410
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,042
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Электронное строение атома алюминия
Электронное строение нейтрального атома алюминия в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме алюминия.
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме алюминия.
| 3 | ↑↓ | ↑ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
| 1 | ↑↓ | |||
| s | p |
Валентные орбитали атома алюминия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома алюминия.
13Al 1s 2 2s 2 2p 6 3s 2 3p 1
Сокращённая электронная конфигурация атома алюминия.
13Al [Ne] 3s 2 3p 1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома алюминия.
Электронные формулы атомов химических элементов (Таблица)
Таблица содержит электронные формулы атомов химических элементов (слои расположены в порядке заполнения подуровней)
Электронная формула показывает распределение электронов на орбиталях в атоме:

Формирование электронной оболочки атома происходит в соответствии с 3-мя принципами:
1. Принцип минимума энергии, который определяет заполнение атомных орбиталей с наименьшей энергией
[spoiler title=”источники:”]
http://chemer.ru/services/elements/electrons/Al
http://infotables.ru/khimiya/825-elektronnye-formuly-atomov-khimicheskikh-elementov
[/spoiler]
