Технологические карты к учебнику О. С. Габриеляна «Химия. 9 класс»
Смотреть все за 9 класс
|
ПЛАНИРУЕМЫЕ ОБРАЗОВАТЕЛЬНЫЕ РЕЗУЛЬТАТЫ |
||
|
Предметные |
Метапредметные |
Личностные |
|
Умения характеризовать химиеские элементы 1-3го периодов по их положению в Периодической системе химических элементов Д. И. Менделеева; обосновывать свойства оксидов и гидроксидов металлов и неметаллов посредством молекулярных, полных и сокращенных ионных уравнений реакций |
Умения строить логические рассуждения, устанавливать причинноследственные связи, осуществлять сравнение, создавать обобщения, устанавливать аналогии, делать выводы; понимать, структурировать и интерпретировать информацию, представленную в табличной форме |
Понимание значимости фундаментальных представлений об атомномолекулярном строении вещества для формирования целостной естественнонаучной картины мира |
|
Решаемая учебная проблема |
Какую информацию можно получить о свойствах химического элемента и его соединений исходя из положения элемента в Периодической системе химических элементов Д. И. Менделеева? |
|
|
Основные понятия, изучаемые на уроках |
Характеристика элемента металла, характеристика элемента неметалла, генетические ряды металла, генетические ряды неметалла |
|
|
Демонстрации. Лабораторные опыты |
Демонстрации. Модели атомов элементов 1—3го периодов |
|
|
Вид используемых на уроках средств ИКТ |
Универсальные (электронные книги, компьютер, интерактивная доска) |
|
|
ОРГАНИЗАЦИОННАЯ СТРУКТУРА УРОКОВ |
||
|
ЭТАП 1. Вхождение в тему урока и создание условий для осознанного восприятия нового материала Диалог на уроке |
||
|
Формирование конкретного образовательного результата / группы результатов |
Актуализация знаний о строении атома и Периодическом законе Д. И. Менделеева, классификации неорганических веществ и их свойствах в свете теории электролитической диссоциации и окислительновосстановительных реакциях, о генетической связи между классами соединений |
|
|
Длительность этапа |
35—40 минут |
|
|
Основной вид учебной деятельности, направленный на формирование данного образовательного результата |
Устные и письменные ответы обучающихся на вопросы учителя. Обсуждение сказанного, записи обучающихся в тетрадь |
|
|
Методы обучения |
Диалогическое изложение. Систематизирующая беседа |
|
|
Форма организации деятельности обучающихся |
Коллективная мыслительная деятельность |
|
|
Функция / роль учителя на данном этапе |
Организаторская, корректирующая |
|
|
Основные виды деятельности учителя |
Координация деятельности обучающихся |
|
ЭТАП 2. Организация и самоорганизация обучающихся в ходе дальнейшего усвоения материала Систематизация пройденного материала |
|
|
Формирование конкретного образовательного результата / группы результатов |
Умение характеризовать химические элементы по их положению в периодической таблице Д. И. Менделеева |
|
Длительность этапа |
35—40 минут |
|
Основной вид учебной деятельности, направленный на формирование данного образовательного результата |
Самостоятельная работа по составлению характеристик химических элементов—металлов и неметаллов по их положению в периодической таблице Д. И. Менделеева. Составление генетических рядов металлов и неметаллов |
|
Методы обучения |
Самостоятельная работа с последующей само или взаимопроверкой и коррекцией допущенных ошибок |
|
Форма организации деятельности обучающихся |
Коллективная и индивидуальная мыслительная деятельность |
|
Функция / роль учителя на данном этапе |
Организаторская, контролирующая, корректирующая |
|
Основные виды деятельности учителя |
Координация, контроль, коррекция деятельности обучающихся |
|
ЭТАП 3. Подведение итогов, домашнее задание |
|
|
Формирование конкретного образовательного результата / группы результатов |
Обобщение. Устный ответ на проблемный вопрос уроков |
|
Длительность этапа |
3—5 минут |
|
Форма организации деятельности обучающихся |
Индивидуальная, коллективная |
|
Функция / роль учителя на данном этапе |
Организация самоконтроля обучающихся с последующей самооценкой |
|
Основные виды деятельности учителя |
Координация деятельности обучающихся |
|
Рефлексия по достигнутым или недостигнутым образовательным результатам |
Обучающиеся оценивают свою работу на уроке, учитель выставляет отметки за конкретные виды работы обучающимся на основе их самооценки. Домашнее задание с комментариями |
Тема уроков. Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева.
Цель уроков. Формирование умений характеризовать химические элементы и их соединения исходя из положения элементов в периодической таблице Д. И. Менделеева.
Проблемный вопрос уроков. Какую информацию можно получить о свойствах химического элемента и его соединений исходя из положения элемента в Периодической системе химических элементов Д. И. Менделеева?
ХОД УРОКОВ
I. Диалог на уроке
Актуализация знаний обучающихся о строении атома и Периодическом законе Д. И. Менделеева, классификации неорганических веществ и их свойствах в свете теории электролитической диссоциации и окислительновосстановительных реакциях, о генетической связи между классами соединений.
Изучение нового материала происходит с опорой на содержание § 1 учебника.
Вопросы и задания
1) Вспомните, какая взаимосвязь существует между строением атома химического элемента и его положением в Периодической системе Д. И. Менделеева (заряд ядра атома, число протонов, нейтронов, общее число электронов, число заполняемых энергетических уровней, число внешних электронов у элементов главных подгрупп).
2) Как изменяются свойства атомов, простых веществ и соединений, образованных химическими элементами, в пределах главных подгрупп и периодов Периодической системы Д. И. Менделеева? Мотивируйте свой ответ.
3) Дайте характеристику химического элемента лития в соответствии с планом.
Записи в тетради
План характеристики химического элемента
- Положение в Периодической системе химических элементов Д. И. Менделеева и строение его атомов (заряд ядра атома, массовое число протонов, нейтронов, общее число электронов в нейтральном атоме, строение электронной оболочки, высшая степень окисления).
- Характер простого вещества (металл, неметалл).
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
- Состав высшего оксида, его характер (осно́вный, кислотный, амфотерный).
- Состав высшего гидроксида, его характер (основание, кислородсодержащая кислота, амфотерный гидроксид).
Состав летучего водородного соединения (для неметаллов).
4) Какой тип химической связи существует в соединении натрия с водородом? Какими физическими свойствами будет обладать это соединение?
5) Составьте генетический ряд натрия (металла).
6) Дайте характеристику химического элемента фосфора в соответствии с планом.
7) Составьте генетический ряд фосфора (неметалла).
I. Систематизация пройденного материала
Выполнение заданий № 1(б), 2, 3 после § 1 учебника с последующей само или взаимопровер кой и, в случае необходимости, коррекцией допущенных ошибок.
II. Подведение итогов
Обучающиеся устно отвечают на проблемный вопрос урока.
Домашнее задание: § 1, выполнить задания № 4—7 после § 1; № 8 на с. 17 в рабочей тетради.
Характеристика элемента по его положению в периодической системе
План урока
- План характеристики химического элемента
- Характеристика металла и его соединений
- Характеристика неметалла и его соединений
Цели урока
- рассмотреть план характеристики химического элемента на основании его положения в ПС
- научиться описывать свойства химического элемента и его соединений на основе плана характеристики
- расширить и углубить знания о химических элементах, периодической системе и строении атомов
Элементы и атомы,
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук.
Г. Санников
Можно предположить, что химические элементы в периодической системе — это герои, и им, как и любым героям, можно давать определённые характеристики. За основу характеристики химических элементов мы будем брать Периодическую систему химических элементов (ПСХЭ) Д. И. Менделеева.
План характеристики элементов по ПСХЭ
- Порядковый номер элемента, относительная атомная масса (Ar), химический знак.
- Строение атома (заряд ядра (Z), количество протонов, нейтронов, электронов).
- Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).
- Распределение электронов по энергетическим уровням, электронная формула атома.
- Характер элемента (металл, неметалл).
- Характеристика химической связи, физические свойства.
- Сравнение со свойствами соседних элементов (по группе, по периоду).
- Формула высшего оксида, название, его характер.
- Формула гидроксида (основания или кислоты), название, его характер.
- Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
Характеристика металла и его соединений
Охарактеризуем металл калий К

1. Порядковый номер калия, т. е. клетка, в которой он стоит, — 19, относительная атомная масса Ar — 39. Химический символ — K.
2. Значит, заряд его ядра равен Z = +19 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 19 электронов (19 e–), и 19 протонов (19 p+), а число нейтронов определяется по формуле n = Ar – Z, т. е. 39 – 19 = 20, значит, в атоме 20 нейтронов
(12 n0).
3. Калий расположен в ПС в I группе, главной (A) подгруппе, 4 большом периоде, относится к элементам s-семейства.
4. Так как калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором — 8, на третьем — 8, на четвёртом,
значит, — 1 электрон.
Электронная формула атома калия: 1s22s22p63s23p64s1.
5. Т. к. у калия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
Рис. 1. Металл калий
6. Раз калий — металл, то для него характерна металлическая химическая связь и металлическая кристаллическая решётка. Поэтому, как и для любого металла, для него характерны такие физические свойства, как металлический блеск, пластичность, тепло- и электропроводность.
7. Сравнение свойств элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у
рубидия, т. к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра, их становится легче отдавать. Сравнение свойств элемента калия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у кальция, т. к. в периодах слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее отдавать, чем присоединить.
8. Калий — металл I A группы, его высшая валентность I (определяется номером группы). Металлу соответствует оксид калия K2O, значит, это основный оксид, он проявляет все свойства, характерные для этих оксидов: реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
К2О + 2HCl → 2KCl + H2O
K2O + SO3 → K2SO4
K2O + H2O → 2KOH
9. Гидроксид калия (едкое кали) — это KOH, он является щёлочью — растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями. Это подтверждается уравнениями реакции:
КОH + HNO3 → KNO3 + H2O
2KOH + CO2 → K2CO3 + H2O
2KOH + CaCl2 → 2KCl + Ca(OH)2
10. Если калий — металл, то он не образует летучих водородных соединений.
Характеристика неметалла и его соединений
Охарактеризуем неметалл сера S

1. Сера находится в клетке номер 16, т. е. её порядковый номер 16, относительная атомная масса Ar — 32.
Химический символ — S.
2. Значит, заряд ядра её атома будет Z = +16, а число протонов, как и число электронов равно 16: (р0 = 16, e– = 16). Число нейтронов будет равно 16, т. к. если мы от относительной атомной массы отнимем число протонов, то будет 16 (n0 = 32 – 16 = 16).
3. Сера расположена в ПС в VI группе, главной (A) подгруппе, 3 малом периоде, относится к элементам p-семейства.
4. Сера находится в третьем периоде, значит, у неё три энергетических уровня: на первом 2 электрона, на втором — 8, а на третьем — 6.
Электронная формула атома серы: 1s22s22p63s23p4.
5. Сера — это неметалл, значит, она может быть как окислителем, так и восстановителем. Как окислитель она может присоединить 2 электрона до завершения внешнего уровня, получая при этом степень окисления -2
(S0 + 2e- → S-2), а как восстановитель она может отдать 4 или 6 электронов и получить степень окисления +4 или +6 (S0 – 4e- → S+4, S0 – 6e- → S+6).
6. Сера — неметалл. Для неё характерно явление
аллотропии
, т. е. она может образовывать несколько простых веществ, отличающихся своими свойствами.
Рис. 2. Аллотропные модификации серы: а — ромбическая; б — моноклинная; в — пластическая
Наиболее устойчивая модификация серы — ромбическая сера S8, это хрупкое вещество жёлтого цвета. Моноклинная сера, в которой атомы соединены в циклы в виде «короны», представляет собой твёрдое вещество, состоящее из тёмно-жёлтых игл, устойчивое при температуре более 96 °C, а при обычной температуре превращающееся в ромбическую серу. Пластическая сера — длинные полимерные цепи пластической коричневой массы, нерастворимой в воде.
7. Сравнение свойств элемента серы со свойствами её соседей по группе: неметаллические свойства серы выражены сильнее, чем у селена, но слабее, чем у кислорода, так как радиус у кислорода меньше, чем у серы. По сравнению с соседями по периоду свойства серы выражены сильнее, чем у фосфора, но слабее, чем у хлора.
8. Сера имеет высшую валентность 6 и низшую валентность 2 (определяется по формуле: 8-N, где N — номер группы). Высший оксид серы (VI) — SO3. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты. Это подтверждается уравнениями реакции:
SO3 + BaO → BaSO4
SО3 + 2NaOH → Na2SO4 + H2O
SO3 + H2O → H2SO4
9. Высший гидроксид серы — это серная кислота H2SO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями. Это подтверждается уравнениями реакции:
H2SО4 + Mg → MgSO4 + H2
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
H2SO4 + CaO → CaSO4 + H2O
H2SO4 + Na2SiO3 → H2SiO3 + Na2SO4
10. Сера — неметалл, поэтому имеет летучее водородное соединение H2S — сероводород.
Пример 1
Охарактеризуем химический элемент кальций по следующим характеристикам:
|
№ |
Характеристика |
Элемент |
|
1 |
Химический знак |
Ca |
|
2 |
Название элемента |
кальций |
|
3 |
Порядковый номер |
20 |
|
4 |
Номер группы, подгруппа (главная, побочная) |
II, главная |
|
5 |
Металл, неметалл, амфотерный элемент |
металл |
|
6 |
Номер периода (большой, малый) |
4 большой |
|
7 |
Относительная атомная масса (Аr) |
Аr = 40 |
|
8 |
Формула высшего оксида |
CaO |
|
9 |
Формула высшего гидроксида |
CaOH2 |
|
10 |
Формула летучего водородного соединения |
– |
|
11 |
Строение атома: |
|
|
а) заряд ядра |
+20 |
|
|
б) количество электронов и протонов |
20 |
|
|
в) количество нейтронов (n = Ar – Z) |
n=40-20=20 |
|
|
г) количество энергетических уровней |
4 |
|
|
д) количество электронов на последнем уровне |
2 |
|
|
е) распределение электронов по энергетическим уровням и подуровням |
1s22s22p63s23p64s2 |
|
|
ж) s-, p-, d-, f-элемент |
s-элемент |
Упражнение
Охарактеризуйте химический элемент кремний по тем же характеристикам, что и в примере.
Контрольные вопросы
- Перечислите пункты плана характеристики химического элемента.
- Каким элементам характерно наличие летучих водородных соединений?
Ответы
|
№ |
Характеристика |
Элемент |
|
1 |
Химический знак |
Si |
|
2 |
Название элемента |
кремний |
|
3 |
Порядковый номер |
14 |
|
4 |
Номер группы, подгруппа (главная, побочная) |
IV, главная |
|
5 |
Металл, неметалл, амфотерный элемент |
неметалл |
|
6 |
Номер периода (большой, малый) |
3 малый |
|
7 |
Относительная атомная масса (Аr) |
Аr = 28 |
|
8 |
Формула высшего оксида |
SiO2 |
|
9 |
Формула высшего гидроксида |
H2SiO3 |
|
10 |
Формула летучего водородного соединения |
SiH4 |
|
11 |
Строение атома: |
|
|
а) заряд ядра |
+14 |
|
|
б) количество электронов и протонов |
14 |
|
|
в) количество нейтронов (n = Ar – Z) |
n=28-14=14 |
|
|
г) количество энергетических уровней |
3 |
|
|
д) количество электронов на последнем уровне |
4 |
|
|
е) распределение электронов по энергетическим уровням и подуровням |
1s22s22p63s23p2 |
|
|
ж) s-, p-, d-, f-элемент |
p-элемент |
Зная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану.
I. Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д.И. Менделеева:
- порядковый номер;
- номер периода;
- номер группы;
- подгруппа (главная или побочная).
III. Строение атома химического элемента:
- заряд ядра атома;
- относительная атомная масса химического элемента;
- число протонов;
- число электронов;
- число нейтронов;
- число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
V. Тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой.
VIII. Максимальная и минимальная степень окисления атома.
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строению атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Р.
II. Охарактеризуем положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16). Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная формула атома фосфора: 15P 1s2 2s2 2p6 3s2 3p3.
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление), на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление).
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
V. Определяем тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P2O5, проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H3PO4, проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
P2O5 + 3 Na2O = 2Na3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
VIII. Определяем максимальную и минимальную степень окисления атома фосфора.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
Урок по теме: Характеристика химического элемента и
его соединений на основе положения в Периодической системе и строения атома.
Цель урока:
Расширить и углубить полученные знания по строению
атомов химических элементов из курса химии 8-гокласса. Научить составлять план характеристики
химического элемента, исходя из его положения в Периодической системе и строения
атома.
Оборудование: ПСХЭ, презентация
Ход
урока:
1. Организационный момент.
2.
Изучение нового материала.
Что такое химия как наука?
Химия – это
наука о веществах, их свойствах, превращениях в-в и явлениях, сопровождающих
эти превращения.
В прошлом учебном году вы изучали
общую химию, познакомились с основными хим. законами, классами неорг.
соединений, типами хим. связей… В этом уч. году, используя знания, полученные в
прошлом, вы будете изучать неорганическую химию – это наука о хим. эл-тах и их
соединениях (кроме соединений углерода), изучающая св-ва и превращения неорг
в-в
Неорг в-ва – это хим
соединения, образуемые всеми хим эл-тами ( кроме соединений углерода,
относящихся к органическим в-вам), СО, СО2, Н2СО3
и ее соли.
Неорг в-ва образуются на Земле и в
Космосе под воздействием природных физико-химических факторов. Известно ≈ 300
000 неорг в-в. Они образуют практически всю литосферу, атмосферу и гидросферу
Земли. В их состав могут входить атомы всех хим эл-тов, известных в настоящее
время в различных сочетаниях и количественных отношениях. Кроме того, огромное
кол-во неорг в-в получают в научных лабораториях и на хим предприятиях
искусственно.
Задачи неорг химии:
Установление строения хим эл-тов,
состава и св-вобразуемых ими соединений,
Установление строения молекул сложных
в-в;
Разработка и научное обоснование
способов создания новых материалов с нужными св-вами.
Основными методами неорг химии являются
синтез и анализ.
Основным теоретическим фундаментом неорг
химии служат:
Теория строения атомов;
Периодический Закон;
ПСХЭ.
Повторение структуры ПСХЭ
Закономерности изменения
свойств химических элементов и их соединений по периодам и группам
Химические
свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Памятка !!! Не надо учить наизусть химические свойства
каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по
химии находится в Периодической
системе элементов.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и
в периодах.
1. Изменения свойств химических
элементов и их соединений в группах:
В группах все элементы имеют сходное
электронное строение. Различий в наполнении внешнего энергетического уровня
электронами нет.
Меняется
размер атома – сверху вниз в
группе радиусы атомов увеличиваются!
Вопрос. Что это означает? Это означает, что:
1) внешние электроны все слабее
притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические
свойства.
Правило.
В группах сверху вниз
возрастают металлические свойства элементов
усиливаются основные
свойства их соединений
Изменения
химических свойств элементов и их соединений в периодах:
1) Слева направо в
периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое
при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
Правило.
В периодах слева направо возрастают неметаллические
свойства элементов, электроотрицательность;
усиливаются кислотные свойства их
соединений.
Исходя из этих соображений получается, что
звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже
кислород (O) проявляет положительную степень окисления.
OF2–
бесцветный ядовитый газ с неприятным запахом.
Итак,
подведем итог:
С
увеличением заряда ядра атомов наблюдается постепенное изменение свойств
от металлических к типично неметаллическим, что связано с увеличением числа
электронов на внешнем энергетическом уровне.
Есть еще элементы, которые образуют так
называемые амфотерные соединения.
Они проявляют как металлические, так и неметаллические свойства.
К ним
относятся:
Zn, Cr, Al, Sn,
Pb, Mn, Fe, Be
Рассмотрим
характеристику химического элемента №11-Na
На внешнем энергетическом уровне атома
натрия 1 электрон, следовательно, натрий образует простое вещество, обладающее
металлическими свойствами и способностью только отдавать электроны, проявляя
восстановительные свойства: Na0-1е– = Na+1
(окисление, Na0 – восстановитель).
Металлические и восстановительные свойства
натрия выражены сильнее, чем у лития, но слабее, чем у калия. Это связано с
увеличением радиусов атомов и ослаблением связи валентных электронов с ядром при
переходе от Li к Na и K.
Металлические и восстановительные свойства
натрия выражены сильнее, чем у магния.
Объясните почему?
Минимальная степень окисления натрия ( как
у всех металлов) равна 0, а максимальная +1, что соответствует номеру группы.
С
кислородом натрий образует пероксид Na+1 – O-1 – О-1
– Na+1, Na2O2
Оксид натрия может быть получен при
нагревании смеси пероксида с избытком металла в отсутствии кислорода Na2O2+2Na=2Na2O
Натрий бурно с выделением большого
количества теплоты взаимодействует с водой, образуя щелочь и восстанавливая
воду до водорода 2Na+2H2O=2NaOH+H2↑
III.
Закрепление – выполнение задания на стр. 23 – 5, 2, индивидуальная работа по
карточкам
IV.Д/з
§5, §4 повторить, составить план характеристики химического элемента с атомным
номером 17.
План характеристики элемента по положению в Периодической системе д.И. Менделеева
-
Укажите
название элемента, его обозначение.
Определите порядковый номер элемента,
номер периода, группу, подгруппу.
Укажите физический смысл параметров
системы – порядкового номера, номера
периода, номера группы. Обоснуйте
положение в подгруппе. -
Укажите
количество электронов, протонов и
нейтронов в атоме элемента, заряд ядра,
массовое число. -
Составьте
полную электронную формулу элемента,
определите электронное семейство,
отнесите простое вещество к классу
металлов или неметаллов. -
Изобразите
графически электронную структуру
элемента (или двух последних уровней). -
Укажите
число и тип валентных электронов. -
Графически
изобразите все возможные валентные
состояния. -
Перечислите
все возможные валентности и степени
окисления. -
Напишите
формулы оксидов и гидроксидов для всех
валентных состояний. Укажите их
химический характер (подтвердите ответ
уравнениями соответствующих реакций). -
Приведите
формулу водородного соединения. -
Назовите
область применения данного элемента
Решение.
В ПСЭ элементу с порядковым номером 21
соответствует скандий

1.
Элемент находится в IV
периоде. Номер периода означает число
энергетических уровней в атоме этого
элемента, у него их 4. Скандий расположен
в 3-й группе – на внешнем уровне 3
электрона; в побочной подгруппе.
Следовательно, его валентные электроны
находятся на 4s-
и 3d-
подуровнях. Является d-элементом.
Порядковый номер численно совпадает с
зарядом ядра атома.
2.
Заряд ядра атома скандия +21.
Число
протонов и электронов – по 21.
Число
нейтронов А-Z=
45-21=24.
Общий
состав атома:
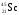

3.
Полная электронная формула скандия:

2s2
2p6
3s2
3p6
3d1
4s2
или в
сокращенной форме: [Sc]
3d1
4s2
Электронное
семейство: d-элемент,
так как в стадии заполнения d-орбитали.
Электронное строение атома заканчивается
s-
электронами, поэтому скандий проявляет
металлические свойства; простое вещество
– металл.
4.
Электронно-графическая конфигурация

5.
Он имеет в возбужденном состоянии три
валентных электрона (два на 4s-
и один на 3d-
подуровне)
6.
Возможные валентные состояния,
обусловленные числом неспаренных
электронов:
–
в основном состоянии:
s
p
d
|
n |
f
|
n |
–
в возбужденном состоянии:
s
p
d
|
n |
f
|
n |
спинвалентность
равна 3 (один неспаренный d-электрон
и два неспаренных s-электрона)
7.
Возможные валентности в данном случае
определяются числом неспаренных
электронов: 1, 2, 3 (или I, II, III). Возможные
степени окисления (отражают число
смещенных электронов) +1, +2, +3. Наиболее
характерные и устойчивая валентность
III, степени окисления +3. Наличие лишь
одного электрона в d-
состоянии обуславливает малую устойчивость
d1s2–
конфигурации. Скандий и его аналоги, в
отличие от других d-элементов
проявляет постоянную степень окисления
+3, это высшая степень окисления и
соответствует номеру группы.
8.
Формулы оксидов и их химический характер:
форма высшего оксида – Sc2O3
(амфотерный).
Формулы
гидроксидов: Sc(OH)3
– амфотерный.
Уравнения
реакций, подтверждающих амфотерный
характер оксидов и гидроксидов:
Sc(OH)3
+3 КОН = К3[Sc(OH)6]
(гексагидроксоскандиат
калия)
2
Sc(OH)3
+ 3 Н2SO4
= 6 Н2О
+ Sc2(SO4)3
(сульфат скандия)
9.
Соединения с водородом не образует, так
как находится в побочной подгруппе и
является d-элементом.
10.
Соединения скандия применяются в
полупроводниковой технике.
Пример
6. У какого
из двух элементов марганца или брома
сильнее выражены металлические свойства?
Решение.
Данные
элементы находятся в четвертом периоде.
Записываем их электронные формулы:
25
Mg
1s22s22p63s23p64s23d5
35
Br
1s22s22p63s23p64s23d104p5
Марганец
– d-элемент,
то есть элемент побочной подгруппы, а
бром – р-элемент главной подгруппы этой
же группы. На внешнем электронном уровне
у атома марганца только два электрона,
а у атома брома – семь. Радиус атома
марганца меньше радиуса атома брома
при одинаковом числе электронных
оболочек.
Общей
закономерностью для всех групп, содержащих
р- и d-элементы
является преобладание металлических
свойств у d-элементов.
Таким образом, у марганца металлические
свойства выражены сильнее, чем у брома.
Пример
7. Какой из
двух гидроксидов является более сильным
основанием а) Sr(OH)2
или
Ba(OH)2;
б) Ca(OH)2
или Fe(OH)2
в) Sr(OH)2
или
Cd(OH)2?
Решение.
Чем больше
заряд и чем меньше радиус иона, тем
сильнее удерживает он другие ионы. В
этом случае гидроксид будет более
слабым, так как у него меньше способность
к диссоциации.
а)
Для ионов одинакового заряда со сходным
электронным строением радиус, тем
больше, чем больше электронных слоев
содержит ион. Для элементов главных
подгрупп (s-
и р-) радиус у ионов увеличивается с
увеличением порядкового номера элемента.
Следовательно, Ba(OH)2
является
более сильным
основанием, чем Sr(OH)2.
б)
В пределах одного периода радиусы ионов
уменьшаются при переходе от s-
и р-элементов к d-элементам.
При этом число электронных слоев не
меняется, а заряд ядра увеличивается.
Поэтому основание Ca(OH)2
более сильное,
чем Fe(OH)2.
в)
Если элементы находятся в одном периоде,
в одной группе, но в разных подгруппах,
то радиус атома элемента главной
подгруппы больше радиуса атома элемента
побочной подгруппы. Отсюда, основание
Sr(OH)2
сильнее,
чем Cd(OH)2.
Пример
8. Каким типом
гибридизации АО азота описывается
образование иона

молекулыNH3?
какова пространственная структура этих
частиц?
Решение.
Как в ионе
аммония, так и в молекуле аммиака
валентный электронный слой атома азота
содержит четыре электронных пары.
Поэтому в обоих случаях электронные
облака атома азота будут максимально
удалены друг от друга при sр3-гибритизации,
когда их оси направлены к вершинам
тетраэдра. При этом в ионе

водорода, так что этот ион имеет
тетраэдрическую конфигурацию с атомом
азота в центре тетраэдра.
При
образовании молекулы аммиака атомы
водорода занимают только три вершины
тетраэдра, а к четвертой вершине
направлено электронное облако неподеленной
электронной пары атома азота. Образовавшаяся
фигура при этом – тригональная пирамида
с атомом азота в ее вершине и атомами
водорода в вершинах основания.
Пример
9. Объясните
с позиций метода МО возможность
существования молекулярного иона

Решение.
В молекулярном
ионе

схема образования этого иона с учетом
принципа Паули показана на рис.21.
Рис.
21. Энергетическая схема образования
иона

На
связывающей орбитали размещены два
электрона, а на разрыхляющей – один.
Следовательно, кратность связи в этом
ионе равна (2-1)/2 = 0,5, и он должен быть
энергетически устойчивым.
Напротив,
молекула Не2
должна
быть энергетически неустойчивой,
поскольку из четырех электронов, которые
должны разместиться на МО, два займут
связывающую МО, а два – разрыхляющую.
Следовательно, образование молекулы
Не2
не будет
сопровождаться выделением энергии.
Кратность связи в этом случае равна
нулю – молекула не образуется.
Пример
10. Какая из
молекул – В2
или С2
характеризуется более высокой энергией
диссоциации на атомы? Сопоставьте
магнитные свойства этих молекул.
Решение.
Составим
энергетические схемы образования данных
молекул (рис. 22).
Рис.
22. Энергетическая схема образования
молекул В2
и С2.
Как
видно, в молекуле В2
разность
между числом связывающих и числом
разрыхляющих электронов равна двум, а
в молекуле С2
– четырем;
это отвечает кратности связи соответственно
1 и 2. Следовательно, молекула С2
.
характеризующаяся более высокой
кратностью связи между атомами, должна
быть более прочной. Этот вывод соответствует
экспериментально установленным значениям
энергии диссоциации на атомы молекул
В2
(276 кДж/моль)
и С2
(605 кДж/моль).
В
молекуле В2
два электрона расположены, согласно
правилу Гунда, на двух πсв
2р-орбиталях.
Наличие двух неспаренных электронов
сообщает этой молекуле парамагнитные
свойства. В молекуле С2
все электроны спарены, следовательно,
эта молекула диамагнитна.
Пример
11. Как
располагаются электроны по МО в молекуле
CN
и в молекулярном
ионе CN
–,
образующемся
по схеме: C–
+ N
→ CN
–.
В какой из этих частиц длина связи
наименьшая?
Решение.
Составив
энергетические схемы образования
рассматриваемых частиц (рис. 23), заключаем,
что кратность связи в CN
и CN–
соответственно
равна 2,5 и 3. Наименьшей длиной связи
характеризуется ион CN
–, в котором
кратность связи между атомами наибольшая.
Рис.
23. Энергетические схемы
образования
молекулы CN
и молекулярного
иона CN
–.
Пример
12. Какой тип
кристаллической решетки характерен
для твердого простого вещества,
образованного элементом с порядковым
номером 22?
Решение.
По ПСЭ Д.И.
Менделеева определяем элемент с данным
порядковым номером и составляем его
электронную формулу.
Титан

Титан
является d-элементом,
на внешнем уровне содержит два электрона.
Является типичным металлом. В кристалле
титана между атомами, имеющими на внешнем
валентном уровне два электрона, возникает
металлическая связь. Энергия кристаллической
решетки ниже энергии решетки ковалентных
кристаллов, но значительно выше, чем у
молекулярных кристаллов. Кристалл
титана обладает высокой электро- и
теплопроводностью, способен деформироваться
без разрушения, обладает характерным
металлическим блеском, имеет высокую
механическую прочность и температуру
плавления.
Пример
13. Чем
отличается структура кристалла CaF2
от структуры
кристаллов Са
и F2?
Какие виды связей существуют в кристаллах
этих веществ? Как это влияет, а их
свойства?
Решение.

Са –
типичный металл, s-элемент,
имеет на внешнем энергетическом уровне
два валентных электрона. Образует
металлическую кристаллическую структуру
с выраженным металлическим типом связи.
Обладает металлическим блеском, электро-
и теплопроводностью, пластичен.

F2
– типичный неметалл, р-элемент, на
внешнем энергетическом уровне имеет
только один неспаренный электрон, что
недостаточно для образования прочных
ковалентных кристаллов. Атомы фтора
связаны ковалентной связью в двухатомные
молекулы, которые образуют молекулярный
кристалл за счет сил межмолекулярного
взаимодействия. Он непрочен, легко
возгоняется, обладает низкой температурой
плавления, изолятор.
При
образовании кристалла CaF2
между атомами
Са
и F
образуется ионная связь, поскольку
разница в электроотрицательности между
ними достаточно велика ЭО=4
(табл. 14). Это приводит к образованию
ионного кристалла. Вещество растворимо
в полярных растворителях. При обычных
температурах является изолятором, при
повышении температуры усиливаются
точечные дефекты кристалла (за счет
теплового движения ионы покидают узлы
кристаллической решетки и переходят в
междоузлия или на поверхность кристалла).
Когда кристалл попадает в электрическое
поле, наблюдается направленное перемещение
ионов к вакансии, образованные ушедшим
ионом. Тем самым обеспечивается ионная
проводимость кристалла CaF2.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #




























