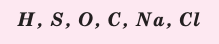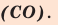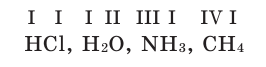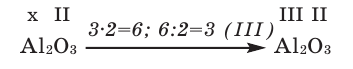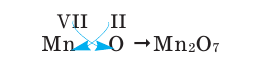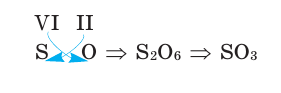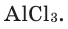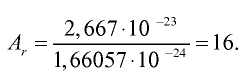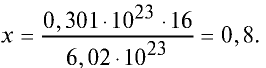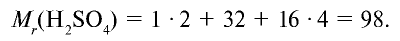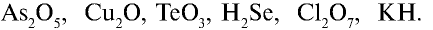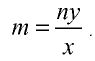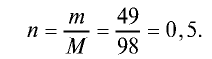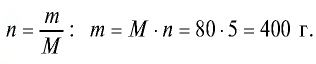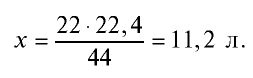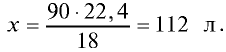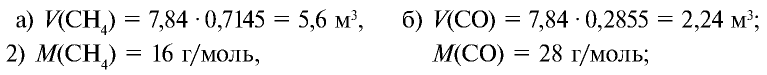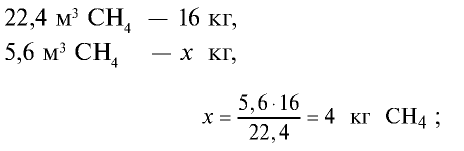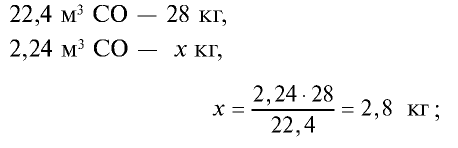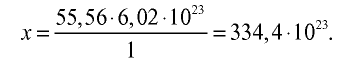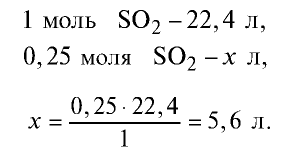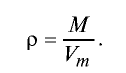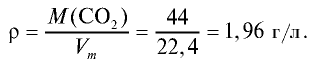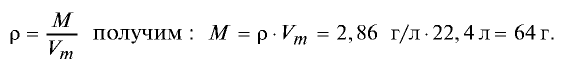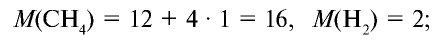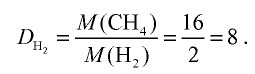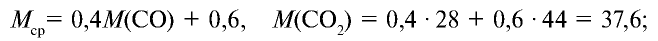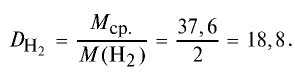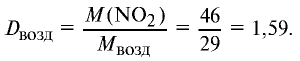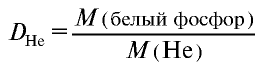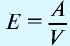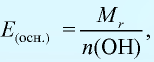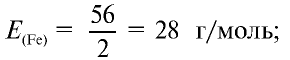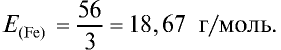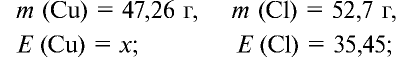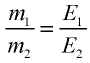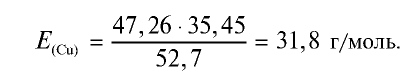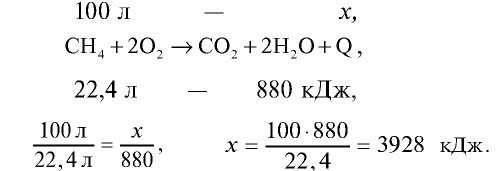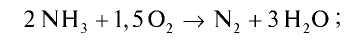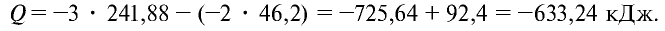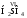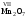Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула – это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является “валентность“. Валентность – это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций – 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую – 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Хочешь сдать ЕГЭ по химии и биологии на 90+? WhatsApp репетитора Богуновой В.Г. +7(903)186-74-55
Сайт репетитора Богуновой В.Г.
Репетитор Богунова В.Г. ВК
Ютуб-канал репетитора Богуновой В.Г.
Полный каталог статей – на авторском сайте в разделе “Статьи репетитора Богуновой В.Г.”
Знаете, в чем ошибка большинства преподавателей химии и репетиторов? Желая продемонстрировать степень собственного образования и никчемность знаний абитуриента, они, практически с первых занятий, начинают решать трудные задачи “уровня Белавина” и задания олимпиад. Кстати, профильные лицеи при ведущих медицинских ВУЗах – не исключение (у каждого ученика есть репетиторы). Как результат, у ребенка формируется страх перед сложным и объемным учебным материалом, который необходимо освоить. Нервная система включает защитный механизм – блокирование негативно воспринимаемой информации. И все … у абитуриента развивается стойкое отвращение к предмету! Теперь, чтобы инициировать ребенка на изучение химии, необходим опытный Преподаватель и много-много времени для работы. И нет никакой гарантии, что ученик раскроется и позволит Учителю выстроить у себя в голове стройную систему предмета. Поэтому, в преподавании, как и во врачевании, важны принципы: “Не навреди!”, “Пироги должен печь пирожник, а не сапожник”! Это я к тому, что репетиторов в последнее время развелось, как тараканов, очень много, а преподавателей среди них – днем с огнем не найдешь!
Не будем спотыкаться о чужие ошибки (своих не допустить бы, тьфу-тьфу), начнем изучение химии с нуля и сделаем первый шаг – составление, название и понимание формул веществ.
Конспект репетитора
Химическая формула – это запись состава вещества с помощью символов элементов и подстрочных индексов.
Индекс (подстрочный) обозначает число атомов данного элемента в молекуле вещества.
Коэффициент – число, стоящее перед химической формулой, обозначает число молекул вещества.
Например, запись 7H2SO4 означает: семь молекул серной кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Познакомимся с алгоритмом составления формул веществ на примере бинарных соединений.
Бинарные соединения – вещества, образованные двумя химическими элементами (H2O, Al2S3, PCl5, NH3 и др.). Поучимся составлять формулы бинарных соединений по конкретному заданию.
Задание
Написать одну из формул и назвать соединение, молекула которого содержит атомы серы и фосфора
Алгоритм составления формул:
1. Выписать символы химических элементов в порядке увеличения их электроотрицательности.
Электроотрицательность (ЭО на схеме) – способность атома притягивать к себе электроны (и свои, и чужие).
2. Определить валентность элементов
Валентность – способность атомов химических элементов образовывать определенное число химических связей.
Высшая валентность (в) равна номеру группы. У первого элемента, стоящего левее, валентность либо определена, либо высшая. В нашем случае валентность фосфора не озвучена, поэтому берем высшую.
Низшая валентность (н) равна “восемь минус номер группы” (определяется только для элементов IVA-VIIA групп). У второго элемента, стоящего правее, валентность всегда низшая. В нашем случае сера – элемент VIA-группы, ее низшая валентность равна 8-6=2.
Запомнить: у кислорода валентность всегда 2, у фтора – всегда 1!
3. Определить число атомов каждого элемента (нижние индексы).
Для этого находим наименьшее общее кратное значений валентностей и делим его на каждое из них.
Для справки
Наименьшее общее кратное двух целых чисел m и n есть наименьшее натуральное число, которое делится на m и n без остатка.
4. Назвать вещество
Название бинарного соединения состоит из двух слов.
Первое слово – название второго элемента, стоящего правее (с низшей валентностью) с добавлением суффикса -ИД. В нашем случае – сульфид. Таким образом, суффикс -ИД указывает на то, что этот элемент имеет низшую валентность “восемь минус номер группы”.
Второе слово – название первого элемента, стоящего левее (с более низкой электроотрицательностью) – в родительном падеже. В нашем случае – фосфора (кого? чего?).
Если первый элемент может иметь несколько значений валентности, то в конце названия указывается конкретное значение валентности в скобках римскими цифрами. В нашем случае фосфор может иметь валентности 3 и 5, поэтому название вещества – сульфид фосфора (V).
Вы хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками, многие из которых уже давно закончили ВУЗы и, работая врачами, спасают наши с вами жизни.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Приходите ко мне на занятия, я помогу вам фундаментально изучить химию и биологию, научу решать любые задачи, даже самые сложные.
Репетитор по химии и биологии кбн В.Богунова
CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
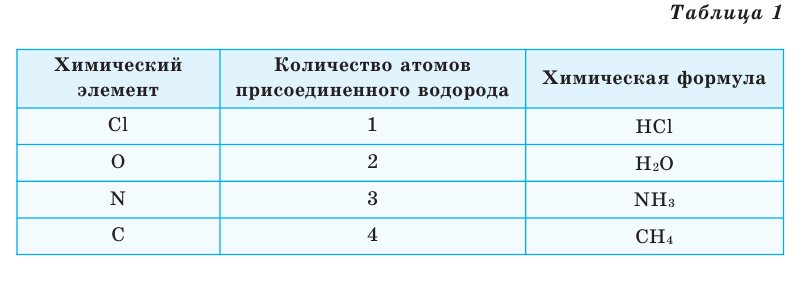
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 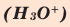
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
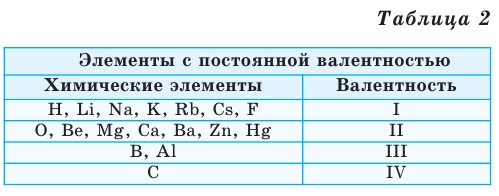
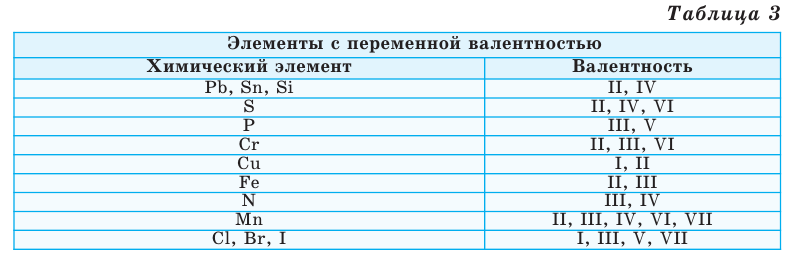
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 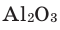
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
Химическая формула
Заполните таблицу. Как произносится химическая формула вещества?
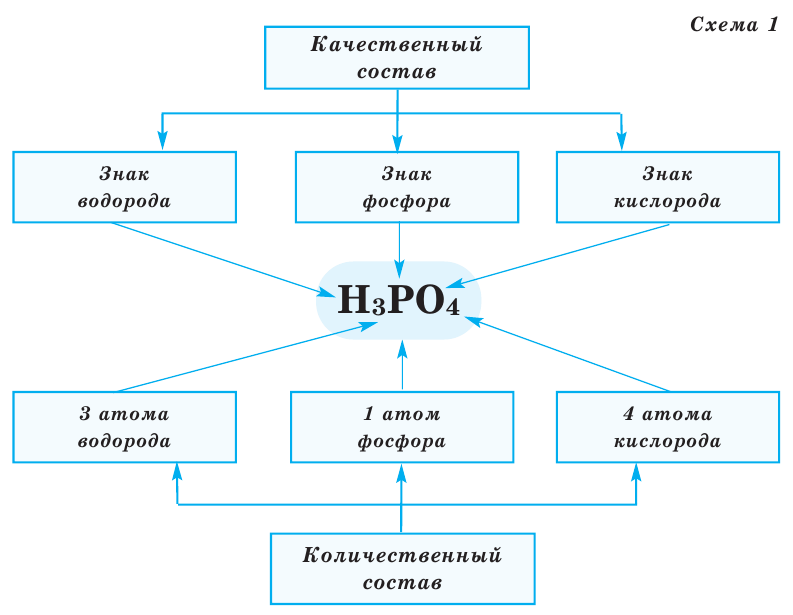
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
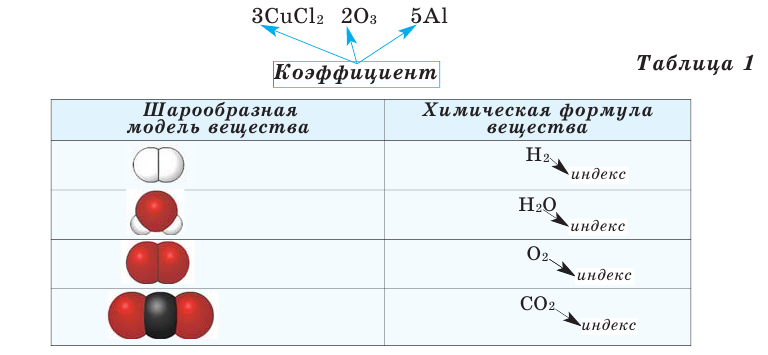
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
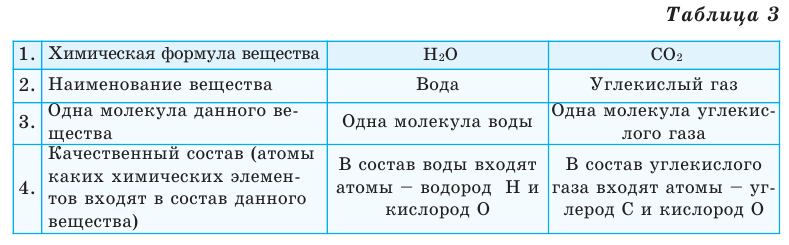
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза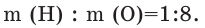
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 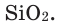
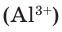

Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium (“образующий воду”).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•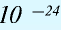

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 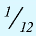
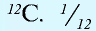
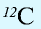

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02•
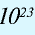
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 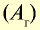 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ: 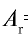
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 •
Тогда, если 6,02 • 

Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 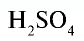
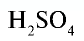
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (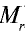
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (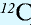
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 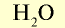 |
18 | 1 | 6,02• |
| Углекислый газ | 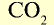 |
44 | 1 | 6,02• |
| Серная кислота | 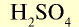 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 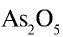
2) 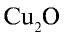
3) 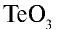
4) 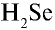
5) 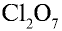
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 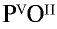
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – 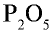
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 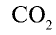
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 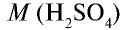
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество | 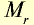 |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
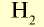 |
2 | 2 | 22,4 | 6,02• |
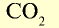 |
44 | 44 | 22,4 | 6,02• |
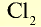 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 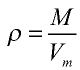
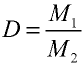
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 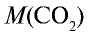
2) вычислим объем 22 г 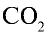
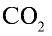
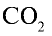
Ответ: 22 г 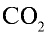
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
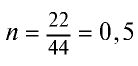
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(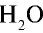
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 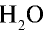
90г 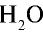
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{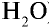
2) вычислим количество вещества в 1000 г воды:
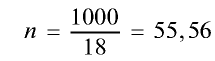
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02•
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
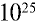
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 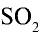
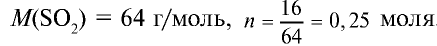
2) вычислим, какой объем займут 16 г (или 0,25 моля) 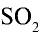
Ответ: 16 г 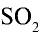
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(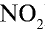
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = 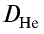
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 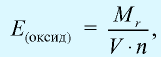
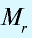
Эквивалентность оснований выражается формулой:
где 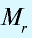
Эквивалентность кислот выражается формулой: 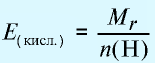
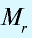
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 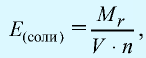
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 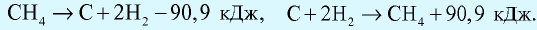
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



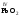
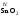
V,
VI,
VII
.являются
кислотными:
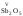


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #