Рассмотрим порядок составления химической реакции на примере взаимодействия сложных веществ гидроксида натрия
NaOH
и серной кислоты
H2SO4
, протекающего с образованием сульфата натрия
Na2SO4
и воды
H2O
.
1. В левой части уравнения запишем формулы веществ, вступающих в реакцию (реагентов):
левая часть
реагенты
2. В правой части уравнения запишем формулы веществ, которые образуются в результате реакции (продуктов реакции):
правая часть
продукты реакции
3. Уравняем число атомов химических элементов с помощью коэффициентов:
Пример:
составь уравнение реакции горения магния в кислороде.
реагенты
продукт реакции
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
![]()
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
![]()
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
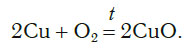
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
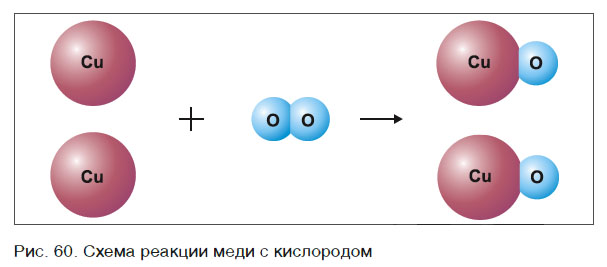
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
![]()
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
![]()
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
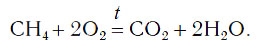
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
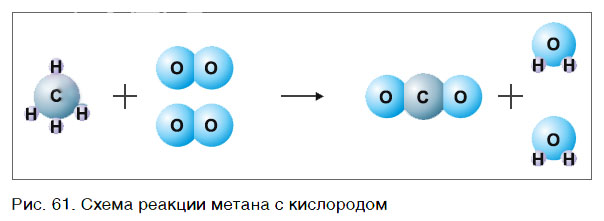
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Уравнения химических реакций


4.3
Средняя оценка: 4.3
Всего получено оценок: 1228.
4.3
Средняя оценка: 4.3
Всего получено оценок: 1228.
Запись химического взаимодействия, отражающая количественную и качественную информацию о реакции, называют уравнением химических реакций. Записывается реакция химическими и математическими символами.
Основные правила
Химические реакции предполагают превращение одних веществ (реагентов) в другие (продукты реакции). Это происходит благодаря взаимодействию внешних электронных оболочек веществ. В результате из начальных соединений образуются новые.
Чтобы выразить ход химической реакции графически, используются определённые правила составления и написания химических уравнений.
В левой части пишутся изначальные вещества, которые взаимодействуют между собой, т.е. суммируются. При разложении одного вещества записывается его формула. В правой части записываются полученные в ходе химической реакции вещества. Примеры записанных уравнений с условными обозначениями:
- CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4;
- CaCO3 = CaO + CO2↑;
- 2Na2O2 + 2CO2 → 2Na2CO3 + O2↑;
- CH3COONa + H2SO4(конц.) → CH3COOH + NaHSO4;
- 2NaOH + Si + H2O → Na2SiO3 + H2↑.
Коэффициенты перед химическими формулами показывают количество молекул вещества. Единица не ставится, но подразумевается. Например, уравнение Ba + 2H2O → Ba(OH)2 + H2 показывает, что из одной молекулы бария и двух молекул воды получается по одной молекуле гидроксида бария и водорода. Если пересчитать количество водорода, то и справа, и слева получится четыре атома.
Обозначения
Для составления уравнений химических реакций необходимо знать определённые обозначения, показывающие, как протекает реакция. В химических уравнениях используются следующие знаки:
- → – необратимая, прямая реакция (идёт в одну сторону);
- ⇄ или ↔ – реакция обратима (протекает в обе стороны);
- ↑ – выделяется газ;
- ↓ – выпадает осадок;
- hν – освещение;
- t° – температура (может указываться количество градусов);
- Q – тепло;
- Е(тв.) – твёрдое вещество;
- Е(газ) или Е(г) – газообразное вещество;
- Е(конц.) – концентрированное вещество;
- Е(водн.) – водный раствор вещества.

Вместо стрелки (→) может ставиться знак равенства (=), показывающий соблюдение закона сохранения вещества: и слева, и справа количество атомов веществ одинаково. При решении уравнений сначала ставится стрелка. После расчёта коэффициентов и уравнения правой и левой части под стрелкой подводят черту.
Условия реакции (температура, освещение) указываются сверху знака протекания реакции (→,⇄). Также сверху подписываются формулы катализаторов.

Какие бывают уравнения
Химические уравнения классифицируются по разным признакам. Основные способы классификации представлены в таблице.
|
Признак |
Реакции |
Описание |
Пример |
|
По изменению количества реагентов и конечных веществ |
Замещения |
Из простого и сложного вещества образуются новые простые и сложные вещества |
2Na +2H2O → 2NaOH + H2↑ |
|
Соединения |
Несколько веществ образуют новое вещество |
С + О2 = СО2↑ |
|
|
Разложения |
Из одного вещества образуется несколько веществ |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
|
Ионного обмена |
Обмен составными частями (ионами) |
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O |
|
|
По выделению тепла |
Экзотермические |
Выделение тепла |
С + 2H2 = СH4 + Q |
|
Эндотермические |
Поглощение тепла |
N2 + O2 → 2NO – Q |
|
|
По типу энергетического воздействия |
Электрохимические |
Действие электрического тока |
|
|
Фотохимические |
Действие света |
||
|
Термохимические |
Действие высокой температуры |
||
|
По агрегатному состоянию |
Гомогенные |
Одинаковое состояние |
CuCl2 + Na2S → 2NaCl + CuS↓ |
|
Гетерогенные |
Разное состояние |
4Н2О (ж) + 3Fe (т) → Fe3O4 + 4H2↑ |
Существует понятие химического равновесия, присущее только обратимым реакциям. Это состояние, при котором скорости прямой и обратной реакции, а также концентрации веществ равны. Такое состояние характеризуется константой химического равновесия.
При внешнем воздействии температуры, давления, света реакция может смещаться в сторону уменьшения или увеличения концентрации определённого вещества. Зависимость константы равновесия от температуры выражается с помощью уравнений изобары и изохоры. Уравнение изотермы отражает зависимость энергии и константы равновесия. Эти уравнения показывают направление протекания реакции.


Что мы узнали?
В уроке химии 8 класса была рассмотрена тема уравнений химических реакций. Составление и написание уравнений отражает ход химической реакции. Существуют определённые обозначения, показывающие состояние веществ и условия протекания реакции. Выделяют несколько видов химических реакций по разным признакам: по количеству вещества, агрегатному состоянию, поглощению энергии, энергетическому воздействию.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
9/10
-

Ярослав Галкин
7/10
-

Марина Гагарина
10/10
-

Александр Котков
9/10
-

Вера Конзалаева
8/10
-

Наталья-Юлиановна Вахрамеева
9/10
-

Валерия Кириленко
8/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 1228.
А какая ваша оценка?
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
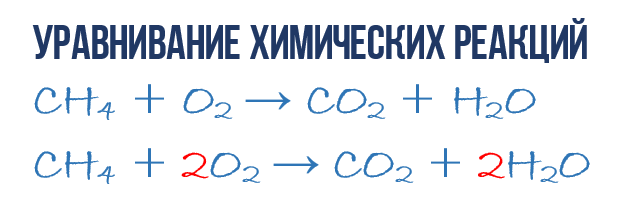
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:

Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Урок химии в 8-м классе по теме “Химические уравнения”
Разделы: Химия
Цель: научить учащихся составлять химические уравнения. Научить их уравнивать с помощью коэффициентов на основе знания закона сохранения массы вещества М.В. Ломоносова.
Задачи:
- Образовательные:
- продолжить изучение физических и химических явлений с введением понятия «химическая реакция»,
- ввести понятие «химическое уравнение»;
- научить учащихся составлять химические уравнения, уравнивать уравнения с помощью коэффициентов.
- Развивающие:
- продолжить развивать творческий потенциал личности учащихся через создание ситуации проблемного обучения, наблюдения, проведения опытов химических реакций.
- Воспитательная:
- воспитать умение работать в команде, группе.
Оборудование: табличный материал, справочники, алгоритмы, набор заданий.
Д/О: «Горение бенгальских огней»:, спички, сухое горючее, железный лист/ ТБ при работе с огнём.
I. Организационный момент
Определение цели урока.
II. Повторение
1) На доске набор физических и химических явлений: испарение воды; фильтрование; ржавление; горение дров; скисание молока; таяние льда; извержение вулкана; растворение сахара в воде.
Задание:
Дать пояснение каждому явлению, назвать практическое применение данного явления в жизни человека.
На доске нарисована капля воды. Создать полную схему превращения воды из одного агрегатного состояния в другое. Как называется данное явление в природе и каково его значение в жизни нашей планеты и всего живого?
III. Д/О «Горение бенгальских огней»
1. Что происходит с магнием, который составляет основу бенгальского огня ?
2. Что явилось основной причиной такого явления?
3. К какому типу относится данная химическая реакция?
4. Попробуйте схематично изобразить химическую реакцию, которую вы наблюдали в этом опыте.
– Предлагаю попробовать составить схему данной реакции:
– Как мы узнали, что получилось другое вещество? (По признакам химической реакции: изменение окраски, появление запаха.)
– Какой газ находится в воздухе, который поддерживает горение? (Кислород – О)
IV. Новый материал
Химическую реакцию можно записывать с помощью химического уравнения.
Можно вспомнить понятия «уравнение», которое дается в математике. В чем суть самого уравнения? Что-то уравнивают, какие-то части.
Попробуем дать определение «химического уравнения», можно смотреть на схему и попытаться дать определение:
Химическое уравнение – это условная запись химической реакции с помощь химических знаков, формул и коэффициентов.
Химические уравнения записываются на основе Закона сохранения массы вещества, открытого М.В.Ломоносовым в 1756 году, который гласит (учебник стр. 96): «Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате её».
– Надо научиться уравнивать химические уравнения с помощью коэффициентов.
– Для того чтобы хорошо научиться составлять химические уравнения, нам необходимо вспомнить:
– Что такое коэффициент?
– Что такое индекс?
Не забываем алгоритм «Составление химических формул».
Предлагаю пошаговый алгоритм составления химического уравнения:
V. Составления химического уравнения
1. Записываю в левой части уравнение вступающие в реакцию вещества: Al + O2
2. Ставлю знак «=» и записываю образующиеся вещества в правой части уравнения – продукты реакции: Al + O2 = Al2O3
3. Уравнивать начинаю с того химического элемента, которого больше или с кислорода, затем составляю конструкцию:
вступило кислорода «2», а получилось «3», их число не равно.
4. Ищу НОК (наименьшее общее кратное) двух цифр «2» и «3» – это «6»
5. Делю НОК «6» на число «2» и «3»и выставляю в качестве коэффициентов перед формулами.
6. Начинаю уравнивать следующие химические элементы – Al, рассуждаю так же. Вступило Al «1», а получилось «4», ищу НОК
Коэффициент «1» в уравнениях не пишется, но учитывается при составлении уравнения.
7. Читаю всю запись химического уравнения.
Такое долгое рассуждение позволяет быстро научиться уравнивать в химических уравнениях, учитывая, что правильное составление уравнений реакций для химии имеет большое значение: решение задач, написание химических реакций.
VI. Задание на закрепление
Фосфор + кислород = оксид фосфора (V)
Серная кислота + алюминий = сульфат алюминия + водород
Вода = водород + кислород
– Работает на доске один сильный ученик.
– Расставить коэффициенты в уравнениях химических реакций.
Химические уравнения отличаются по типам, но это мы рассмотрим на следующем уроке.
VII. Подведение итогов урока
Вывод. Выставление оценок.
VIII. Домашнее задание: § 27, упр. 2, с. 100.
Дополнительный материал: Р.т.с. 90-91, упражнение 2 – индивидуально.
Как составлять химические уравнения 8 класс поэтапно с объяснением
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).
Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции – водорода и кислорода – справа. Между ними поставим стрелку:
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Запишем протекающую реакцию в виде уравнения химической реакции:
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
[spoiler title=”источники:”]
http://urok.1sept.ru/articles/599246
http://kardaeva.ru/88-dlya-uchenika/8-klass/124-sostavlenie-uravnenij-khimicheskikh-reaktsij
[/spoiler]
Алгоритм составления химического уравнения
1.Записываем исходные вещества в левой части уравнения в виде суммы.
2.Ставим знак = и пишем продукты реакции, так же в виде суммы.
3. Находим индексы у продуктов реакции согласно с валентностями.
4.Уравниваем. То есть ставим коэффициенты так чтобы, число атомов в левой части уравнения = числу атомов в правой части уравнения.
а) в первую очередь уравниваем чётные и нечётные значения индексов с помощью математического понятия наименьшее общее кратное,
б) затем уравниваем более лёгкие числа атомов
в) сложные ионы уравниваются группой и не разрываются, например: =SO4; ≡PO4
III II
Например: 4Al + 3O2= 2Al2O3 (жирным шрифтом показаны коэффициенты)
Уравняем О: 2 ∙3 = 6 .| 6 : 2(индекс в О2) = 3 => ставим коэффициент перед O2 – 3
6 : 3(индекс в Al2О3) = 2 => ставим коэффициент перед Al2О3 – 2
Уравняем Al: число атомов алюминия в правой части уравнения =2 ∙2 = 4 (в 2Al2O3) => ставим коэффициент 4 перед Al в левой части уравнения. Ура-а! Уравняли!
3СuSO4 +2Al = Al2(SO4)3 + 3Cu
Исходные вещества = продукты реакции
Левая часть уравнения = правая часть уравнения
Внимание! В середине молекулы коэффициент не ставится.
Коэффициент ставится только перед молекулой
……………………………………………………….
