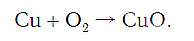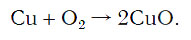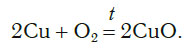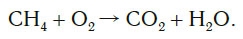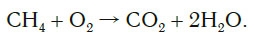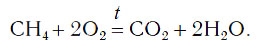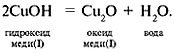Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
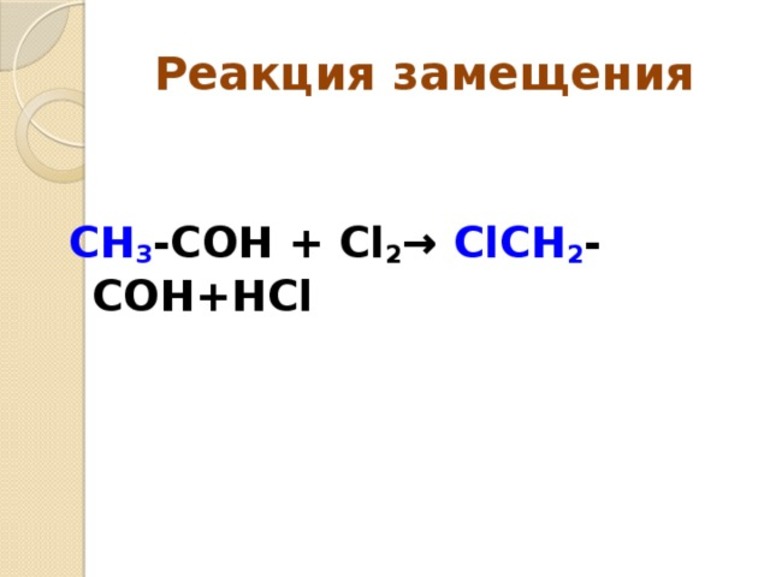
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
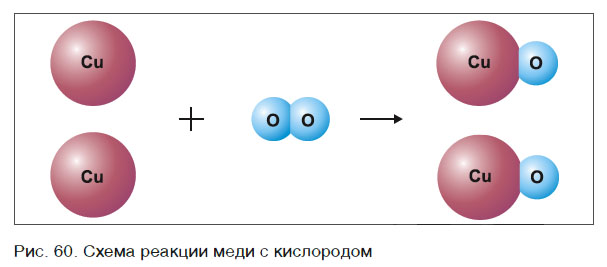
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
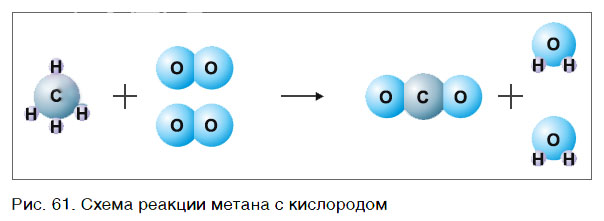
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Как составить уравнение химической реакции: пошаговая инструкция
Превращение одних веществ в другие — обычное явление, которое происходит в ходе химических реакций. Для того чтобы обозначить, как протекают такие процессы, используют специальную систему уравнений. Так, например, горение метана (мы можем наблюдать его каждый день, когда зажигаем газовую плиту) протекает по следующей схеме:
СН4 + 2О2 → СО2 + Н2О
Расшифровать уравнение реакции можно следующим образом. Две молекулы кислорода соединяются с молекулой метана и в результате формируют две молекулы воды и молекулу углекислого газа. Можно отметить, что во время протекания реакции связи между некоторыми атомами (например, водорода и углерода) разрываются. Вместо них появляются новые, благодаря которым и формируются углекислород и вода.
Особенности записи формул химических реакций
Уравнения химических реакций: способы решения заданий
Для удобства записи уравнения химических реакций делают предельно схематичными: их записывают только при помощи латинских букв и цифр. В левой части уравнения указываются реагенты (те вещества, которые взаимодействуют между собой), а в правой — так называемые продукты реакции (те вещества, которые формируются после завершения процесса). При записи уравнения важно помнить о двух правилах.
- Атомы не исчезают никуда и не появляются из ниоткуда (соответственно, их число в обоих частях формулы должно быть одинаковым).
- Общая масса реагентов не может отличаться от итоговой массы продуктов реакции (именно по этой причине записи протекания реакций называют уравнениями).
Какими бывают химические реакции
Выделяют четыре варианта взаимодействия химических веществ друг с другом.
| Тип реакции | Пример | Особенности |
| Соединения | Формула образования воды:
2H2 + O2 = 2H2O |
Несколько реагентов (простых или сложных веществ) создают один продукт. |
| Разложения | При нагревании известняка он разделяется на углекислый газ и негашеную известь:
Стрелка, направленная вверх, показывает, что сформировавшийся газ улетучился и больше не участвует в процессе. |
Одно вещество распадается на несколько простых компонентов. |
| Замещения | При образовании хлорида цинка атомы цинка встают на место атомов водорода, который включен в состав хлороводорода:
Zn + 2HCl = H2↓ + ZnCl2 Направленная вниз стрелка показывает, что вещество осталось в осадке. |
В таких реакциях обязательно участвуют простое и сложное вещества. При более активные атомы простого вещества вытесняют (замещают) компоненты сложного. |
| Обмена | CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl | В таких реакциях обязательно участвуют два сложных вещества, которые обмениваются атомами. Важно помнить: в уравнениях обмена обязательно формируются газ, осадок или вода. |
Как расставить коэффициенты в химических уравнениях
Чтобы уравнение реакции было верным, крайне важно правильно расставить в нем коэффициенты. С помощью этих цифр указывается, какое число молекул необходимо для протекания реакции. Внешне коэффициент выглядит как число, поставленное перед формулой вещества (например, 2NaCl). Важно не перепутать их с индексами: последние как раз ставятся под символом химического элемента и указывают на количество атомов (например, H2).
Если вам требуется узнать, сколько атомов конкретного вещества участвует в реакции, следует индекс умножит на коэффициент. Например, при использовании двух молекул воды (2H₂O) речь идет о четырех атомах водорода и двух атомах кислорода. При решении уравнения реакции задача ученика — подобрать коэффициент и узнать, сколько молекул участвует в процессе.
Помочь разобраться в этом нелегком деле могут наши репетиторы по химии в Москве. Ведь, согласитесь, поспеть за школьной программой порой непросто и некоторые темы требуют более детального изучения, чем отведенные несколько школьных уроков.
Как составить уравнение химической реакции: пошаговая инструкция
- Подготовьте схему реакции. Для этого потребуется выделить реагенты и продукты реакции. Например, для формирования оксида магния схема будет выглядеть так: Mg + O2 → MgO.
- Расставьте коэффициенты. Из предыдущего примера видно, что в левой части уравнения представлено два атома кислорода, а в правой — только один. Поэтому в продукте реакции нужно увеличить количество молекул: Mg + O2 → 2MgO. Теперь у нас есть равное количество атомов кислорода, а вот с магнием возникла проблема. Уравняем и его число: 2Mg + O2 = 2MgO. Обратите внимание, что знак равно можно ставить только после того, как уравнение решено, до этого используется символ горизонтальной стрелки.
Уравнения химических реакций: способы решения заданий
В качестве завершающего примера предложим реакцию разложения нитрата калия. Он образует два вещества: кислород и нитрит калия. Схема реакции выглядит следующим образом: KNO₃ → KNO₂ + О₂. Если с атомами азота и калия все в порядке, то кислорода до момента начала реакции было три, а вот по завершении разложения стало уже четыре. Чтобы уравнять части поставим перед реагентом удвоенный коэффициент: 2KNO₃ → KNO₂ + О₂.
Теперь нужно разобраться с цифрами. До реакции мы имеем по два атома азота и калия и шест атомов кислорода. После же разложения атомов азота и калия по одному, а атомов кислорода всего четыре. Чтобы создать равенство, потребуется поставить удвоенный коэффициент перед нитритом калия в продуктах реакции: 2KNO₃ = 2KNO₂ + О₂. В итоге мы получили равное количество атомов в обеих частях: по два калия и азота и шесть кислорода. Важность уравнений состоит в том, что они не только дают определить, какие вещества получатся в ходе протекания реакции, но и позволяют понять количественное соотношение используемых реагентов.
Как составить химическое уравнение: правила, примеры. Запись химической реакции
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий химических процессов и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений – важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.
Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород – это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na2O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет оксид магния, в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 – 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O2=MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O2=2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и раствором соляной кислоты. Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl2+H2.
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl2+H2.
Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью химических символов, знаков, коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
[spoiler title=”источники:”]
http://egevpare.ru/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B9-%D1%81%D0%BF%D0%BE%D1%81%D0%BE%D0%B1/
http://fb.ru/article/276850/kak-sostavit-himicheskoe-uravnenie-pravila-primeryi-zapis-himicheskoy-reaktsii
[/spoiler]
Реакция замещения в химии — как определить, признаки, примеры уравнений
Перераспределение электронов и ядер, при котором образуется новое вещество, называется химической реакцией. Это физико-химическое взаимодействие, приводящее к образованию нового соединения. Если атомы простого реагента занимают места химических элементов в сложном, то этот процесс называют реакцией замещения. При этом может образовываться не одно, а сразу два вещества.
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
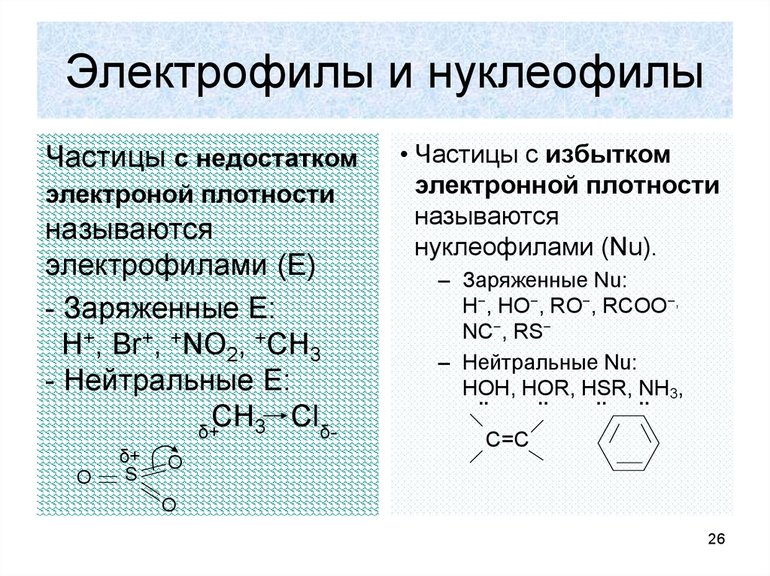
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Реакции замещения
Тип урока. Приобретение новых знаний.
Вид урока. Лабораторная работа.
Обучающие – рассмотреть новый тип реакций – реакции замещения; научить учащихся писать уравнения реакций замещения; формировать умение предсказывать продукты реакций замещения; дать первоначальные понятия об электрохимическом ряде напряжений металлов.
Развивающие – развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к адекватному само- и взаимоконтролю.
Воспитательные – продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах «ученик–ученик», «учитель–ученик», а также наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы. Лабораторная работа; фронтальный опрос; самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок; работа с наглядными средствами – периодической системой химических элементов Д.И.Менделеева и карточками.
Оборудование и реактивы. Кодоскоп, карточки с заданиями для самостоятельной работы по теме «Реакции разложения и соединения», карточки с таблицей «Классификация реакций на основании количества и состава реагирующих веществ», лабораторный штатив с пробирками, кристаллизатор, прибор для получения водорода, лучинка, спички; цинк и магний в гранулах, железный гвоздь, медная проволока, растворы – соляной кислоты, хлорида меди(II), хлорида железа(II).
Учитель. Думаю, что урок вам понравится, вы узнаете много нового. Сегодня вы не соскучитесь, потому что сами будете проводить опыты. Но для начала проверим материал прошлого урока.

Проводится фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений (Габриелян О.С. «Химия-8», М.: изд-во «Дрофа», 2002, упр. 1а, б; 2г; с. 100.)
Учитель. На прошлом уроке* вы познакомились с классификацией химических реакций. По каким признакам классифицируют реакции?
Ученик. Реакции классифицируют по количеству вступивших и образовавшихся веществ и по их составу.
Учитель. С реакциями каких типов вы познакомились?
Ученик. С реакциями разложения и соединения.
Учитель. Дайте определение реакции разложения.
Ученик. Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель. Какая реакция называется реакцией соединения?
Ученик. Реакцией соединения называется реакция, в результате которой из двух или более простых или сложных веществ образуется одно сложное вещество.
Учитель. Для чего в схемах химических реакций расставляют коэффициенты?
Ученик. Для того, чтобы соблюдался закон сохранения массы веществ.
Учитель проверяет домашние упражнения, выполненные на доске, ученики задают дополнительные вопросы отвечающим, выставляются оценки.
Задание 1а, б, с. 100. Запишите в виде химических уравнений следующие предложения:
а) при обжиге карбоната кальция образуются оксид кальция и оксид углерода(IV);
б) при взаимодействии оксида фосфора(V) с водой образуется фосфорная кислота.
Укажите типы этих реакций. Какая из них экзотермическая, а какая – эндотермическая?
Первая – реакция разложения, эндотермическая:
СаСО3 
Вторая – реакция соединения, экзотермическая:
Задание 2г, с. 100. Составьте уравнение по следующей схеме и укажите тип реакции:
СuОН 
Под формулами веществ напишите их названия.
Тип реакции – разложение:
Учитель. Следующий этап урока – самостоятельная работа на два варианта.
Самостоятельная работа (8–10 мин)
Задание. Расставьте коэффициенты, укажите типы химических реакций.
1) MgO + CO2 
2) NO2 + O2 + H2O 
3) Na2O + H2O 
4) KClO3 
5) CO + O2 
1) KNO3 
2) SO2 + O2 
3) SO3 + H2O 
4) K2O + H2O 
5) NO + O2 
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанный тип химической реакции и по 1 баллу за правильно расставленные коэффициенты).
На «5» – 10–9 баллов,
на «4» – 8–7 баллов,
на «3» – 6–5 баллов.
После выполнения заданий учащиеся, сидящие за одной партой, обмениваются работами. Ученики взаимно проверяют работы с помощью кодоскопа, им выставляют отметки по вышеуказанным критериям.
Учитель. Сейчас вы познакомитесь еще с одним типом химических реакций – реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться, потренируетесь в расстановке коэффициентов.

Учитель. Какие ассоциации вызывает у вас название «реакция замещения»?
Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим.
Учитель. Каким по составу – простым или сложным – должно быть вещество, которое замещает элемент сложного вещества?
Ученик. Простым.
Учитель. Каким должен быть состав вещества, в котором происходит замещение?
Ученик. Это вещество должно быть сложным, чтобы атомы одного элемента могли замещаться, а атомы других элементов остались.
Учитель. Обозначим простое вещество буквой А, а сложное вещество – двумя буквами – ВС. Как в этом случае записать общую схему реакции замещения?
Ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в таблицу (табл. 1), которую начали заполнять на прошлом уроке.
| Тип реакции | Уравнения реакций в общем виде |
|---|---|
| Реакция соединения | Соединение двух (нескольких) простых веществ в одно сложное вещество: А + В = АВ. Соединение двух бинарных веществ в одно трехэлементное сложное вещество: АВ + СВ = АСВ2 |
| Реакция разложения | Разложение сложного вещества на два (несколько) простых вещества: АВ = А + В. Разложение трехэлементного сложного вещества на два бинарных вещества: АСВ2 = АВ + ВС |
| Реакция замещения | Взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества: А + ВС = В + АС |
Учитель. Реакцией замещения называется реакция, в которой участвуют одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуются новые вещества – простое и сложное (запись определения в тетрадь).
Рассмотрим на практике реакции замещения. Для этого проведем лабораторную работу. (Учащиеся получают карточки с таблицей (табл. 2) для составления отчета по лабораторной работе «Реакции замещения»). В карточке заполнена графа, дающая представление о том, что нужно сделать. Две другие графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспомните, что работать с растворами кислот нужно осторожно, т. к. они опасны. С растворами работайте по принципу «не разлей», с твердыми веществами – по принципу «не рассыпь». Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта № 1.
Лабораторная работа «Реакции замещения»
| № опыта | Ход работы (что нужно сделать) |
Наблюдения (что увидели) |
Уравнения химических реакций, выводы |
|---|---|---|---|
| 1 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу цинка | Выделяются пузырьки газа | Произошла химическая реакция: Zn + 2HCl = ZnCl2 + H2  . Это реакция замещения, цинк вытеснил водород из соляной кислоты . Это реакция замещения, цинк вытеснил водород из соляной кислоты |
| 2 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу магния | Выделяются пузырьки газа | Произошла химическая реакция: Mg + 2HCl = MgCl2 + H2  . Это реакция замещения, магний вытеснил водород из соляной кислоты . Это реакция замещения, магний вытеснил водород из соляной кислоты |
| 3 | Налейте в пробирку раствор хлорида меди(II), опустите в раствор железный гвоздь | Гвоздь покрывается красным налетом | Произошла химическая реакция: Fe + CuCl2 = FeCl2 + Cu. Это реакция замещения, железо вытеснило медь из раствора соли |
| 4 | Налейте в пробирку раствор хлорида железа(II) и опустите в раствор медную проволоку | Никаких изменений не происходит | Эта реакция невозможна: FeCl2 + Cu  .Менее активная медь не может вытеснить более активное железо из раствора соли .Менее активная медь не может вытеснить более активное железо из раствора соли |
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, поскольку выделился газ.
Учитель. Чтобы составить уравнение химической реакции, надо предположить, какие вещества образовались в результате этой реакции. (Учитель у доски объясняет принцип составления уравнений реакций такого типа и предлагает учащимся самостоятельно расставить коэффициенты.)
Из уравнения реакции видно, что получился газ водород. Открою вам маленький секрет: вы сейчас прошли тем же путем, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории.
Но водород еще нужно собрать. Догадайтесь, как собрать водород в другую пробирку.
Правило при работе с кислотами:
«Не разлей!» Фото Л.Ларионовой
Ученик. Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку.
Учитель. Что находится в пустой пробирке?
Ученик. Воздух.
Учитель. Найдите относительную молекулярную массу водорода и скажите, что легче – водород или воздух?
Ученик. Легче водород, потому что его относительная молекулярная масса Mr(H2) равна двум.
Учитель. В этом случае пробирку, в которую собирают водород, необходимо перевернуть вверх дном. Такой способ собирания газов называется способом вытеснения воздуха.
Учитель проводит демонстрационный опыт. после этого учащиеся приступают к самостоятельному выполнению опыта № 2.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, т.к. выделился газ.
Учитель. Предположите, какой газ выделился в результате этой химической реакции.
Ученик. В результате замещения атомов водорода в соляной кислоте на атомы магния выделился водород.
Учитель. Составьте уравнение этой химической реакции и расставьте в нем коэффициенты. Сравните скорости взаимодействия магния и цинка с соляной кислотой.
Оказывается, скорость взаимодействия металла с кислотой зависит от активности металла. Все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов. Посмотрите, какой неметалл занесен в этот ряд.
Ученик. Неметалл в ряду металлов – водород.
Учитель. Металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Будет ли медь вытеснять водород из раствора соляной кислоты?
Ученик. Нет, такая реакция невозможна, т.к. медь находится в электрохимическом ряду напряжений металлов за водородом.
Учитель демонстрирует опыты, подтверждающие выдвинутую гипотезу, и делает вывод, что электрохимический ряд напряжений металлов позволяет не только предсказывать продукты реакции, но и определять возможность протекания той или иной реакции.
Учащиеся выполняют опыты № 3 и 4.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Что вы наблюдали при проведении этих опытов?
Ученик. В первой реакции гвоздь покрылся красным налетом меди, а во второй никаких изменений не произошло.
Учитель. Почему невозможна вторая реакция?
Ученик. Медь в электрохимическом ряду напряжений металлов находится правее железа, значит, она менее активна и не может его вытеснить.
Учитель. Запишите уравнения взаимодействия железа с хлоридом меди(II). (Результаты работы проверяются с помощью кодоскопа.)

Учитель. Итак, сегодня вы познакомились еще с одним типом химических реакций – реакциями замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнения.
На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие – нет. Дайте развернутый ответ. (Спрашивать по одному ученику на составление каждого уравнения реакции.)
Задание. Расставьте коэффициенты в схемах возможных химических реакций.
Аg + Н2SO4 (р-р) 
Fe + НСl 
АgNO3 + Сu 
СuO + H2 
Al + FeSO4 
Fe(NO3)3 + Hg 
Аl + Н2SO4 (р-р) 
Ответ. Уравнения возможных реакций:
Заключительная часть. Учитель подводит итоги урока, анализирует полученные результаты.
Домашнее задание. По учебнику О.С.Габриеляна «Химия-8» § 27, упр. 2а, 3в, с. 100.
* См. № 7/2006, «Реакции разложения и соединения»
Литература
Габриелян О.С. Химия. 8 класс. М.: Дрофа, 2002, 208 с.; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. 8 класс. М.: Дрофа, 2002, 416 с.; Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001, 224 с.; Кузнецова Н.Е., Титова И.М.,
Гара Н.Н., Жегин А.Ю. Химия. 8 класс. М: Вентана-Граф, 2003, 224 с.; Гин А. Приемы педагогической техники. Пособие для учителя. М.: Вита-Пресс, 2003, 88 с.
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
источники:
http://him.1sept.ru/article.php?ID=200601011
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html
КОНКУРС “Я ИДУ НА
УРОК”
Реакции замещения
Тип урока. Приобретение новых знаний.
Вид урока. Лабораторная работа.
Цели.
Обучающие – рассмотреть новый тип
реакций – реакции замещения; научить учащихся
писать уравнения реакций замещения; формировать
умение предсказывать продукты реакций
замещения; дать первоначальные понятия об
электрохимическом ряде напряжений металлов.
Развивающие – развивать умения ставить
несложные проблемы, формулировать гипотезы и
проводить их опытную проверку; совершенствовать
умения работать с лабораторным оборудованием и
реактивами; продолжить формирование умений
оформлять результаты учебного эксперимента;
развивать способность к адекватному само- и
взаимоконтролю.
Воспитательные – продолжить
формирование научного мировоззрения учащихся;
воспитывать культуру общения через работу в
парах «ученик–ученик», «учитель–ученик», а
также наблюдательность, внимание, пытливость,
инициативу.
Методы и методические приемы. Лабораторная
работа; фронтальный опрос; самостоятельная
работа с карточками, взаимопроверка результатов
самостоятельной работы в парах, выставление
отметок; работа с наглядными средствами –
периодической системой химических элементов
Д.И.Менделеева и карточками.
Оборудование и реактивы. Кодоскоп, карточки
с заданиями для самостоятельной работы по теме
«Реакции разложения и соединения», карточки с
таблицей «Классификация реакций на основании
количества и состава реагирующих веществ»,
лабораторный штатив с пробирками,
кристаллизатор, прибор для получения водорода,
лучинка, спички; цинк и магний в гранулах,
железный гвоздь, медная проволока, растворы –
соляной кислоты, хлорида меди(II), хлорида
железа(II).
ХОД УРОКА
Учитель. Думаю, что урок вам
понравится, вы узнаете много нового. Сегодня вы
не соскучитесь, потому что сами будете проводить
опыты. Но для начала проверим материал прошлого
урока.
Актуализация
знаний
Проводится фронтальный опрос, во время
которого трое учащихся записывают на доске
решение домашних упражнений (Габриелян О.С. «Химия-8»,
М.: изд-во «Дрофа», 2002, упр. 1а, б; 2г; с. 100.)
Учитель. На прошлом уроке*
вы познакомились с классификацией химических
реакций. По каким признакам классифицируют
реакции?
Ученик. Реакции классифицируют по
количеству вступивших и образовавшихся веществ
и по их составу.
Учитель. С реакциями каких типов вы
познакомились?
Ученик. С реакциями разложения и
соединения.
Учитель. Дайте определение реакции
разложения.
Ученик. Реакцией разложения
называется реакция, в результате которой из
одного сложного вещества образуется несколько
простых или сложных веществ.
Учитель. Какая реакция называется
реакцией соединения?
Ученик. Реакцией соединения
называется реакция, в результате которой из двух
или более простых или сложных веществ образуется
одно сложное вещество.
Учитель. Для чего в схемах
химических реакций расставляют коэффициенты?
Ученик. Для того, чтобы соблюдался
закон сохранения массы веществ.
Учитель проверяет домашние упражнения,
выполненные на доске, ученики задают
дополнительные вопросы отвечающим, выставляются
оценки.
Задание 1а, б, с. 100. Запишите в виде
химических уравнений следующие предложения:
а) при обжиге карбоната кальция образуются
оксид кальция и оксид углерода(IV);
б) при взаимодействии оксида фосфора(V) с водой
образуется фосфорная кислота.
Укажите типы этих реакций. Какая из них
экзотермическая, а какая – эндотермическая?
Решение
Первая – реакция разложения, эндотермическая:
СаСО3 СаО
+ СО2.
Вторая – реакция соединения, экзотермическая:
P2O5 + 3H2O = 2H3PO4.
Задание 2г, с. 100. Составьте уравнение по
следующей схеме и укажите тип реакции:
СuОН Сu2О +
Н2О.
Под формулами веществ напишите их названия.
Решение
Тип реакции – разложение:
Учитель. Следующий этап урока –
самостоятельная работа на два варианта.
Самостоятельная работа (8–10 мин)
Задание. Расставьте коэффициенты,
укажите типы химических реакций.
Вариант I
1) MgO + CO2 MgCO3;
2) NO2 + O2 + H2O HNO3;
3) Na2O + H2O NaOH;
4) KClO3 KCl + O2;
5) CO + O2 CO2.
Вариант II
1) KNO3 KNO2 + O2;
2) SO2 + O2 SO3;
3) SO3 + H2O H2SO4;
4) K2O + H2O KOH;
5) NO + O2 NO2.
Критерии оценки
Максимально можно набрать 10 баллов (по 1 баллу
за правильно указанный тип химической реакции и
по 1 баллу за правильно расставленные
коэффициенты).
На «5» – 10–9 баллов,
на «4» – 8–7 баллов,
на «3» – 6–5 баллов.
После выполнения заданий учащиеся, сидящие за
одной партой, обмениваются работами. Ученики
взаимно проверяют работы с помощью кодоскопа, им
выставляют отметки по вышеуказанным критериям.
Учитель. Сейчас вы познакомитесь еще
с одним типом химических реакций – реакциями
замещения, научитесь записывать уравнения этих
реакций, предсказывать, какие вещества должны
образоваться, потренируетесь в расстановке
коэффициентов.
Изучение
нового материала
Фронтальная беседа
Учитель. Какие ассоциации вызывает у
вас название «реакция замещения»?
Выслушать все мнения, выбрать предположение о
том, что одно должно замещаться другим.
Учитель. Каким по составу – простым
или сложным – должно быть вещество, которое
замещает элемент сложного вещества?
Ученик. Простым.
Учитель. Каким должен быть состав
вещества, в котором происходит замещение?
Ученик. Это вещество должно быть
сложным, чтобы атомы одного элемента могли
замещаться, а атомы других элементов остались.
Учитель. Обозначим простое вещество
буквой А, а сложное вещество – двумя буквами
– ВС. Как в этом случае записать общую схему
реакции замещения?
Ученик у доски записывает общую схему реакции
замещения, учащиеся на местах делают записи в
таблицу (табл. 1), которую начали заполнять на
прошлом уроке.
Таблица 1
Классификация реакций на
основании
количества и состава реагирующих веществ
| Тип реакции | Уравнения реакций в общем виде |
|---|---|
| Реакция соединения | Соединение двух (нескольких) простых веществ в одно сложное вещество: А + В = АВ. Соединение двух бинарных веществ в одно трехэлементное сложное вещество: АВ + СВ = АСВ2 |
| Реакция разложения | Разложение сложного вещества на два (несколько) простых вещества: АВ = А + В. Разложение трехэлементного сложного вещества на два бинарных вещества: АСВ2 = АВ + ВС |
| Реакция замещения | Взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества: А + ВС = В + АС |
Учитель. Реакцией замещения
называется реакция, в которой участвуют одно
простое и одно сложное вещество, при этом атомы
простого вещества замещают один из видов атомов
в сложном веществе и образуются новые вещества –
простое и сложное (запись определения в
тетрадь).
Рассмотрим на практике реакции замещения. Для
этого проведем лабораторную работу. (Учащиеся
получают карточки с таблицей (табл. 2) для
составления отчета по лабораторной работе
«Реакции замещения»). В карточке заполнена
графа, дающая представление о том, что нужно
сделать. Две другие графы вы заполните после
выполнения опытов.
Прежде чем приступить к выполнению опытов,
вспомните, что работать с растворами кислот
нужно осторожно, т. к. они опасны. С растворами
работайте по принципу «не разлей», с твердыми
веществами – по принципу «не рассыпь». Опыт
проводить над кристаллизатором. Вещества
наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта № 1.
Таблица 2
Лабораторная работа «Реакции
замещения»
| № опыта | Ход работы (что нужно сделать) |
Наблюдения (что увидели) |
Уравнения химических реакций, выводы |
|---|---|---|---|
| 1 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу цинка |
Выделяются пузырьки газа | Произошла химическая реакция: Zn + 2HCl = ZnCl2 + H2 Это реакция замещения, цинк вытеснил водород из соляной кислоты |
| 2 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу магния |
Выделяются пузырьки газа | Произошла химическая реакция: Mg + 2HCl = MgCl2 + H2 Это реакция замещения, магний вытеснил водород из соляной кислоты |
| 3 | Налейте в пробирку раствор хлорида меди(II), опустите в раствор железный гвоздь |
Гвоздь покрывается красным налетом | Произошла химическая реакция: Fe + CuCl2 = FeCl2 + Cu. Это реакция замещения, железо вытеснило медь из раствора соли |
| 4 | Налейте в пробирку раствор хлорида железа(II) и опустите в раствор медную проволоку |
Никаких изменений не происходит | Эта реакция невозможна: FeCl2 + Cu активная медь не может вытеснить более активное железо из раствора соли |
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что
произошла химическая реакция?
Ученик. Да, поскольку выделился газ.
Учитель. Чтобы составить уравнение
химической реакции, надо предположить, какие
вещества образовались в результате этой реакции.
(Учитель у доски объясняет принцип составления
уравнений реакций такого типа и предлагает
учащимся самостоятельно расставить
коэффициенты.)
Из уравнения реакции видно, что получился газ
водород. Открою вам маленький секрет: вы сейчас
прошли тем же путем, который проделал английский
химик Генри Кавендиш. Именно он предложил такой
способ получения водорода в лаборатории.
Но водород еще нужно собрать. Догадайтесь, как
собрать водород в другую пробирку.
|
|
Правило при работе с кислотами:
|
Ученик. Нужно закрыть пробирку
пробкой с газоотводной трубкой, конец которой
опустить в другую пробирку.
Учитель. Что находится в пустой
пробирке?
Ученик. Воздух.
Учитель. Найдите относительную
молекулярную массу водорода и скажите, что легче
– водород или воздух?
Ученик. Легче водород, потому что его
относительная молекулярная масса Mr(H2)
равна двум.
Учитель. В этом случае пробирку, в
которую собирают водород, необходимо
перевернуть вверх дном. Такой способ собирания
газов называется способом вытеснения воздуха.
Учитель проводит демонстрационный опыт. после
этого учащиеся приступают к самостоятельному
выполнению опыта № 2.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что
произошла химическая реакция?
Ученик. Да, т.к. выделился газ.
Учитель. Предположите, какой газ
выделился в результате этой химической реакции.
Ученик. В результате замещения
атомов водорода в соляной кислоте на атомы
магния выделился водород.
Учитель. Составьте уравнение этой
химической реакции и расставьте в нем
коэффициенты. Сравните скорости
взаимодействия магния и цинка с соляной
кислотой.
Оказывается, скорость взаимодействия металла с
кислотой зависит от активности металла. Все
металлы в зависимости от своей активности
расположены в ряд. Этот ряд называется
электрохимическим рядом напряжений металлов.
Посмотрите, какой неметалл занесен в этот ряд.
Ученик. Неметалл в ряду металлов –
водород.
Учитель. Металлы, стоящие в
электрохимическом ряду напряжений до водорода,
способны вытеснять его из растворов кислот.
Будет ли медь вытеснять водород из раствора
соляной кислоты?
Ученик. Нет, такая реакция
невозможна, т.к. медь находится в
электрохимическом ряду напряжений металлов за
водородом.
Учитель демонстрирует опыты, подтверждающие
выдвинутую гипотезу, и делает вывод, что
электрохимический ряд напряжений металлов
позволяет не только предсказывать продукты
реакции, но и определять возможность протекания
той или иной реакции.
Учащиеся выполняют опыты № 3 и 4.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Что вы наблюдали при
проведении этих опытов?
Ученик. В первой реакции гвоздь
покрылся красным налетом меди, а во второй
никаких изменений не произошло.
Учитель. Почему невозможна вторая
реакция?
Ученик. Медь в электрохимическом
ряду напряжений металлов находится правее
железа, значит, она менее активна и не может его
вытеснить.
Учитель. Запишите уравнения
взаимодействия железа с хлоридом меди(II).
(Результаты работы проверяются с помощью
кодоскопа.)
Закрепление
изученного материала
Учитель. Итак, сегодня вы
познакомились еще с одним типом химических
реакций – реакциями замещения. Узнали, что
продукты реакций замещения можно предсказывать,
используя электрохимический ряд напряжений
металлов. Теперь для закрепления полученных
знаний выполните упражнения.
На доске предложены схемы реакций замещения.
Укажите, какие из этих реакций можно осуществить,
а какие – нет. Дайте развернутый ответ.
(Спрашивать по одному ученику на составление
каждого уравнения реакции.)
Задание. Расставьте коэффициенты в
схемах возможных химических реакций.
Аg + Н2SO4 (р-р)
… ,
Fe + НСl … ,
АgNO3 + Сu … ,
СuO + H2 … ,
Al + FeSO4 … ,
Fe(NO3)3 + Hg … ,
Аl + Н2SO4 (р-р)
… .
Ответ. Уравнения возможных реакций:
Fe + 2НСl = FeCl2 + H2,
2АgNO3 + Сu = Cu(NO3)2 + 2Ag,
СuO + H2 = H2O + Cu,
2Al + 3FeSO4 = Al2(SO4)3 + 3Fe,
2Аl + 3Н2SO4 (р-р) = Al2(SO4)3
+ 3H2.
Заключительная часть. Учитель подводит
итоги урока, анализирует полученные результаты.
Домашнее задание. По учебнику
О.С.Габриеляна «Химия-8» § 27, упр. 2а, 3в, с. 100.
* См. № 7/2006, «Реакции
разложения и соединения»
Литература
Габриелян О.С. Химия. 8 класс. М.: Дрофа, 2002, 208 с.;
Габриелян О.С., Воскобойникова Н.П., Яшукова А.В.
Настольная книга учителя. 8 класс. М.: Дрофа, 2002, 416
с.; Габриелян О.С., Смирнова Т.В. Изучаем химию
в 8 классе. Методическое пособие к учебнику
О.С.Габриеляна «Химия-8» для учащихся и учителей.
М.: Блик и Ко, 2001, 224 с.; Кузнецова Н.Е., Титова И.М.,
Гара Н.Н., Жегин А.Ю. Химия. 8 класс. М:
Вентана-Граф, 2003, 224 с.; Гин А. Приемы
педагогической техники. Пособие для учителя. М.:
Вита-Пресс, 2003, 88 с.
Т.Н.Синчук,
учитель химии школы № 1
(г. Светлый, Калининградская обл.);
Н.Б.Левичева,
учитель-методист (г. Калининград)
План урока:
Введение
Уравнения химических реакций
Типы химических реакций
Введение
Изменения в веществах принято называть явлениями, которые условно называют физические и химические. Давайте подробно разберём данные понятия, и выделим, в чём состоит их отличие.
Чтобы ответить на данный вопрос, проделаем опыт. Возьмите форму для льда, налейте воды с крана и поставьте в морозилку на пару часов. Не трудно предположить, что вода замёрзнет. Почему? Температура замерзания воды 0°C. Если кусочек льда оставить в комнате, то он растает и снова будет жидкостью. Что произошло с водой? Первое, она поменяла форму, жидкость принимает форму сосуда, а также агрегатное состояние жидкость – твёрдое – жидкость. Но вода осталась водой, т.е. не изменился качественный и количественный состав.
Меняя условия (температуру среды), вода меняет только агрегатное состояние, но никакие больше изменения с ней не происходят, не меняется состав вещества. Такие явления рассматриваются на уроках физики, и они носят название физические.
Примеры данных явлений Вам известен с детства, во время лепки пластилина, от теплоты рук он смягчается. А вспомните свой любимый праздник День Рождения, восковые свечи, которые ставите в торт, если долго придумываете желание, то они станут мягкими. Но что происходит со свечой, когда мы её зажигаем, чтобы загадать желание? Какие процессы происходят во время её горения? В руках она просто смягчается, а во время горения свеча «исчезает», при этом выделяется свет, тепло и газ. Происходят необратимые процессы – образование новых веществ.
Или запишем химическим языком данное явление
2C18H38 + 55O2 → 36CO2 + 38H2O
Обратите внимание, что качественный состав никак не изменился. Как до, так и после реакции имеется только три элемента: С, О, Н.
Из этого следует, что явления, при которых образуются новые вещества – это химические
Ежесекундно происходят тысячи явлений, мир не стоит на месте, с веществами происходят процессы. Рассмотрим, по каким признакам отличаются физические и химические явления.
Возьмём, к примеру, круговорот воды в природе. Меняя своё агрегатное состояние, она всё также остаётся водой. Самое главное отличие: при физических процессах не образуются новые вещества.
Чтобы понять суть химических явлений предлагаем Вам выполнить ещё один опыт:
Возьмите два стакана, один наполните водой, второй молоком, и оставьте их в тёплом месте на ночь. Проснувшись утром, Вы обнаружите, что внешний вид молока изменился, и не только вид, а вкус и запах. Это яркий пример химической реакции, во время которой происходит изменения вкуса и запаха. Если к образовавшемуся кефиру добавить щепотку соды, наблюдаем выделение пузырьков газа, происходит ещё одна реакция «гашение соды».
Другой пример: качество воды, а именно её твёрдость, легко определить по образованию осадка известняка на чайнике, который легко растворяется в кислоте: уксусной, лимонной. Это также является признаком химической реакции, также как и образование накипи при кипячении.
Следовательно, чтобы отнести какое-либо явление к химическим, сравниваем по следующим признакам:
Физические явления характеризуются сменой агрегатного состояния. Во время химического явления происходят явные изменения, по которым мы можем судить об образовании других веществ.
Уравнения химических реакций
Вещества образуются во время химических процессов. Каждое соединение имеет химическую формулу. Чтобы описать происходящий процесс языком химии, используют уравнения реакций.
Используя постулаты атомно-молекулярного учения, можем сказать, что образование новых веществ является следствием перегруппировки атомов.
Возьмём медную проволоку и нагреем в пламени горелки. Медь металл красного цвета, после нагревания становится чёрной. Что с ней произошло?
Источник
Кислород О2 и медь Cu относятся к простым соединениям, образуют сложное соединение CuO.Чтобы описать данный процесс, используем символы в схеме реакции. Слева от стрелки реагенты, справа находятся продукты реакции.
Cu + O2 → CuO
Обратите внимание на рисунок и на схему. Согласно рисунку, чтобы произошла реакция, берут два атома Меди и одну молекулу кислорода О2. В следствии образуется две молекулы CuO оксида меди (II). Схема показывает, что до реакции 1 атом меди и молекула кислорода образуют сложное вещество CuO. Так как не появился новый вид атомов, а произошла только их перегруппировка, то их количество должно быть равно. Посмотрев на схему, можно увидеть, что количество отличается:
|
До реакции |
После реакции |
||
|
Cu |
1 |
= |
1 |
|
O |
2 |
> |
1 |
Чтобы схема стала уравнением, используем закон сохранения массы вещества (ЗСМВ), который был открыт Михаилом Васильевичем Ломоносовым. До его открытия, ЗСМВ носил разнообразные названия. Древние философы называли его «Законом сохранения атомов», а точнее «Принципом сохранения и неуничтожимости материи».
Используя ЗСМВ сделаем схему уравнением реакции, т.е. уравняем левую и правую части. Начнём с Кислорода. В правой части поставим 2 перед формулой (надеемся, Вы помните, что коэффициенты ставят перед формулой и никак не в средине)
Cu + O2 → 2CuO
Наверняка вы заметили, что изменилось количество атомов меди после реакции, чтобы было поровну, поставим 2 перед Cu.
2Cu + O2 → 2CuO
Источник
Следуя данному алгоритму, расставим коэффициенты в уравнении реакции
CH4 + O2 → CO2 + H2O
Начнём с Углерода, до реакции 1, после реакции 1. 1 = 1
Водород 4 > 2. Выбираем НОК (наименьшее общее кратное), это 4. Делим на индексы. До реакции 4/4 = 1. Значит перед СН4 должен быть коэффициент 1. После реакции 4/2 = 2. Перед Н2О ставим 2.
CH4 + O2 → CO2 + 2H2O
Кислород 2 < 4. Обратите внимание, Кислород входит в состав СО2 и Н2О, и перед водой стоит коэффициент 2. В сумме выходит 4. НОК равно 4. Выполнив аналогичные действия, как и с Водородом. Получаем коэффициент 2 перед О2.
CH4 + 2O2 → CO2 + 2H2O
Следует обратить внимание, что существуют так называемые «группы» атомов – кислотные остатки и гидроксо-группа –ОН. С ними Вы познакомитесь чуть позже, а сейчас рассмотрим принцип расстановки коэффициентов, используя эти группы.
Типы химических реакций
Существует большое количество реакций, но в зависимости от числа компонентов реагентов выделяют следующие типы.
Реакции соединения
Не составит труда догадаться, что реагирующие вещества будут «соединяться». Что происходит с реагентами в данном случае.
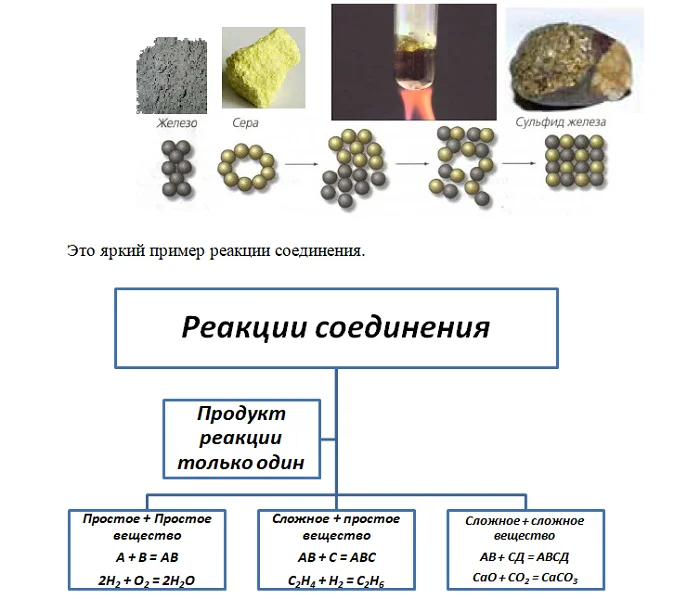
Рассмотрим два случая. Первый возьмём железные опилки и порошок серы и смешаем их. Результатом будет смесь, ведь каждое вещество сохраняет свои индивидуальные свойства.
Разделить вновь на составные компоненты можно используя, например, магнит, на котором будут находиться опилки железа. Либо налить стакан воды, из-за разной плотности, металл будет внизу, а жёлтая сера – вверху.
Но если эту же смесь нагреть, то образуется сложное вещество – сульфид железа FeS, в котором атомы Железа и Серы соединены с помощью химической связи. Также доказать, что Железо находится в связанном виде, можем с помощью магнита, который не будет притягивать данное соединение.
Обращаем внимание, что во всех трёх примерах продукт реакции только один. Это основной признак: соединение в единое (сложное), возможно как между простыми(S + O2 → SO2) так и сложными (H2O + SO2 → H2SO3).
Реакции разложения
В мире существуют противоположности, день – ночь, добро – зло, чёрное – белое, плюс – минус, зима – лето…Антонимом к соединению является разложение (распад).
Признаком этого вида является наличие только одного реагента, и несколько продуктов реакции.
Если при реакциях соединения зачастую выделяется тепло. Чтобы разрушить химические связи, необходимо приложить усилие, точнее нагреть. Следственно реакции разложения осуществляются при нагревании.
Реакции замещения
Вспомним математику, а точнее состав числа 3. Оно выражается как сумма 1 + 2 или 2 +1. Больше комбинаций не существует. Аналогично и в химии, когда реагируют простые и сложные соединения, атом одного элемента, «замещает» место другого элемента.
Особенностью этого типа является, до реакции и после будет только два вещества (простое и сложное).
Реакции обмена
Характерной чертой данного типа является, что эти процессы характерны только для сложных веществ (чтобы было чем меняться). Реагенты и продукты будут сложные вещества.
Обобщив всё выше сказанное, сделаем краткие выводы:
Во время химических процессов совершается разрыв связей в реагентах и образуются новые в продуктах реакции.
В зависимости от числа компонентов реакции, выделяют следующие типы:
Химия – это наука о веществах, их свойствах и превращениях.
То есть, если с окружающими нас веществами ничего не происходит, то это не относится к химии. Но что значит, «ничего не происходит»? Если в поле нас вдруг застала гроза, и мы все промокли, как говорится «до нитки», то это ли не превращение: ведь одежда была сухой, а стала мокрой.
Если, к примеру взять железный гвоздь, обработать его напильником, а затем собрать железные опилки (Fe), то это ли так же не превращение: был гвоздь – стал порошок. Но если после этого собрать прибор и провести получение кислорода (О2): нагреть перманганат калия (КМпО4) и собрать в пробирку кислород, а затем в неё поместить раскалённые «до красна» эти железные опилки, то они вспыхнут ярким пламенем и после сгорания превратятся в порошок бурого цвета. И это так же превращение. Так где же химия? Несмотря на то, что в этих примерах меняется форма (железный гвоздь) и состояние одежды (сухая, мокрая) – это не превращения. Дело в том, что сам по себе гвоздь как был веществом (железо), так им и остался, несмотря на другую свою форму, а воду от дождя как впитала наша одежда, так потом его и испарила в атмосферу. Сама вода не изменилась. Так что же такое превращения с точки зрения химии?
Превращениями с точки зрения химии называются такие явления, которые сопровождаются изменением состава вещества. Возьмём в качестве примера тот же гвоздь. Не важно, какую форму он принял после обработки напильником, но после того как собранные от него железные опилки поместили в атмосферу кислорода – он превратился в оксид железа (Fe2O3). Значит, что-то всё-таки изменилось? Да, изменилось. Было вещество гвоздь, но под воздействием кислорода сформировалось новое вещество – оксид элемента железа. Молекулярное уравнение этого превращения можно отобразить следующими химическими символами:
4Fe + 3O2 = 2Fe2O3 (1)
Для непосвящённого в химии человека сразу возникают вопросы. Что такое «молекулярное уравнение», что такое Fe? Почему поставлены цифры «4», «3», «2»? Что такое маленькие цифры «2» и «3» в формуле Fe2O3 ? Это значит, наступило время во всём разобраться по порядку.
Знаки химических элементов.
Несмотря на то, что химию начинают изучать в 8-м классе, а некоторые даже раньше, многим известен великий русский химик Д. И. Менделеев. И конечно же, его знаменитая «Периодическая система химических элементов». Иначе, проще, её называют «Таблица Менделеева».
В этой таблице, в соответствующем порядке, располагаются элементы. К настоящему времени их известно около 120. Названия многих элементов нам были известны ещё давно. Это: железо, алюминий, кислород, углерод, золото, кремний. Раньше мы не задумываясь применяли эти слова, отождествляя их с предметами: железный болт, алюминиевая проволока, кислород в атмосфере, золотое кольцо и т.д. и т.д. Но на самом деле все эти вещества (болт, проволока, кольцо) состоят из соответствующих им элементов. Весь парадокс состоит в том, что элемент нельзя потрогать, взять в руки. Как же так? В таблице Менделеева они есть, а взять их нельзя! Да, именно так. Химический элемент – это абстрактное (то есть отвлечённое) понятие, и используется в химии, впрочем как и в других науках, для расчётов, составления уравнений, при решении задач. Каждый элемент отличается от другого тем, что для него характерна своя электронная конфигурация атома. Количество протонов в ядре атома равно количеству электронов в его орбиталях. К примеру, водород – элемент №1. Его атом состоит из 1-го протона и 1-го электрона. Гелий – элемент №2. Его атом состоит из 2-х протонов и 2-х электронов. Литий – элемент №3. Его атом состоит из 3-х протонов и 3-х электронов. Дармштадтий – элемент №110. Его атом состоит из 110-и протонов и 110-и электронов.
Каждый элемент обозначается определённым символом, латинскими буквами, и имеет определённое прочтение в переводе с латинского. Например, водород имеет символ «Н», читается как «гидрогениум» или «аш». Кремний имеет символ «Si» читается как «силициум». Ртуть имеет символ «Нg» и читается как «гидраргирум». И так далее. Все эти обозначения можно найти в любом учебнике химии за 8-й класс. Для нас сейчас главное уяснить то, что при составлении химических уравнений, необходимо оперировать указанными символами элементов.
Простые и сложные вещества.
Обозначая единичными символами химических элементов различные вещества (Hg ртуть, Fe железо, Cu медь, Zn цинк, Al алюминий) мы по сути обозначаем простые вещества, то есть вещества, состоящие из атомов одного вида (содержащие одно и то же количество протонов и нейтронов в атоме). Например, если во взаимодействие вступают вещества железо и сера, то уравнение примет следующую форму записи:
Fe + S = FeS (2)
К простым веществам относятся металлы (Ва, К, Na, Mg, Ag), а так же неметаллы (S, P, Si, Cl2, N2, O2, H2). Причём следует обратить
особое внимание на то, что все металлы обозначаются единичными символами: К, Ва, Са, Аl, V, Mg и т.д., а неметаллы – либо простыми символами: C,S,P или могут иметь различные индексы, которые указывают на их молекулярное строение: H2, Сl2, О2, J2, P4, S8. В дальнейшем это будет иметь очень большое значение при составлении уравнений. Совсем не трудно догадаться, что сложными веществами являются вещества, образованные из атомов разного вида, например,
1). Оксиды:
оксид алюминия Al2O3, 
оксид меди CuO,
оксид цинка ZnO,
оксид титана Ti2O3 ,
угарный газ или оксид углерода (+2) CO,
оксид серы (+6) SO3
2). Основания:
гидроксид железа (+3) Fe(OH)3,
гидроксид меди Cu(OH)2 ,
гидроксид калия или щёлочь калия КOH,
гидроксид натрия NaOH.
3). Кислоты:
соляная кислота HCl,
сернистая кислота H2SO3,
азотная кислота HNO3
4). Соли:
тиосульфат натрия Na2S2O3,
сульфат натрия или глауберова соль Na2SO4 ,
карбонат кальция или известняк СаCO3,
хлорид меди CuCl2
5). Органические вещества:
ацетат натрия СН3СООNa,
метан СН4,
ацетилен С2Н2 ,
глюкоза С6Н12О6
Наконец, после того как мы выяснили структуру различных веществ, можно приступать к составлению химических уравнений.
Химическое уравнение.
Само слово «уравнение» производное от слова «уравнять», т.е. разделить нечто на равные части. В математике уравнения составляют чуть ли не самую сущность этой науки. К примеру, можно привести такое простое уравнение, в котором левая и правая части будут равны «2» :
40 : (9 + 11) = (50 х 2) : ( 80 – 30 );
И в химических уравнениях тот же принцип: левая и правая части уравнения должны соответствовать одинаковым количествам атомов, участвующим в них элементов. Или, если приводится ионное уравнение, то в нём число частицтак же должно соответствовать этому требованию. Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков . Химическое уравнение по своей сути отражает ту или иную химическую реакцию, то есть процесс взаимодействия веществ, в процессе которых возникают новые вещества. Например, необходимо написать молекулярное уравнение реакции, в которой принимают участие хлорид бария ВаСl2 и серная кислота H2SO4. В результате этой реакции образуется нерастворимый осадок – сульфат бария ВаSO4 и соляная кислота НСl :
ВаСl2 + H2SO4 = BaSO4 + 2НСl (3)
Прежде всего необходимо уяснить, что большая цифра «2», стоящая перед веществом НСlназывается коэффициентом, а малые цифры «2», «4» под формулами ВаСl2, H2SO4 ,BaSO4 называются индексами. И коэффициенты и индексы в химических уравнениях выполняют роль множителей, а не слагаемых. Что бы правильно записать химическое уравнение, необходимо расставить коэффициенты в уравнении реакции. Теперь приступим к подсчёту атомов элементов в левой и правой частях уравнения. В левой части уравнения: в веществе ВаСl2 содержатся 1 атом бария (Ва), 2 атома хлора (Сl). В веществе H2SO4: 2 атома водорода (Н), 1 атом серы (S) и 4 атома кислорода (О) . В правой части уравнения: в веществе BaSO4 1 атом бария (Ва) 1 атом серы (S) и 4 атома кислорода (О), в веществе НСl: 1 атом водорода (Н) и 1 атом хлора (Сl). Откуда следует, что в правой части уравнения количество атомов водорода и хлора вдвое меньше, чем в левой части. Следовательно, перед формулой НСl в правой части уравнения необходимо поставить коэффициент «2». Если теперь сложить количества атомов элементов, участвующих в данной реакции, и слева и справа, то получим следующий баланс:
В обеих частях уравнения количества атомов элементов, участвующих в реакции, равны, следовательно оно составлено правильно.
Химические уравнение и химические реакции
Как мы уже выяснили, химические уравнения являются отражением химических реакций. Химическими реакциями называются такие явления, в процессе которых происходит превращение одних веществ в другие. Среди их многообразия можно выделить два основных типа:
1). Реакции соединения
2). Реакции разложения.
В подавляющем своём большинстве химические реакции принадлежат к реакциям присоединения, поскольку с отдельно взятым веществом редко могут происходить изменения в его составе, если оно не подвергается воздействиям извне (растворению, нагреванию, действию света). Ничто так не характеризует химическое явление, или реакцию, как изменения, происходящие при взаимодействии двух и более веществ. Такие явления могут осуществляться самопроизвольно и сопровождаться повышением или понижением температуры, световыми эффектами, изменением цвета, образованием осадка, выделением газообразных продуктов, шумом.
Для наглядности приведём несколько уравнений, отражающих процессы реакций соединения, в процессе которых получаются хлорид натрия (NaCl), хлорид цинка (ZnCl2), осадок хлорида серебра (AgCl), хлорид алюминия (AlCl3)
Cl2 + 2Nа = 2NaCl (4)
СuCl2+ Zn= ZnCl2 + Сu (5)
AgNO3 + КCl = AgCl+ 2KNO3 (6)
3HCl+ Al(OH)3 = AlCl3 + 3Н2О (7)
Cреди реакций соединения следует особым образом отметить следующие: замещения (5), обмена (6), и как частный случай реакции обмена – реакцию нейтрализации (7).
К реакциям замещения относятся такие, при осуществлении которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. В примере (5) атомы цинка замещают из раствора СuCl2 атомы меди, при этом цинк переходит в растворимую соль ZnCl2, а медь выделяется из раствора в металлическом состоянии.
К реакциям обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.В случае реакции (6) растворимые соли AgNO3 и КCl при сливании обоих растворов образуют нерастворимый осадок соли AgCl. При этом они обмениваются своими составными частями – катионами и анионами. Катионы калия К+ присоединяются к анионам NO3, а катионы серебра Ag+ – к анионам Cl–.
К особому, частному случаю, реакций обмена относится реакция нейтрализации. К реакциям нейтрализации относятся такие реакции, в процессе которых кислоты реагируют с основаниями, в результате образуется соль и вода. В примере (7) соляная кислота HCl, реагируя с основанием Al(OH)3 образует соль AlCl3 и воду. При этом катионы алюминия Al3+ от основания обмениваются с анионами Сl– от кислоты. В итоге происходит нейтрализация соляной кислоты.
К реакциям разложения относятся такие, при котором из одного сложного образуются два и более новых простых или сложных веществ, но более простого состава. В качестве реакций можно привести такие, в процессе которых разлагаются 1). Нитрат калия(КNO3) с образованием нитрита калия (КNO2) и кислорода (O2); 2). Перманганат калия (KMnO4): образуются манганат калия (К2МnO4), оксид марганца (MnO2) и кислород (O2); 3). Карбонат кальция или мрамор; в процессе образуются углекислый газ (CO2) и оксид кальция (СаО)
2КNO3 =2КNO2 + O2 (8)
2KMnO4 = К2МnO4 + MnO2 + O2 (9)
СаCO3 = CaO + CO2 (10)
В реакции (8) из сложного вещества образуется одно сложное и одно простое. В реакции (9) – два сложных и одно простое. В реакции (10) – два сложных вещества , но более простых по составу
Разложению подвергаются все классы сложных веществ:
1). Оксиды: оксид серебра 2Ag2O = 4Ag + O2 (11)
2). Гидроксиды: гидроксид железа 2Fe(OH)3 = Fe2O3 + 3H2O (12)
3). Кислоты: серная кислота H2SO4 = SO3 + H2O (13)
4). Соли: карбонат кальция СаCO3 = СаO + CO2 (14)
5). Органические вещества: спиртовое брожение глюкозы
С6Н12О6 = 2С2Н5ОH + 2CO2 (15)
Согласно другой классификации, все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты – эндотермические. Критерием таких процессов является тепловой эффект реакции. Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана:
СН4 + 2O2 = СО2 + 2Н2О + Q (16)
а к эндотермическим реакциям – реакции разложения, уже приводимые выше (11) – (15). Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+Q) или поглощается (-Q):
СаCO3 = СаO+CO2 – Q (17)
Можно так же рассматривать все химические реакции по типу изменения степени окисления, участвующих в их превращениях элементов. К примеру, в реакции (17) участвующие в ней элементы не меняют свои степени окисления:
Са+2C+4O3-2 = Са+2O-2+C+4O2-2 (18)
А в реакции (16) элементы меняют свои степени окисления:
2Mg0 + O20 = 2Mg+2O-2
Реакции такого типа относятся к окислительно-восстановительным. Они будут рассматриваться отдельно. Для составления уравнений по реакциям такого типа необходимо использовать метод полуреакцийи применять уравнение электронного баланса.
После приведения различных типов химических реакций, можно приступать к принципу составлений химических уравнений, иначе, подбору коэффициентов в левой и правой их частях.
СЛОЖНА-А-А 🙀 Ты же знаешь, что если не разобраться в теме сейчас, то потом придется исправлять оценки. Беги на бесплатное онлайн-занятие с репетитором (подробности тут + 🎁).
Механизмы составления химических уравнений.
К какому бы типу ни относилась та или иная химическая реакция, её запись ( химическое уравнение) должна соответствовать условию равенства количества атомов до реакции и после реакции.
Существуют такие уравнения (17), которые не требуют уравнивания, т.е. расстановки коэффициентов. Но в большинстве случаях, как в примерах (3), (7), (15), необходимо предпринимать действия, направленные на уравнивание левой и правой частей уравнения. Какими же принципами необходимо руководствоваться в таких случаях? Существует ли какая ни будь система в подборе коэффициентов? Существует, и не одна. К таковым системам относятся:
1). Подбор коэффициентов по заданным формулам.
2). Составление по валентностям реагирующих веществ.
3). Составление по степеням окисления реагирующих веществ.
В первом случае полагается, что нам известны формулы реагирующих веществ как до реакции, так и после. К примеру, дано следующее уравнение:
N2 + О2 →N2О3 (19)
Принято считать, что пока не установлено равенство между атомами элементов до реакции и после, знак равенства (=) в уравнении не ставится, а заменяется стрелкой (→). Теперь приступим к собственно уравниванию. В левой части уравнения имеются 2 атома азота (N2) и два атома кислорода (О2), а в правой – два атома азота (N2) и три атома кислорода (О3). По количеству атомов азота его уравнивать не надо, но по кислороду необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало три атома. Составим следующую схему:
до реакции после реакции
О2 О3
Определим наименьшее кратное между данными количествами атомов, это будет «6».
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение:
N2 + 3О2 →N2О3
Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
N2 + 3О2 → 2N2О3
Количества атомов кислорода и в левой и в правой частях уравнения стали равны, соответственно по 6 атомов:
3О2 → 2О3
Но количество атомов азота в обеих частях уравнения не будут соответствовать друг другу:
N2→ 2N2
В левой – два атома, в правой – четыре атома. Следовательно, что бы добиться равенства, необходимо удвоить количество азота в левой части уравнения, поставив коэффициент «2»:
2N2→ 2N2
Таким образом, равенство по азоту соблюдено и в целом, уравнение примет вид:
2N2 + 3О2 → 2N2О3
Теперь в уравнении можно вместо стрелки поставит знак равенства:
2N2 + 3О2 = 2N2О3 (20)
Приведём другой пример. Дано следующее уравнение реакции:
Р + Cl2→ РCl5
В левой части уравнения имеется 1 атом фосфора (Р) и два атома хлора (Cl2), а в правой – один атом фосфора (Р) и пять атомов кислорода (Cl5). По количеству атомов фосфора его уравнивать не надо, но по хлору необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало пять атома. Составим следующую схему:
до реакции после реакции
Cl2 Cl5
Определим наименьшее кратное между данными количествами атомов, это будет «10».
Cl2 Cl5
10 /
Разделим это число в левой части уравнения по хлору на «2». Получим число «5», поставим его в решаемое уравнение:
Р + 5Cl2→ РCl5
Так же разделим число «10» для правой части уравнения на «5». Получим число «2», так же поставим его в решаемое уравнение:
Р + 5Cl2→ 2РCl5
Количества атомов хлора и в левой и в правой частях уравнения стали равны, соответственно по 10 атомов:
5Cl2→ 2Cl5
Но количество атомов фосфора в обеих частях уравнения не будут соответствовать друг другу:
Р → 2Р
Следовательно, что бы добиться равенства, необходимо удвоить количество фосфора в левой части уравнения, поставив коэффициент «2»:
2Р → 2Р
Таким образом, равенство по фосфору соблюдено и в целом, уравнение примет вид:
2Р + 5Cl2= 2РCl5 (21)
При составлении уравнений по валентностям необходимо дать определение валентности и установить значения для наиболее известных элементов. Валентность – это одно из ранее применяемых понятий, в настоящее время в ряде школьных программ не используется. Но при его помощи легче объяснить принципы составления уравнений химических реакций. Под валентностью понимают число химических связей, которые тот или иной атом может образовывать с другим, или другими атомами. Валентность не имеет знака ( + или – ) и обозначается римскими цифрами, как правило, над символами химических элементов, например:
I II III IV V
H O N S Р
Откуда берутся эти значения? Как их применять при составлении химических уравнений? Числовые значения валентностей элементов совпадают с их номером группы Периодической системы химических элементов Д. И. Менделеева (Таблица 1).
Для других элементов значения валентностей могут иметь иные значения, но никогда не больше номера группы, в которой они расположены. Причём для чётных номеров групп (IV и VI ) валентности элементов принимают только чётные значения, а для нечётных – могут иметь как чётные, так и нечётные значения (Таблица.2).
Конечно же, в значениях валентностей для некоторых элементов имеются исключения, но в каждом конкретном случае эти моменты обычно оговариваются. Теперь рассмотрим общий принцип составления химических уравнений по заданным валентностям для тех или иных элементов. Чаще всего данный метод приемлем в случае составления уравнений химических реакций соединения простых веществ, например, при взаимодействии с кислородом (реакции окисления). Допустим, необходимо отобразить реакцию окисления алюминия. Но напомним, что металлы обозначаются единичными атомами (Al), а неметаллы, находящиеся в газообразном состоянии – с индексами «2» – (О2). Сначала напишем общую схему реакции:
Al + О2 →AlО
На данном этапе ещё не известно, какое правильное написание должно быть у оксида алюминия. И вот именно на данном этапе нам на помощь придёт знание валентностей элементов. Для алюминия и кислорода проставим их над предполагаемой формулой этого оксида:
III II
Al О
После чего «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III II
Al2 О3
Состав химического соединения Al2О3 определён. Дальнейшая схема уравнения реакции примет вид:
Al+ О2 →Al2О3
Остаётся только уравнять левую и правую его части. Поступим таким же способом, как в случае составления уравнения (19). Количества атомов кислорода уравняем, прибегая к нахождению наименьшего кратного:
до реакции после реакции
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение. Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
Al + 3О2 → 2Al2О3
Что бы добиться равенства по алюминию, необходимо скорректировать его количество в левой части уравнения, поставив коэффициент «4»:
4Al + 3О2 → 2Al2О3
Таким образом, равенство по алюминию и кислороду соблюдено и в целом, уравнение примет окончательный вид:
4Al + 3О2 = 2Al2О3 (22)
Применяя метод валентностей, можно прогнозировать, какое вещество образуется в процессе химической реакции, как будет выглядеть его формула. Допустим, в реакцию соединения вступили азот и водород с соответствующими валентностями III и I. Напишем общую схему реакции:
N2 + Н2 → NН
Для азота и водорода проставим валентности над предполагаемой формулой этого соединения:
III I
N Н
Как и прежде «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III I
N Н3
Дальнейшая схема уравнения реакции примет вид:
N2 + Н2 → NН3
Уравнивая уже известным способом, через наименьшее кратное для водорода, равное «6»,получим искомые коэффициенты, и уравнение в целом:
N2 + 3Н2 = 2NН3 (23)
При составлении уравнений по степеням окисления реагирующих веществ необходимо напомнить, что степенью окисления того или иного элемента называется число принятых или отданных в процессе химической реакции электронов. Степень окисления в соединениях в основном, численно совпадает со значениями валентностей элемента. Но отличаются знаком. Например, для водорода валентность равна I, а степень окисления (+1) или (-1). Для кислорода валентность равна II, а степень окисления (-2). Для азота валентности равны I,II,III,IV,V, а степени окисления (-3), (+1), (+2), (+3), (+4), (+5) и т.д. Степени окисления наиболее часто применяемых в уравнениях элементов, приведены в таблице 3.
В случае реакций соединения принцип составления уравнений по степеням окисления такой же, как и при составлении по валентностям. Например, приведём уравнение реакции окисления хлора кислородом, в которой хлор образует соединение со степенью окисления +7. Запишем предполагаемое уравнение:
Cl2 + О2 →ClО
Поставим над предполагаемым соединением ClО степени окисления соответствующих атомов:
+7 -2
Cl О
Как и в предыдущих случаях установим, что искомая формула соединения примет вид:
+7 -2
Cl2О7
Уравнение реакции примет следующий вид:
Cl2 + О2 → Cl2О7
Уравнивая по кислороду, найдя наименьшее кратное между двумя и семи, равное «14», установим в итоге равенство:
2Cl2 + 7О2 = 2Cl2О7 (24)
Несколько иной способ необходимо применять со степенями окисления при составлении реакций обмена, нейтрализации, замещения. В ряде случаев предоставляется затруднительным узнать: какие соединения образуются при взаимодействии сложных веществ?
Как узнать: что получится в процессе реакции?
Действительно, как узнать: какие продукты реакции могут возникнут в ходе конкретной реакции? К примеру, что образуется при взаимодействии нитрата бария и сульфата калия?
Ва(NО3) 2 + К2SO4 → ?
Может быть ВаК2(NО3) 2 + SO4 ?Или Ва + NО3SO4 + К2? Или ещё что-то? Конечно же, в процессе этой реакции образуются соединения: ВаSO4 и КNО3 . А откуда это известно? И как правильно написать формулы веществ? Начнём с того, что чаще всего упускается из вида: с самого понятия «реакция обмена». Это значит, что при данных реакциях вещества меняются друг с другом составными частями. Поскольку реакции обмена в большинстве своём осуществляются межу основаниями, кислотами или солями, то частями, которыми они будут меняться, являются катионы металлов ( Na+, Mg2+,Al3+,Ca2+,Cr3+), ионов Н+ или ОН–, анионов – остатков кислот,(Cl–, NO32-,SO32-, SO42-, CO32-, PO43-). В общем виде реакцию обмена можно привести в следующей записи:
Kt1An1 + Kt2An1 = Kt1An2 + Kt2An1 (25)
Где Kt1 и Kt2 – катионы металлов (1) и (2), а An1 и An2 – соответствующие им анионы (1) и (2). При этом обязательно надо учитывать, что в соединениях до реакции и после реакции на первом месте всегда устанавливаются катионы, а анионы – на втором. Следовательно, если в реакцию вступит хлорид калия и нитрат серебра, оба в растворённом состоянии
KCl + AgNO3→
то в процессе её образуются вещества KNO3 и AgClи соответствующее уравнение примет вид:
KCl + AgNO3=KNO3 + AgCl (26)
При реакциях нейтрализации протоны от кислот (Н+) будут соединяться с анионами гидроксила (ОН–) с образованием воды (Н2О):
НCl + КОН = КCl + Н2O (27)
Степени окисления катионов металлов и заряды анионов кислотных остатков указаны в таблице растворимости веществ (кислот, солей и оснований в воде). По горизонтали приведены катионы металлов, а по вертикали – анионы кислотных остатков.
Исходя из этого, при составлении уравнения реакции обмена, необходимо вначале в левой его части установить степени окисления принимающих в этом химическом процессе частиц. Например, требуется написать уравнение взаимодействия между хлоридом кальция и карбонатом натрия.Составим исходную схему этой реакции:
СаCl + NаСО3 →
Над катионами и анионами проставим соответствующие заряды:
Са2+Cl– + Nа+СО32- →
Совершив уже известное действие «крест»-на-«крест», определим реальные формулы исходных веществ:
СаCl2 + Nа2СО3 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ:
СаCl2 + Nа2СО3 → СаСО3 + NаCl
Над их катионами и анионами проставим соответствующие заряды:
Са2+СО32- + Nа+Cl–
Формулы веществ записаны правильно, в соответствии с зарядами катионов и анионов. Составим полное уравнение, уравняв левую и правую его части по натрию и хлору:
СаCl2 + Nа2СО3 = СаСО3 + 2NаCl (28)
В качестве другого примера приведём уравнение реакции нейтрализации между гидроксидом бария и ортофосфорной кислотой:
ВаОН + НРО4 →
Над катионами и анионами проставим соответствующие заряды:
Ва2+ ОН– + Н+РО43- →
Определим реальные формулы исходных веществ:
Ва(ОН)2 + Н3РО4 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ, учитывая, что при реакции обмена одним из веществ обязательно должна быть вода:
Ва(ОН)2 + Н3РО4 → Ва2+ РО43- + Н2O
Определим правильную запись формулы соли, образовавшейся в процессе реакции:
Ва(ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Уравняем левую часть уравнения по барию:
3Ва (ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Поскольку в правой части уравнения остаток ортофосфорной кислоты взят дважды, (РО4)2, то слева необходимо также удвоить её количество:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + Н2O
Осталось привести в соответствие количество атомов водорода и кислорода в правой части у воды. Так как слева общее количество атомов водорода равно 12, то справа оно так же должно соответствовать двенадцати, поэтому перед формулой воды необходимо поставить коэффициент «6» (поскольку в молекуле воды уже имеется 2 атома водорода). По кислороду так же соблюдено равенство: слева 14 и справа 14. Итак, уравнение имеет правильную форму записи:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + 6Н2O (29)
Возможность осуществления химических реакций
Мир состоит из великого множества веществ. Неисчислимо так же количество вариантов химических реакций между ними. Но можем ли мы, написав на бумаге то или иное уравнение утверждать, что ему будет соответствовать химическая реакция? Существует ошибочное мнение, что если правильно расставить коэффициенты в уравнении, то оно будет осуществимо и на практике. Например, если взять раствор серной кислоты и опустить в него цинк, то можно наблюдать процесс выделения водорода:
Zn+ H2SO4 = ZnSO4 + H2 (30)
Но если в этот же раствор опустить медь, то процесс выделения газа наблюдаться не будет. Реакция не осуществима.
Cu+ H2SO4≠
В случае, если будет взята концентрированная серная кислота, она будет реагировать с медью:
Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2O (31)
В реакции (23) между газами азотом и водородом наблюдается термодинамическое равновесие, т.е. сколько молекул аммиака NН3 образуется в единицу времени, столько же их и распадётся обратно на азот и водород. Смещение химического равновесия можно добиться повышением давления и понижением температуры
N2 + 3Н2 = 2NН3
Если взять раствор гидроксида калия и прилить к нему раствор сульфата натрия, то никаких изменений наблюдаться не будет, реакция будет не осуществима:
КОН + Na2SO4 ≠
Раствор хлорида натрия при взаимодействии с бромом не будет образовывать бром, несмотря на то, что данная реакция может быть отнесена к реакции замещения:
NаCl + Br2≠
В чём же причины таких несоответствий? Дело в том, что оказывается недостаточно только правильно определять формулы соединений, необходимо знать специфику взаимодействия металлов с кислотами, умело пользоваться таблицей растворимости веществ, знать правила замещения в ряду активности металлов и галогенов. В этой статье излагаются только самые основные принципы как расставить коэффициенты в уравнениях реакций, как написать молекулярные уравнения, как определить состав химического соединения.
Химия, как наука, чрезвычайно разнообразна и многогранна. В приведённой статье отражена лишь малая часть процессов, происходящих в реальном мире. Не рассмотрены типы окислительно-восстановительных реакций, термохимические уравнения, электролиз, процессы органического синтеза и многое, многое другое. Но об этом в следующих статьях.
Молодец! Раз ты дочитал это до конца, вероятно, ты все отлично усвоил. Но если вдруг что-то еще непонятно – попробуй онлайн-занятие с репетитором (подробности тут + 🎁).
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.